Энцефалопатия — это комплекс неврологических и психических расстройств, связанных с очаговым поражением головного мозга. В зависимости от этиологии выделяют несколько форм этого заболевания: дисциркуляторную, которая обусловлена патологией кровообращений и чаще встречается в пожилом возрасте, травматическая, возникающая обычно у спортсменов после неоднократных черепно-мозговых травм, гипоксическая и др. Энцефалопатия токсического генеза развивается из-за прямого повреждающего действия на головной мозг различных ядовитых веществ. Патология может встречаться в любом возрасте, в том числе и у детей, но клиническое течение и прогноз во многом зависят от общего состояния здоровья и своевременного начала лечения. Лечится ли эта патология? Доктора клиник «Лето» убеждены, что при быстрой детоксикации и устранении действия токсина шанс на полное восстановление функционирования центральной нервной системы (ЦНС) очень высок.
Токсическая энцефалопатия головного мозга: что за болезнь, основные причины
В основе токсикогенного действия большинства нейротропных ядов лежит их негативное влияние непосредственно на мембраны нейронов и механизмы передачи нервного импульса. Далеко не последнюю роль в патогенезе заболевания играют нарушения энергетического и пластического обмена. Кроме того, некоторые токсины угнетают систему кроветворения и кровообращения, дыхания, что также становится причиной токсической гипоксической энцефалопатии. В силу особенностей анатомического строения к влиянию патологических факторов особенно чувствительны клетки, локализованные в коре больших полушарий, мозжечке и гиппокампе, что и обуславливает клинические проявления болезни.
Основные нейротоксины
К главным причинам токсической энцефалопатии относят:
алкоголь и летучие растворители: разрушают клеточные мембраны, рецепторы, вызывают изменения (при длительном воздействии необратимые) энергообмена;- психоактивные вещества (опиаты, каннабиноиды, амфетамины, кокаин, эфедрон, галлюциногены, некоторые лекарственные препараты и др.): патологически влияют на систему обратного захвата и выработку норадреналина, дофамина и серотонина
- тяжелые металлы (ртуть, свинец, марганец, мышьяк, таллий и т.д.): оказывают прямое разрушающее действие на структуры ЦНС, также влияют на функционирование периферической нервной системы.
Соответственно, риск возникновения токсической энцефалопатии мозга особенно высок у лиц, работающих на вредных производствах. Это, например, химическое, строительное, металлургия, сельское хозяйство, где применяют инсектициды и пестициды. Заболевание нередко диагностируют при алкоголизме, наркозависимости. Реже патология встречается у художников, в группу риска попадают те, кто использует нейротоксичные растворители для красок.
Причины развития алкогольных энцефалопатий
Причиной развития данного заболевания в подавляющем большинстве случаев становится длительное употребление больших доз алкоголя. Как правило, появлению первых симптомов предшествуют запои, продолжающиеся в течение недель или месяцев, либо привычный ежедневный прием спиртного в течение многих лет. Риск возникновения заболевания повышается при употреблении технических жидкостей и суррогатов алкоголя. Иногда из-за индивидуальных особенностей организма пациента болезнь развивается при отсутствии алкоголизма, на фоне регулярного употребления небольших доз алкоголя или редких алкогольных эксцессов.
В основе заболевания лежат нарушения обмена веществ, характерных для алкоголизма. Ведущую роль играет недостаток витаминов (прежде всего – группы В). При постоянном употреблении алкоголя потребность организма в витамине В1 повышается, а его уровень снижается. Это обусловлено нерегулярным однообразным питанием, отсутствием аппетита во время запоев, ухудшением всасывания витамина В1 в кишечнике и нарушениями функции печени. Следствием дефицита В1 становятся обменные расстройства в головном мозге. Проблема усугубляется недостатком витамина P и В6. Из-за дефицита этих витаминов еще больше нарушаются функции пищеварительной системы, а капилляры в головном мозге становятся более проницаемыми, что может привести к отеку головного мозга.
В зависимости от скорости развития, преобладающих симптомов, особенностей течения и вариантов исхода различают две группы алкогольных энцефалопатий: острые и хронические. К числу острых энцефалопатий относят геморрагический полиэнцефалит (синдром Гайе-Вернике), митигированную острую энцефалопатию и энцефалопатию с молниеносным течением. В анамнезе у больных, страдающих хроническими энцефалопатиями, как правило, выявляются тяжелые алкогольные психозы или острые энцефалопатии. Существует две формы хронической алкогольной энцефалопатии: корсаковский психоз (алкогольный паралич, полиневритический психоз) и алкогольный псевдопаралич.
Клинические проявления токсической энцефалопатии
Признаки заболевания и особенности течения во многом зависят от нейротоксина, который и вызвал подобное состояние. По выраженности и длительности сохранения симптомов заболевание может быть острым и хроническим. Но даже и острая форма редко проходит без каких-либо последствий. На протяжении длительного срока (а в некоторых случаях — всей жизни) сохраняются остаточные явления. Как правило, это:
- регулярные головные боли с головокружениями;
- общая слабость, повышенная утомляемость;
- раздражительность;
- нарушения сна (затрудненное засыпание, частые пробуждения, кошмарные сновидения);
- синдром вегетативной дисфункции, который проявляется усиленным потоотделением, тремором пальцев вытянутых рук, снижением мышечного тонуса;
- когнитивные расстройства: ухудшение памяти и внимания, нередко больной испытывает трудности даже с чтением художественной литературы и просмотром телепередач и фильмов.
После перенесенной острой токсической энцефалопатии могут периодически возникать гипоталамические кризы, сопровождающиеся:
- усилением головной боли;
- подъемом артериального давления;
- болевым синдромом в области грудной клетки;
- ознобом с дрожью;
- приступами гневливости и раздражительности.
Симптомы острой формы заболевания
Подобный вариант недуга типичен для отравления тяжелыми металлами и летучими растворителями, при алкоголизме и наркомании встречаются относительно редко, обычно, на фоне уже существующего дефицита или нарушений обмена тиамина.
Клинические проявления патологии включают:
- глазодвигательные расстройства (паралич глаз, косоглазие, снижение реакции на световые раздражители);
- астазию и абазию (потеря возможности передвигаться без поддержки и помощи);
- генерализованный судорожный синдром;
- амнезию, причем нередко больной заменяет события, которые он не помнит, вымышленными;
- оральные автоматизмы;
- многократную рвоту;
- сильнейшую головную боль;
- повышение или снижение температуры тела;
- тахикардия;
- острый психоз.
Без своевременной медицинской помощи высок риск летального исхода из-за отека мозга, инсульта, острой дыхательной недостаточности.
Симптоматика хронической токсической энцефалопатии
При затяжном течении выделяют 5 стадий заболевания:
- Продромальная. Признаки недуга могут быть заметны только близким пациента. Обращают внимание на несобранность, рассеянность и забывчивость.
- Первая. Развивается апатия, снижается координация движений, возможен легкий тремор, типичны нарушения сна, ухудшение аппетита, похудание. Отмечают различные эмоциональные расстройства: чувство внутреннего напряжения и тревоги, страх.
- Вторая. На первый план выходят личностные и поведенческие нарушения, которые многие принимают за начальные симптомы деменции.
- Третья. Характерны речевые расстройства, выраженная дезориентация, снижение практически всех рефлексов.
- Четвертая. Токсическая энцефалопатия самой тяжелой степени: развивается кома с утратой всех неврологических функций.
Очень часто заболевание осложняется сопутствующими острыми и хроническими соматическими патологиями. Так, помимо неврологической симптоматики, нередко отмечают проявления со стороны желудочно-кишечного тракта, сердечно-сосудистой системы. Как правило, очень страдает иммунитет, что приводит к снижению сопротивляемости различным бактериальным, вирусным и грибковым инфекциям. И в таких случаях к действию нейротропного яда «присоединяется» негативное влияние продуктов жизнедеятельности патогенной микрофлоры — развивается инфекционно-токсическая энцефалопатия.
Перинатальная гипоксическая энцефалопатия
Факторы риска. Этиология и патогенез гипоксической энцефалопатии
Для распознавания клинических признаков перинатальной гипоксии необходимо учитывать факторы риска, предрасполагающие к ее развитию [8]: • Пограничный возраст матери (моложе 20 и старше 35 лет) • Преждевременная отслойка плаценты • Предлежание плаценты • Преэклампсия • Преждевременные или поздние роды • Окрашивание околоплодных вод меконием • Брадикардия, тахикардия плода, приглушение тонов сердца плода • Многоплодие • Длительный безводный промежуток • Диабет матери • Любые заболевания матери во время беременности • Прием матерью потенциально опасных для плода препаратов Среди причин нарушений вентиляции легких и оксигенации крови выделяют периферическую и центральную гипоксию. В периферической гипоксии принимает участие патология дыхательных путей или альвеолярного кровотока, в центральной гипоксии основой является нарушение функции дыхательного центра.
Этиология гипоксии
| Периферическая | Центральная |
| 1. Респираторный | 1. Пониженное давление |
| дистресс-синдром | у матери |
| 2. Аспирация околоплодных | 2. Анемия матери |
| вод | |
| 3. Пневмоторакс | 3. Артериальная гипертензия |
| (с родовой травмой) | |
| 4. Бронхолегочная | 4. Плацентарная |
| дисплазия | недостаточность |
| 5. Врожденные аномалии (синдром Пьера — Робена) | 5. Пороки развития мозга |
Гипоксия приводит к нарушению окислительных процессов, развитию ацидоза, снижению энергетического баланса клетки, избытку нейромедиаторов, нарушению метаболизма глии и нейронов. Ацидоз увеличивает проницаемость сосудистой стенки с развитием межклеточного отека и нарушением церебральной гемодинамики. В условиях гипоксии нарушается перекисное окисление липидов с накоплением агрессивных свободных радикалов, гидроперекисей, которые оказывают деструктивное действие на мембраны нейронов. Нарушения церебральной гемодинамики ишемическо-геморрагического характера являются следствием тяжелой гипоксии мозга. В антенатальном периоде основным этиологическим фактором гипоксии является плацентарная недостаточность [2,9]. Трофическая недостаточность протекает с нарушением всасываемости и усвоением питательных веществ через плаценту, дефицитом транспорта кислорода и углекислоты, что проявляется синдромом задержки развития плода, внутриутробной гипотрофией, незрелостью легких и сурфактанта. Установлено, что снижение маточно-плацентарного кровотока служит объективным показателем гипоксического поражения мозга [4]. Дефицит сурфактанта и дыхательная аноксия служат основными патогенетическими факторами церебральной гипоксии недоношенных и новорожденных от больных диабетом матерей. В патогенезе дефицита сурфактанта новорожденных лежит вторичный гиперинсулинизм плода, который развивается в ответ на гликемию матери. Инсулин тормозит синтез лецитина — основного элемента сурфактанта, недостаток которого препятствует разлипанию альвеол, что и приводит к нарушению вентиляции легких. Таким образом, компенсация диабета беременных является профилактикой дыхательного дисстресс-синдрома новорожденных и гипоксической энцефалопатии [15]. В неонатальном периоде причиной церебральной гипоксии и ишемии может быть выраженный интрапульмональный шунт. В патогенезе гипоксии мозга значительную роль играют гипоксическая кардиопатия новорожденных и надпочечниковая недостаточность. Гипогликемия и дефицит запаса гликогена рассматриваются как факторы, обусловливающие повышенную ранимость мозговой ткани к гипоксии новорожденных, особенно недоношенных с низкой массой тела.
Морфология гипоксической энцефалопатии
Головной мозг в норме поглощает пятую часть кислорода, поступающего в организм. У детей раннего возраста доля мозга в использовании кислорода составляет почти половину, что обеспечивает высокий уровень метаболизма окислительных процессов. В зависимости от длительности гипоксии в мозге развиваются изменения от локального отека до некрозов с геморрагическим пропитыванием. В ряде исследований было показано, что имеется различная чувствительность мозговых структур к гипоксии, которая зависит от особенностей метаболизма и кровоснабжения. Наиболее чувствительными к гипоксии являются зона Зоммера аммонова рога и перивентрикулярная область смежного кровоснабжения между передней, средней и задней мозговыми артериями. При сочетании гипоксии и ишемии возникают очаги некрозов в коре, зрительном бугре, полосатом теле, мозжечке. Выделяют следующие стадии морфологических гипоксических изменений в головном мозге: I стадия — отечно-геморрагическая, II стадия — энцефальный глиоз, III стадия — лейкомаляция (некроз), IV стадия — лейкомаляция с кровоизлиянием. Первые две стадии острой гипоксии являются курабельными, имеется возможность восстановления метаболизма нейронов и глии, III и IV стадии ведут к необратимой гибели нейронов. При антенатальной гипоксии наблюдаются дистрофия нейронов, пролиферация глии, явления склерозирования, кистозные полости на местах мелких очагов некрозов.
Клиника гипоксической энцефалопатии
В клинической картине гипоксической энцефалопатии выделяют три периода — острый (1-й месяц жизни ребенка), восстановительный (с 1-го месяца до 1 года, а у недоношенных незрелых детей до 2 лет) и исход [12]. В остром периоде по степени тяжести выделяются легкая форма поражений нервной системы, отражающая преходящие нарушения гемоликвородинамики; форма средней тяжести с отечно-геморрагическими изменениями, глиозом, единичными лейкомаляциями; тяжелая форма, характерная для генерализованного отека мозга, множественных лейкомаляций и кровоизлияний. Для определения степени тяжести и выраженности нарушений мозгового кровообращения применяется шкала Апгар. В остром периоде выделяют 5 клинических синдромов: повышение нервно-рефлекторной возбудимости, судорожный, гипертензионно-гидроцефальный, синдром угнетения, коматозный. Обычно наблюдается сочетание нескольких синдромов. Особенностью острого периода является доминирование общемозговых нарушений без выраженных локальных симптомов. При легкой форме поражения мозга (оценка по шкале Апгар 6 — 7 баллов) характерным является синдром повышенной нервно-рефлекторной возбудимости
. Основными проявлениями синдрома являются усиление спонтанной двигательной активности, беспокойный поверхностный сон, удлинение периода активного бодрствования, трудность засыпания, частый немотивированный плач, оживление безусловных врожденных рефлексов, мышечная дистония, повышение коленных рефлексов, тремор конечностей и подбородка. У недоношенных синдром нервно-рефлекторной возбудимости в 94% случаев является клиническим признаком понижения порога судорожной готовности, что подтверждается данными электроэнцефалографии (ЭЭГ) [12]. Больные, у которых, по данным ЭЭГ, имеется снижение порога судорожной готовности, должны рассматриваться в группе риска по судорожному синдрому. Среднетяжелая форма гипоксической энцефалопатии (оценивается по шкале Апгар 4 — 6 баллов) проявляется
гипертензионно-гидроцефальным синдромом и синдромом угнетения
.
Для гипертензионно-гидроцефального синдрома
характерным является увеличение размеров головы на 1 — 2 см по сравнению с нормой (или окружностью грудной клетки), раскрытие сагитального шва более 0,5 см, увеличение и выбухание большого родничка. Типичной является брахиоцефалическая форма головы с увеличенными лобными буграми или долихоцефалическая — с нависающим кзади затылком. Отмечается симптом Грефе, симптом «заходящего солнца», непостоянный горизонтальный нистагм, сходящее косоглазие. Выявляется мышечная дистония, больше в дистальных отделах конечностей в виде симптома «тюленьих лапок» и «пяточных стопок». У большинства детей, особенно в первые дни жизни, эти явления сочетаются с пароксизмами вздрагиваний, спонтанным рефлексом Моро, нарушением сна, симптомом Арлекино, общим и локальным цианозом. Развитие гипертензионно-гидроцефального синдрома на 3 — 5-й день жизни может являться признаком перивентрикулярного кровоизлияния. Гипертензионно-гидроцефальный синдром может быть изолированным, но чаще сочетается с синдромом угнетения или коматозным синдромом.
Синдром угнетения
проявляется вялостью, гиподинамией, снижением спонтанной активности, общей мышечной гипотонией, гипорефлексией, угнетением рефлексов новорожденных, снижением рефлексов сосания и глотания. Наблюдаются локальные симптомы в виде расходящегося и сходящегося косоглазия, нистагм, асимметрия и отвисание нижней челюсти, асимметрия мимической мускулатуры, бульбарные и псевдобульбарные симптомы. Синдром характеризует течение острого периода гипоксической энцефалопатии и в конце первого месяца жизни обычно исчезает. В остром периоде синдром угнетения может являться предвестником отека мозга и развития коматозного синдрома.
Коматозный синдром
является проявлением тяжелого состояния новорожденного, по шкале Апгар оценивается 1 — 4 балла. В клинической картине выявляются выраженная вялость, адинамия, мышечная гипотония до атонии, врожденные рефлексы не выявляются, зрачки сужены, реакция на свет незначительная или отсутствует. Нет реакции на болевые раздражители, «плавающие» движения глазных яблок, горизонтальный и вертикальный нистагм, сухожильные рефлексы угнетены. Дыхание аритмичное, с частыми апное, брадикардия, тоны сердца глухие, пульс аритмичный, артериальное давление низкое. Могут отмечаться приступы судорог с преобладанием тонического компонента. Тяжелое состояние сохраняется 10 — 15 дней, отсутствуют рефлексы сосания и глотания. Появление в остром периоде гидроцефалии с выбуханием и напряжением большого родничка, расхождением черепных швов, протрузией глазных яблок, быстрым ростом головы свидетельствует о внутричерепном кровоизлиянии.
Судорожный синдром
в остром периоде, как правило, сочетается с синдромом угнетения или коматозным. Возникает в результате гипоксического отека мозга, гипогликемии, гипомагнемии или внутричерепных кровоизлияний. Проявляется в первые дни жизни тонико-клоническими или тоническими судорогами. Наряду с этим наблюдаются локальные клонические судороги или гемиконвульсии. Судорожные припадки у новорожденных отличаются кратковременностью, внезапным началом, отсутствием закономерности повторения и зависимости от состояния сна или бодрствования, режима кормления и других факторов. Судороги наблюдаются в виде мелкоамплитудного тремора, кратковременной остановки дыхания, тонического спазма глазных яблок по типу пареза взора вверх, имитации симптома «заходящего солнца», нистагма, автоматических жевательных движений, пароксизмов клонуса стоп, вазомоторных реакций. Эти судороги по своему характеру иногда напоминают спонтанные движения ребенка, что затрудняет диагностику. Восстановительный период гипоксической энцефалоратии включает следующие синдромы: повышение нервно-рефлекторной возбудимости, гипертензионно-гидроцефальный, вегетовисцеральных дисфункций, двигательных нарушений, задержки психомоторного развития, эпилептический. Синдром повышенной нервно-рефлекторной возбудимости в восстановительном периоде имеет два варианта течения. При благоприятном варианте течения отмечается исчезновение или уменьшение выраженности симптомов повышенной нервно-рефлекторной возбудимости в сроки от 4 — 6 месяцев до 1 года. При неблагоприятном варианте, особенно у недоношенных, может развиться эпилептический синдром. Гипертензионно-гидроцефальный синдром имеет два варианта течения: 1) гипертензионно-гидроцефальный синдром с благоприятным течением, при котором наблюдается исчезновение гипертензионных симптомов при задержке гидроцефальных; 2) неблагоприятный вариант гипертензионно-гидроцефального синдрома, входящий в симптомокомплекс органического церебрального синдрома. Исходы гипертензионно-гидроцефального синдрома: 1. Нормализация роста окружности головы к 6 месяцам. 2. Компенсированный гидроцефальный синдром в 8 — 12 месяцев. 3. Развитие гидроцефалии.
Синдром вегето-висцеральных дисфункций
начинает проявляться после 1 — 1,5 месяца жизни на фоне повышения нервно-рефлекторной возбудимости и гипертензионно-гидроцефального синдрома. В клинической картине отмечаются упорные срыгивания, стойкая гипотрофия, нарушение ритма дыхания и апное, изменение окраски кожных покровов, акроцианоз, пароксизмы тахи- и брадипное, расстройства терморегуляции, дисфункция желудочно-кишечного тракта, височное облысение.
Эпилептический синдром
может проявляться в любом возрасте (как продолжение судорог после рождения или на фоне соматической инфекции). У новорожденных и грудных детей он имеет так называемое возрастное лицо, т. е. судорожные пароксизмы имитируют те двигательные возможности, которыми ребенок к моменту их появления обладает. У новорожденных и грудных детей (особенно у недоношенных) судорожный синдром характеризуется многообразием клинических форм припадков. Наблюдаются генерализованные судорожные припадки (тонико-клонические, клонические, тонические), абортивные, фокальные, гемиконвульсивные, полиморфные припадки, простые и сложные абсансы. По частоте преобладают полиморфные формы припадков. У недоношенных детей с перинатальной энцефалопатией пропульсивные и импульсивные пароксизмы в изолированном виде не встречаются, а наблюдаются только в составе полиморфных припадков. Наибольшую трудность в диагностике представляют абортивные и бессудорожные формы пароксизмов. Наблюдается имитация безусловных двигательных рефлексов в виде пароксизмально возникающих проявлений шейно-тонического симметричного рефлекса с наклоном головы и тоническим напряжением рук и ног; шейно-тонического асимметричного рефлекса с поворотом головы в сторону и разгибанием одноименной руки и ноги; первой фазы рефлекса Моро с раскрытием ручек. Бывают пароксизмы в виде спазма взора и нистагмом, имитацией «симптома заходящего солнца». Нередко наблюдаются приступы покраснения и побледнения кожных покровов с усиленным потоотделением, иногда срыгиваниями. После 3 — 4 месяцев жизни, по мере появления способности удерживать голову, появляются «кивки», «кливки», а с 6 — 7 месяцев — «поклоны» (сгибание туловища вперед-назад). Такие особенности судорожного синдрома у недоношенных детей, как нестабильность клинических проявлений с преобладанием полиморфных судорог, наличие абортивных форм припадков, а также сложных абсансов с имитацией безусловных рефлексов новорожденных (первой фазы рефлекса Моро, асимметричного шейно-тонического рефлекса) являются, вероятно, следствием незрелости структур головного мозга. Однако увеличение частоты припадков, нарастание полиморфизма их проявлений, резистентность к противосудорожной терапии должны настораживать в отношении формирования грубых органических форм поражения мозга. Полиморфизм приступов, их резистентность к терапии является прогностически неблагоприятным признаком.
Синдром двигательных нарушений
выявляется с первых недель жизни, может протекать с мышечной гипотонией или гипертонией. При появлении синдрома двигательных нарушений с мышечной гипотонией отмечается снижение спонтанной двигательной активности, угнетение сухожильных рефлексов и врожденных безусловных рефлексов новорожденных. Синдром двигательных нарушений с мышечной гипотонией встречается изолированно, а также в сочетании с гипертензионно-гидроцефальным синдромом, синдром повышенной нервно-рефлекторной возбудимости с понижением порога судорожной готовности. Неблагоприятно сочетание синдрома двигательных нарушений и судорожного синдрома. Нарастание мышечной гипертонии у доношенных детей, появление сторонности очаговых симптомов должны настораживать в плане развития детского церебрального паралича. Синдром задержки психомоторного развития начинает проявляться с 1 — 2 месяцев. В структуре синдрома отмечается нарушение редукции безусловных врожденных рефлексов. Большую диагностическую роль приобретает шейно-тонические симметричный и асимметричный рефлексы, задержка формирования выпрямительных лабиринтных цепных тонических рефлексов. При наличии в структуре данного синдрома задержки психического развития у детей к месячному возрасту наблюдается недостаточно устойчивая фиксация взгляда, кратковременное прослеживание с быстрым истощением. Нет реакции на голос матери, слухового сосредоточения. К 2 — 3-месячному возрасту наблюдается недостаточное оживление при общении, крик маловыразителен, гуление отсутствует, дети отыскивают источник звука глазами без поворота головы, появляется редкая, трудно вызываемая улыбка. К полугоду — недостаточно активно интересуются игрушками и окружающими предметами, недостаточно реагируют на присутствие матери, гуление малоактивное и непродолжительное, манипуляции с предметами задержаны, нет активного внимания. Если задержка развития является «темповой», она при правильном выхаживании начинает исчезать. Данная группа детей в 4 — 5 месяцев как бы «скачком» становится активнее, причем психическое развитие опережает моторное. Появляются эмоциональная реакция на окружающих, интерес к игрушкам. Возрастные двигательные функции начинают активно компенсироваться после 6 — 7 месяцев и, как правило, восстанавливаются к 1 — 1,5 годам. Прогностически неблагоприятна длительная задержка психического развития.
Диагностика
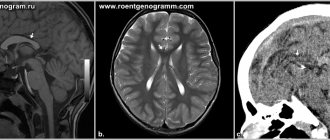
Исследование глазного дна в остром периоде легкой гипоксической энцефалопатии отклонений не выявляет, реже наблюдают умеренное полнокровие вен. При среднетяжелой степени отмечают расширение вен, отек, отдельные геморрагии. При тяжелой степени повреждения на фоне выраженного отека расширения сосудов отмечается стушеванность границ диска зрительного нерва, кровоизлияния. В дальнейшем у таких детей может обнаружиться атрофия сосков зрительных нервов. В спинномозговой жидкости изменения выявляются при наличии внутричерепного кровоизлияния. В этих случаях в ликворе имеются свежие и выщелочные эритроциты. После 7 — 10-го дня жизни подтверждением перенесенного кровоизлияния является наличие в ликворе макрофагов. Нейросонография
— двухмерное ультразвуковое исследование анатомических структур мозга через большой родничок — позволяет установить перивентрикулярное кровоизлияние, очаги лейкомаляции, расширение желудочковой системы — вентрикуломегалию [5, 10]. Нейросонография позволяет провести дифференциальную диагностику с пороками головного мозга. Признаки гипоплазии мозга: увеличение субарахноидальных пространств, расширение межполушарной щели, вентрикуломегалия, повышение плотности в области паренхимы мозга без четкой дифференциации извилин, порэнцефалия. Галопрозэнцефалия — увеличение одного желудочка, тени, повышение эхоплотности от стволовых структур мозга, снижение плотности от паренхимы мозга [7]. При клинико-нейросонографических сопоставлениях выявляется корреляция числа лейкомаляций и неврологических исходов. Множественные лейкомаляции в обоих полушариях, обнаруживаемые у больных по данным нейросонографии в остром периоде заболевания, сочетаются с синдромом двигательных нарушений и грубой задержкой психомоторного развития в восстановительном периоде. Компьютерная томография головного мозга помогает объективизировать гипоксические изменения мозговой ткани в структурах мозжечка и ствола мозга, которые недостаточно четко выявляются при нейросонографии.
Электроэнцефалографическое
(ЭЭГ) исследование выявляет очаги медленноволновой активности, очаги редукции корковой ритмики, очаги эпилептической активности. Большое значение ЭЭГ-исследование имеет для выделения группы риска по судорожному синдрому и диагностики клинически «немых» приступов. Косвенным подтверждением судорожного синдрома, а также признаком понижения порога судорожной готовности у больных является наличие пароксизмальных изменений ЭЭГ. Повторные припадки могут приводить к усилению выраженности пароксизмальной активности на ЭЭГ. Из биохимических исследований в остром периоде показателем глубины гипоксических нарушений является оценка ацидоза от смешанного до выраженного декомпенсированного метаболического. При тяжелой гипоксии нарастает осмотическое давление плазмы крови, увеличивается уровень лактатдегидрогеназы. Лактатдегидрогеназа и другие ферменты гликолиза коррелируют с тяжестью состояния детей и отражают выраженность гипоксии в остром периоде перинатальной энцефалопатии. Рентгенография легких используется для диагностики врожденных ателектазов, пневмопатии и воспалительных изменений легких.
Лечение острого периода
В остром периоде необходима своевременная коррекция респираторного дыхательного дисстресс-синдрома и адекватная вентиляция легких
. У недоношенных проводится эндотрахеальное введение колфосцерила пальмитата 5 мл/кг. Использование аналогов сурфактанта приводит к значительному регрессу неврологических синдромов гипоксической энцефалопатии. 1. Коррекция гомеостаза и гиповолемии: свежезамороженная плазма 5 — 10 мл/кг, 10% альбумин 5 — 10 мл/кг, реополиглюкин 7 — 10 мл/кг, гемодез 10 мл/кг. 2. Снижение проницаемости сосудов: 12,5% раствор этамзилата внутримышечно или внутривенно, 1% викасол 0,1 мл/кг. 3. Метаболическая и антиоксидантная терапия: пирацетам 50 мг/кг, 10% глюкоза 10 мл/кг, актовегин внутривенно, 5% витамин Е 0,1 мл в день. В качестве антиоксиданта используется соевое масло 2 — 3 мл 4 — 6 дней на кожу живота [11]. 4. Сосудистая терапия: винпоцетин 1мг/кг внутривенно. 5. Дегидратационная терапия: гидрокортизон 3 — 10 мг/кг, преднизолон 1 — 2 мг/кг, 25% магния сульфат 0,2 мл/кг. 6. Улучшение тканевого метаболизма сердечной мышцы: кокарбоксилаза 8 мг/кг, АТФ 10 мг/кг. 7. Антиконвульсантная терапия: диазепам 1мг/кг внутримышечно или внутривенно, ГОМК 50 мг/кг, барбитураты, когда бензодиазепины не эффективны, 5 мг/кг [14].
Лечение восстановительного периода
Лечение восстановительного периода проводится по синдромологическому принципу. 1. При синдроме повышенной нервно-рефлекторной возбудимости с проявлениями вегетовисцеральных дисфункций показаны седативные препараты: диазепам 0,001 г 2 раза в день, тазепам 0,001 г 2 раза в день, микстура с цитралью — раствор цитраля 2,0, магния сульфат 3,0, 10% раствор глюкозы 200,0 — по чайной ложке 3 раза в день; с 2-месячного возраста назначаются успокоительный коктейль из трав (корень валерианы, пустырник, шалфей) по 1 чайной ложке 3 раза в день. 2. При гипертензионно-гидроцефальном синдроме целесообразно назначать фуросемид 0, 002 г/кг в сутки с панангином, глицерол по 1 чайной ложке 3 раза в день. При выраженных проявлениях гипертензионно-гидроцефального синдрома используют ацетазоламид по 0,02 г/кг в сутки однократно по схеме: 3 дня — прием, 1 день перерыв, курс от 3 нед до 1 — 1,5 мес с панангином. 3. При синдроме двигательных нарушений: витамин В6 5 мг, витамин В1 2 мг, АТФ 0,5 мл 10 — 12 инъекций, пиритинол 10 — 20 капель на 1 кг массы тела 2 раза в день в первой половине дня 1 — 3 мес. Массаж. Лечебная гимнастика, проводится обучение матери навыкам реабилитации. 4. При синдроме задержки психомоторного развития: пирацетам 30 — 50 мг/кг в 3 приема, пиритинол. С 6 месяцев церебролизин 0,5 мл № 20 (противопоказан при судорожном синдроме), витамины В6, В1. Гамма-аминобутировая кислота по 0,06 г 2 — 3 раза в день. 5. При судорожном синдроме: вальпроат натрия 20 — 50 мг/кг, клоназепам до 1 — 2 мг в сутки, фенобарбитал 1 — 2 мг/кг. При резистентных судорогах ламотригин 1 — 2 мг/кг. 6. Хирургическое лечение применяется при сочетанных перивентрикулярных кровоизлияниях и развитии постгеморрагической гидроцефалии, проводится вентрикулярное шунтирование. Терапевтические мероприятия в дальнейшем индивидуализируются в зависимости от исхода процесса. К годовалому возрасту у большинства зрелых детей с появлением вертикализации и речевых функций можно выявить исходы перинатальной гипоксической энцефалопатии. Выздоровление наступает у 15 — 20% детей. Частыми последствиями перенесенной энцефалопатии являются минимальная мозговая дисфункция, гидроцефальный синдром. Наиболее тяжелыми исходами являются детский церебральный паралич и эпилепсия. Безусловно, успехи перинатальной медицины, адекватное ведение родов и острого периода гипоксической энцефалопатии позволят снизить психоневрологические исходы заболевания.
Литература:
1.Балан П.В., Маклакова А.С., Крушинская Я.В., Соколова Н.Л., Кудаков Н.И. Сравнительный анализ устойчивости к острой гипобарической гипоксии новорожденных и взрослых экспериментальных животных. Акуш. и гин. 1998;3:20-3. 2. Громыко Ю.Л. Оценка эффективности нового антиоксидантного препарата -актовегина для лечения плацентарной недостаточности и отставания в размерах плода. Материалы 1 съезда Российской ассоциации специалистов перинатальной медицины, 32. 3. Ивановская Т.Е., Покровская Л.Я. Основная патология перинатального периода по современным патологическим данным. Педиатрия 1987;4:11-7. 4. Кулаков В.И. Пренатальная медицина и репродуктивное здоровье женщины. Акуш. и гин. 1997;5:19-22. 5. Кузнецова Л.М, Дворяковский И.В., Мордова Н.А. Корреляция клинических и ультразвуковых признаков при ликвородинамических нарушениях у детей раннего возраста. Материалы научно-практической конференции. Калуга, 1980;34. 6. Миленин О.Б., Ефимов М.С. Применение синтетического сурфактанта экзосорфа в лечении и профилактике респираторного дисстресс-синдрома у новорожденных детей. Акуш. и гин. 1998;3:5-9. 7. Орлова Н.С., Мачинская Е.А., Фишкина Е.В. Нейросонография в диагностике некоторых пороков развития головного мозга. Материалы научно-практической конференции. Калуга. 1982;35. 8. Педиатрия (пер. англ.) / Под ред. Н.Н.Володина. М.,1996;125-70. 9. Федорова М.В. Плацентарная недостаточность. Акуш. и гин. 1997;5:40-3. 10. Фишкина Е.В., Симушин Г.П., Рубцова И.И. и др. Возможности нейросонографии в диагностике поражений центральной нервной системы у новорожденных детей. Материалы научно-практической конференции. Калуга. 1980;43. 11. Шарипов Р.Х. Применение препаратов мембраннотропного действия в комплексном лечении недоношенных детей с перинатальной энцефалопатией. Тезисы докладов научно-практической конференции. Самара. 1993;1:63. 12. Эдельштейн Э.А., Бондаренко Е.С., Быкова Л.И. Перинатальные гипоксические синдромы. Учебное пособие. М., 1988;38. 13. De Volder AG, Joffinet AM, Bol A, et al. Brain glucose metabolism in postanoxic syndrome. Arch Neurol 1990;47(2):197-204. 14. Carlier G, Guidi О, Dubru JM. Le traitement des convulsions d’enfant. Rev/med/ Liege. 1989;257-62. 15. J. VoIpe Neurology of the Newborn, coundres company. 1987;715.
Принципы диагностики
Постановка диагноза основывается на объективных симптомах, данных результатов лабораторного и инструментального обследования и анамнеза. Помимо обязательного осмотра у терапевта и невролога, показаны:
- общеклинический анализ крови и мочи;
- биохимический анализ крови с определением глюкозы, АЛТ, АСТ, билирубина, мочевины, креатининов и электролитов;
- по показаниям: анализ на определение иммуноспецифического статуса, нейроспецифических факторов;
- КТ, МРТ, ангиография;
- специфические анализы для выявления в организме тяжелых металлов и наркотических веществ.
При симптомах, свидетельствующих о поражении внутренних органов, могут потребоваться дополнительные исследования или консультации профильных специалистов. Дифференциальную диагностику проводят с другими формами энцефалопатий, нейродегенеративными заболеваниями.
Стоимость услуг
| КОНСУЛЬТАЦИИ СПЕЦИАЛИСТОВ | |
| Первичная консультация врача психиатра (60 мин.) | 6 000 руб. |
| Повторная консультация | 5 000 руб. |
| Консультация психиатра-нарколога (60 мин.) | 5 000 руб. |
| Консультация психолога | 3 500 руб. |
| Консультация Громовой Е.В. (50 минут) | 12 000 руб. |
| ПСИХОТЕРАПИЯ | |
| Психотерапия (сеанс) | 7 000 руб. |
| Психотерапия (5 сеансов) | 30 000 руб. |
| Психотерапия (10 сеансов) | 60 000 руб. |
| Групповая психотерапия (3-7 человек) | 3 500 руб. |
| Сеанс психотерапии у Громовой Е.В. (50 минут) | 12 000 руб. |
| ЛЕЧЕНИЕ В СТАЦИОНАРЕ | |
| Палата 4-х местное размещение | 10 000 руб./сутки |
| Палата 3-х местное размещение | 13 000 руб./сутки |
| Палата 1 местное размещение VIP | 23 000 руб./сутки |
| Индивидуальный пост | 5 000 руб. |
| ПИТ | 15 000 руб./сутки |
В данном перечне представлены не все цены на услуги, которые предоставляет наша клиника. С полным прайсом можно ознакомиться на странице «Цены», либо по телефону: 8(969)060-93-93. Первичная консультация БЕСПЛАТНА!
Клинические рекомендации по лечению токсической энцефалопатии
Основные принципы терапии заболевания состоят в следующем:
- восстановление и поддержание полноценного функционирования внутренних органов и систем;
- прекращение дальнейшего поступления нейротоксина в организм (ограничение трудовой деятельности, отказ от алкоголя и/или наркотиков и т.д.);
- форсирование метаболизма для максимально быстрого выведения яда, применение специфических антидотов;
- симптоматическое лечение.
В остром периоде терапию проводят строго в условиях стационара под круглосуточным наблюдением врача. По мере улучшения самочувствия пациента переводят на амбулаторный режим. На длительный курс прописывают:
- ноотропные препараты;
- средства, улучшающие метаболические процессы в мозге;
- нейропептиды;
- антиоксиданты;
- средства для нормализации тонуса церебральных сосудов;
- витамины и биологически активные добавки (группа В, никотинамид, рибоксин, янтарная, аскорбиновая кислота, глицин и т.д.);
- при необходимости — транквилизаторы из группы бензодиазепинов, антидепрессанты, снотворные.
Симптомы токсической энцефалопатии являются обязательным показанием для обращения к неврологу. Никакого лечения народными средствами — только комплексная, индивидуально подобранная терапия в сочетании с физиопроцедурами, коррекцией режима питания, изменением образа жизни. Не медлите с началом терапии! Для записи на прием или вызова профильного специалиста на дом, звоните нам по круглосуточному телефону 8(969)060-93-93.
Хронические алкогольные энцефалопатии
Корсаковский психоз чаще наблюдается у женщин, проявляется нарушениями памяти, ложными воспоминаниями и дезориентированностью. Пациенты плохо запоминают новую информацию, с трудом вспоминают о том, что происходило с ними до начала болезни. В беседе с больными выясняется, что они часто «вспоминают» события, которых не было в действительности. Ориентация в пространстве, месте и времени затруднена. Отмечается бедность речи и двигательных реакций. Выявляются неврологические расстройства в виде невритов. При отмене алкоголя симптомы заболевания могут редуцироваться.
Алкогольный псевдопаралич обычно возникает у мужчин. Возможно как постепенное развитие, так и быстрое прогрессирование симптомов после острого алкогольного психоза. Характерна деменция с утратой прежних знаний и навыков, расстройствами памяти и снижением критики к своему состоянию. Наблюдается огрубление (грубость, цинизм) в сочетании с резкими перепадами настроения. Неврологическая симптоматика представлена полиневритами, нарушениями речи, дрожанием мышц рук и лица.