Головной мозг человека является основным органом ЦНС. Его поверхностный слой состоит из множества нервных клеток, которые связаны между собой синаптической связью.
В рабочем состоянии находится всего 7% нейронов от общей численности, оставшаяся часть ожидает своей «очереди». Еще со школьного курса биологии известно, что одни клетки головного мозга сменяют другие в случае повреждения или полного отмирания.
Однако существует и анатомические отклонения, которые отрицательно сказываются на рабочих и нерабочих нейронах, тем самым убивая их, и разрушая связь между ними. Такая патология приводит к потере массы головного мозга и его функциональных способностей.
Отмирание нервных клеток головного мозга является вполне нормальным процессом, который происходит ежедневно. Но вся загвоздка в том, что при неврологических отклонениях, процесс атрофии охватывает значительно большее количество нейронов от нормы. Практически всегда это приводит к появлению и прогрессированию серьезных болезней, которые заканчиваются смертью.
Как гибнут церебральные нейроны…
Церебральная атрофия поражает лобные участки головного мозга (кора и подкорок). Именно эта зона отвечает за интеллектуально — мнестические функции и эмоции. Но эта болезнь классифицирована на несколько видов, которые имеют разную локацию:
- Кортикальная атрофия. Здесь деструкция происходит в тканях коры головного мозга. И чаще всего это появляется в процессе старения нервных клеток, но и не исключены другие патологические действия на головной мозг (ГМ) .
- Мультисистемное отмирание. Характеризуется повреждением мозжечка, ствола ГМ, базальных ядер. Имеет эффект нарастания.
- Диффузное отмирание затрагивает самые разные процессы в противоположных друг другу местах. Болезнь начинает свое действие в районе мозжечка, а далее появляются симптомы, которые характерны для других областей ГМ.
- Мозжечковое отмирание. Характерно мозжечковыми нарушениями с дополнительными патологическими процессами других частей ГМ.
- Задняя корковая. Вызывает атрофию нейронов в области затылка и темечка. Образуется скопления бляшек и клубков нейрофибриллярных сплетений, которые способствуют отмиранию.
Что подразумевается под отмиранием нейронов?
В общем случае атрофические изменения головного мозга не считаются болезнью. Атрофия может появиться не только в результате прогрессирования заболевания, но и сама стать причиной развития недуга.
Точнее говоря, атрофия головного мозга – это патологическая активность, которая разглаживает ткани мозговой коры, уменьшает размеры, вес и убивает нейронные сети ГМ. Следовательно, это затрагивает интеллектуальную деятельность и другие функции человека.
Данная патология больше всего присуща людям в старческом возрасте. Каждый знает о том, что люди в возрасте 70-80 лет начинают страдать слабоумием, частичной потерей памяти и аналогичными проблемами. Но и нельзя сказать, что такое не сможет случиться с молодым человеком или даже с новорожденным ребенком.
Такие изменения приводят к переменам в характере человека и его жизни. Отсюда мы и сделаем вывод. Под отмиранием нейронов головного мозга подразумевается:
- ухудшение или полная потеря памяти;
- речевые нарушения;
- нарушение моторики;
- снижение интеллекта.
Нехватка факторов питания для нервов
Многие теории относительно гибели мотонейронов в основном описывают нарушения внутриклеточных процессов. Существует доказательство того, что двигательные нейроны становятся более подвержены БАС из-за нехватки питательных веществ. Одна из групп таких веществ — это группа химических соединений, называемая нейротрофическими факторами, что буквально значит «питательные факторы для нейрона».
Клинические испытания по использованию подобных факторов для лечения БАС пока заканчивались неудачей. Новых лекарств изобретено не было. Однако был усвоен урок, который приведет к лучшим результатам исследований в будущем.
Что провоцирует смерть клеток головного мозга
Зачастую считается что внешние факторы, такие как черепно-мозговые травмы, злоупотребление алкоголем или наркотическими веществами являются главными провокаторами развития атрофической активности.
Но существуют и физиологические факторы, которые не менее активно этому сопутствуют:
- Инфекции ЦНС. Клетки ГМ могут отмирать в результате наличия бактерий, инфекций и других паразитов. Это может происходить как в течение нескольких часов, так и на протяжении долгих лет, в зависимости от типа инфекции.
- Иммунитет. Иногда проявляются болезни, при которых иммунная система начинает борьбу против человека, а, точнее против его нервных клеток. Обычно это наблюдается при рассеянном склерозе, когда происходит разрушение миелиновой оболочки нервных клеток.
- Бляшки. Как уже упомянуто выше, скопление бляшек играет свою роль в отмирании церебральных клеток. Процесс растягивается на долгие годы.
- Радиационные облучения. Внутри сильно воздействуют на организм, что это негативно сказывается на нейронах ГМ и проводит их к смерти.
- Биохимические повреждения нервной системы.
Существует также несколько патологических групп заболеваний в результате прогресса которых происходит атрофия мозга:
- Генетические болезни. В большинстве случаев болезнь развивается из-за наследственной предрасположенности. Есть несколько генетических заболеваний, с которыми атрофия идет рука об руку (нейрофиброматоз, деменция).
- Хроническая ишемия. Здесь отмирание нейронов наступает из-за кислородного голодания и недостатка питательных веществ. К этому приводит поражение сосудов в процессе активности болезни;
- Сосудистые болезни. Они делятся на несколько подтипов: ослабление сосудов – приводит к их протеканию, в результате чего кровь попадает в ткани мозга; рост кровеносных сосудов (Болезнь Гиппеля – Линдау, появление гемангиобластом); инсульт – патологическое явление, которое спровоцировано тромбами. Это приводит к дефициту поступающей крови к определенным частям ГМ.
- Болезни нервной системы. Заболевания, патологическое действие которых направлено на гибель нервных клеток.
Забастовка «редакторов» (обработка РНК)
Генетический код человека состоит из более, чем трех миллиардов символов и содержит «инструкции» к тому, как все должно быть построено в нашем теле. «Редакторы» необходимы для того, чтобы скопировать, собрать и перенести короткие участки кода, называемые РНК, которые содержат «инструкции» к сборке новых белков.
Изучая функции генов TDP-43 и FUS (это те самые «редакторы», нарушения в которых, как выяснилось недавно, являются причинами семейной формы БАС), исследователи пришли к выводу, что их роли в процессе «редактирования» очень похожи. Поэтому было выдвинуто предположение, что сбой в работе данных «редакторов» играет определенную роль в процессе развития болезни.
Как это выглядит?
Сперва, очень трудно заметить что-то подозрительное, так как снаружи происходят изменения только в характере человека. Человек становится рассеянным, вялым, иногда агрессивным и равнодушным. Через незначительное время, у человека появляются проблемы с памятью, снижение логики, потеря смысла действий, истощение словарного запаса.
В дополнение к этому, со временем отмирание клеток головного мозга сопровождается такими симптомами:
- постоянная агрессия;
- эгоизм;
- отсутствие самообладания;
- частая раздражительность;
- асоциальность;
- теряется абстрактное мышление;
- психические расстройства;
- депрессивность;
- заторможенность.
Симптомы будут отличаться в зависимости от места атрофии в головном мозгу.
Диагностика и дифдиагностика
Церебральная артрофи это болезнь, для диагностирования которой может понадобиться анамнез подробных сведений о пациенте.
Изучается история болезни, проводится опрос больного о его условиях жизни и самочувствии.
Но для точного установления диагноза, профессионалы отправляют больного на прохождение таких диагностических исследований:
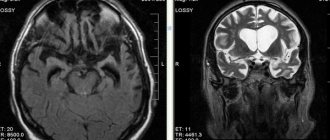
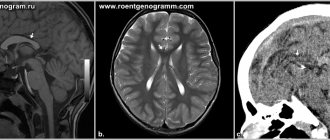
- КТ головы;
- диффузную оптическую томографию;
- МЭГ (измерение и визуализация магнитных полей);
- двухфотонной или однофотонной эмиссионной томографии;
- МРТ головы.
А также в редких случаях возможна дифференциальная диагностика. Имея анамнез пациента, при помощи специально созданной компьютерной программы можно установить диагноз методом исключения. По фактам и симптомам, которые проявляются у больного, компьютер сводит круг всевозможных болезней к одной.
При невозможности провести полную, можно сделать частичную дифференциальную диагностику.
Как остановить или затормозить отмирание клеток
Для того чтобы остановить болезнь, необходимо устранить ее причины. В большинстве случаев это сделать очень трудно, тем более, если учитывать тот факт, что нервные клетки не восстанавливаются – это невозможно.
Если отмирание клеток было диагностировано на начальной стадии, то его возможно остановить или хотя бы минимизировать последствия для головного мозга с помощью витаминных комплексов, укрепляющих клетки и антиоксидантов, блокирующих процесс окисления. Такое лечение направлено только на устранение симптомов. Сама атрофия не лечится современными препаратами.
Если говорить об образе жизни пациента, то здесь вся ответственность теперь ложится на плечи близких. Они должны обеспечить человека постоянным уходом. Больного нужно окружить заботой, обеспечить ему комфорт и отсутствие стрессовых ситуаций.
Пациенту нельзя избавлять от домашней работы, напротив, лучше будет если он займется своими привычными делами. Что касается стационарного лечения, то это только усугубит ситуацию. При акцентировании внимания на проблеме, больной больше переживает, что приводит к прогрессии отмирания клеток.
Спокойная и стабильная обстановка без перепадов сможет притормозить развитие заболевания, а в лучшем случае и остановить. Кроме этого можно использовать антидепрессанты или транквилизаторы, за счет чего можно избежать вспышек агрессии.
Клиническая картина
На начальных этапах симптоматика незаметна. Однако по мере прогрессирования могут появляться крайне неприятные сигналы:
- судороги или даже эпилептические припадки;
- потеря критичности к своим поступкам;
- ухудшения речи;
- проблемы с выражением мыслей;
- проблемы с памятью;
- ухудшение психоэмоционального состояния — когда развиваются депрессии, отмечается повышенная раздражительность, заметны перепады настроения;
- утрата эмпатии к другим людям и многое другое.
При появлении таких симптомов, которые должны насторожить если уж не самого человека, то его близких, следует обращаться к специалисту, чтобы определить причину проблемы. Так, например, проводят аппаратное обследование — чаще говорят про МРТ и КТ-диагностику, чтобы точно понять области повреждения мозга, объемы и прочие важные факторы. Кроме того, могут предложить обследование сосудов мозга и другие варианты. Далее уже принимается решение по терапии.
Как сохранить нейроны в целости и сохранности
Все профилактические меры заключаются в лечении и предупреждении болезней, которые способствуют отмиранию церебральных клеток. По статистике довольно часто такое явление наблюдаются у людей с заболеваниями нервной системы. Отсюда можно сделать вывод, что необходимо положительно мыслить, вести здоровый и активный образ жизни. Научно доказано, что позитивные люди живут дольше и не имеют подобных проблем со здоровьем.
Главным «другом» деменции, особенно в пожилом возрасте, является атеросклероз сосудов. Его появление к отмиранию клеток прибавляет и атрофию коры, что чревато функциональными нарушениями работы других жизненно важных органов.
Для того чтобы не дать «друзьям воссоединиться», необходимо:
- вести активный образ жизни;
- сбалансировать питание дабы не набирать лишнего веса;
- отказаться от никотина и алкогольной продукции;
- усилить иммунную систему;
- избегать стрессовых ситуаций и меньше волноваться;
- контролировать уровень сахара в крови.
А также следует уменьшить потребление холестерина и увеличить количество фруктов и овощей в рационе. Такие тенденции питания приводят состояние организма в норму.
Хроническая ишемия мозга
Цереброваскулярные заболевания являются одной из основных проблем современной медицины. Известно, что в последние годы структура сосудистых болезней мозга меняется за счет нарастания ишемических форм. Это обусловлено повышением удельного веса артериальной гипертензии и атеросклероза как основной причины цереброваскулярной патологии. При изучении отдельных форм нарушений мозгового кровообращения первое место по распространенности занимает хроническая ишемия.
Хроническая ишемия мозга (ХИМ) — особая разновидность сосудистой церебральной патологии, обусловленная медленно прогрессирующим диффузным нарушением кровоснабжения головного мозга с постепенно нарастающими разнообразными дефектами его функционирования. Термин «хроническая ишемия мозга» используется в соответствии с Международной классификацией болезней 10-го пересмотра вместо применявшегося ранее термина «дисциркуляторная энцефалопатия».
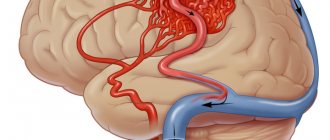
Развитию хронической ишемии мозга способствует ряд причин, которые принято называть факторами риска. Факторы риска делятся на корригируемые и некорригируемые. К некорригируемым факторам относятся пожилой возраст, пол, наследственная предрасположенность. Известно, например, что инсульт или энцефалопатия у родителей увеличивает вероятность сосудистых заболеваний у детей. На эти факторы нельзя повлиять, но они помогают заранее выявить лиц с повышенным риском развития сосудистой патологии и помочь предотвратить развитие болезни. Основными корригируемыми факторами развития хронической ишемии являются атеросклероз и гипертоническая болезнь. Сахарный диабет, курение, алкоголь, ожирение, недостаточная физическая нагрузка, нерациональное питание — причины, приводящие к прогрессированию атеросклероза и ухудшению состояния больного. В этих случаях нарушается свертывающая и противосвертывающая система крови, ускоряется развитие атеросклеротических бляшек. За счет этого просвет артерии уменьшается или полностью закупоривается (рис.). При этом особую опасность представляет кризовое течение гипертонической болезни: оно приводит к возрастанию нагрузки на сосуды головного мозга. Измененные атеросклерозом артерии не в состоянии поддерживать нормальный мозговой кровоток. Стенки сосуда постепенно истончаются, что в конечном счете может привести к развитию инсульта.
| Рисунок. МР-ангиограмма: окклюзия правой средней мозговой артерии |
Этиология ХИМ связана с окклюзирующими атеросклеротическими стенозами, тромбозами, эмболиями. Определенную роль играют посттравматическое расслоение позвоночных артерий, экстравазальные компрессии при патологии позвоночника или мышц шеи, деформация артерий с постоянными или периодическими нарушениями их проходимости, гемореологические изменения крови (повышение гематокрита, вязкости, фибриногена, агрегации и адгезии тромбоцитов). Необходимо иметь в виду, что симптоматика, аналогичная той, что имеет место при хронической ишемии, может быть обусловлена не только сосудистыми, но и другими факторами — хронической инфекцией, неврозами, аллергическими состояниями, злокачественными опухолями и прочими причинами, с которыми следует проводить дифференциальный диагноз. При предполагаемом сосудистом генезе описанных нарушений необходимо инструментальное и лабораторное подтверждение поражения сердечно-сосудистой системы (ЭКГ, УЗ-допплерография магистральных артерий головы, МРА, МРТ, КТ, биохимические исследования крови и др.).
Для постановки диагноза следует придерживаться строгих диагностических критериев: наличие причинно-следственных связей (клинических, анамнестических, инструментальных) поражений головного мозга с нарушениями гемодинамики с развитием клинической, нейропсихологической, психиатрической симптоматики; признаков прогрессирования сосудистой мозговой недостаточности. Следует учитывать возможность субклинически протекающих острых церебральных дисциркуляторных нарушений, включая мелкоочаговые, лакунарные инфаркты, формирующих характерную для энцефалопатии симптоматику. По основным этиологическим причинам выделяют атеросклеротическую, гипертоническую, смешанную, венозную энцефалопатии, хотя возможны и иные причины, приводящие к хронической сосудистой мозговой недостаточности (ревматизм, васкулиты другой этиологии, заболевания крови и др.).
Патоморфологическая картина ХИМ характеризуется участками ишемически измененных нейронов или их выпадения с развитием глиоза. Развиваются мелкие полости (лакуны) и более крупные очаги. При множественном характере лакун формируется так называемое «лакунарное состояние». Эти изменения преимущественно наблюдаются в области базальных ядер и имеют типичное клиническое выражение в виде амиостатического и псевдобульбарного синдромов, деменции, описанных в начале ХХ в. французским неврологом P. Marie. В наибольшей степени развитие status lacunaris характерно для артериальной гипертонии. В этом случае наблюдаются изменения сосудов в виде фибриноидного некроза стенок, их плазматического пропитывания, формирования милиарных аневризм, стенозов.
В качестве характерных для гипертонической энцефалопатии изменений выделяются так называемые криблюры, представляющие собой расширенные периваскулярные пространства. Таким образом, хронический характер процесса патоморфологически подтверждают множественные зоны ишемии мозга, особенно его подкорковых отделов и коры, сопровождающиеся атрофическими изменениями, развивающимися на фоне соответствующих изменений церебральных сосудов. С помощью КТ и МРТ выявляются в типичных случаях множественные микроочаговые изменения, в основном в подкорковых зонах, перивентрикулярно, сопровождающиеся нередко атрофией коры, расширением желудочков мозга, феноменом лейкоареоза («перивентрикулярное свечение»), являющимся отражением процесса демиелинизации. Однако сходные изменения могут наблюдаться при нормальном старении и первичных дегенеративно-атрофических процессах мозга.
Клинические проявления ХИМ не всегда выявляются при КТ- и МРТ-исследованиях. Поэтому нельзя переоценивать диагностическую значимость методов нейровизуализации. Постановка пациенту правильного диагноза требует от врача объективного анализа клинической картины и данных инструментального исследования.
Патогенез ишемии мозга обусловлен недостаточностью мозгового кровообращения в относительно стабильной ее форме или в виде повторных кратковременных эпизодов дисциркуляции.
В результате патологических изменений сосудистой стенки, развивающихся вследствие артериальной гипертонии, атеросклероза, васкулитов и др., происходит нарушение ауторегуляции мозгового кровообращения, возникает все большая зависимость от состояния системной гемодинамики, также оказывающейся нестабильной вследствие тех же заболеваний сердечно-сосудистой системы. К этому добавляются нарушения нейрогенной регуляции системной и церебральной гемодинамики. Сама же по себе гипоксия мозга приводит к дальнейшему повреждению механизмов ауторегуляции мозгового кровообращения. Патогенетические механизмы острой и хронической ишемии мозга имеют много общего. Основные патогенетические механизмы ишемии мозга составляют «ишемический каскад» (В. И. Скворцова, 2000), включающий в себя:
- снижение мозгового кровотока;
- нарастание глутаматной эксайтотоксичности;
- накопление кальция и лактат ацидоз;
- активацию внутриклеточных ферментов;
- активацию местного и системного протеолиза;
- возникновение и прогрессирование антиоксидантного стресса;
- экспрессию генов раннего реагирования с развитием депрессии пластических белковых и снижением энергетических процессов;
- отдаленные последствия ишемии (локальная воспалительная реакция, микроциркуляторные нарушения, повреждения ГЭБ).
Основную роль в поражении нейронов головного мозга играет состояние, получившее название «оксидантный стресс». Оксидантный стресс — это избыточное внутриклеточное накопление свободных радикалов, активация процессов перекисного окисления липидов (ПОЛ) и избыточное накопление продуктов ПОЛ, усугубляющее перевозбуждение глутаматных рецепторов и усиливающее глутаматные эксайтоксические эффекты. Под глутаматной эксайтотоксичностью понимают гиперстимуляцию медиаторами возбуждения NDMA-рецепторов N-метил-D-аспартата, провоцирующую дилатацию кальциевых каналов и, как следствие, массивное поступление кальция в клетки, с последующей активацией протеаз и фосфолипаз. Это приводит к постепенному снижению нейрональной активности, изменению соотношения нейрон-глия, что вызывает ухудшение мозгового метаболизма. Понимание патогенеза ХИМ необходимо для адекватной, оптимально подобранной стратегии лечения.
По мере нарастания выраженности клинической картины усиливаются патологические изменения в сосудистой системе головного мозга. Если вначале процесса выявляются стенозирующие изменения одного-двух магистральных сосудов, то далее оказываются существенно измененными большинство или даже все магистральные артерии головы. При этом клиническая картина нетождественна поражению магистральных сосудов, вследствие наличия у пациентов компенсаторных механизмов ауторегуляции мозгового кровотока. Важную роль в механизмах компенсации нарушений мозгового кровообращения играет состояние внутричерепных сосудов. При хорошо развитых и сохранившихся путях коллатерального кровообращения возможна удовлетворительная компенсация, даже при значительном поражении нескольких магистральных сосудов. Напротив, индивидуальные особенности строения мозговой сосудистой системы могут быть причиной декомпенсации (клинической или субклинической), усугубляющей клиническую картину. Этим можно объяснить факт более тяжелого клинического течения ишемии мозга у больных среднего возраста.
По основному клиническому синдрому различают несколько форм ХИМ: с диффузной цереброваскулярной недостаточностью; преимущественной патологией сосудов каротидной или вертебрально-базилярной систем; вегето-сосудистыми пароксизмами; преимущественными психическими расстройствами. Все формы имеют сходные клинические проявления. В начальных стадиях заболевания все пациенты жалуются на головную боль, несистемное головокружение, шум в голове, ухудшение памяти, снижение умственной работоспособности. Как правило, эти симптомы возникают в период значительного эмоционального и умственного напряжения, требующего существенного усиления мозгового кровообращения. Если два и более из этих симптомов часто повторяются или существуют длительно (не менее 3 последних месяцев) и при этом отсутствуют признаки органического характера, неустойчивости при ходьбе, поражения нервной системы, ставится предположительный диагноз.
Клиническая картина ХИМ имеет прогрессирующее развитие и по выраженности симптоматики делится на три стадии: начальных проявлений, субкомпенсации и декомпенсации.
В 1-й стадии доминируют субъективные расстройства в виде головных болей и ощущения тяжести в голове, общей слабости, повышенной утомляемости, эмоциональной лабильности, головокружения, снижения памяти и внимания, нарушения сна. Эти явления сопровождаются хотя и легкими, но достаточно стойкими объективными расстройствами в виде анизорефлексии, дискоординаторных явлений, глазодвигательной недостаточности, симптомов орального автоматизма, снижения памяти и астении. В этой стадии, как правило, еще не происходит формирования отчетливых неврологических синдромов (кроме астенического) и при адекватной терапии возможно уменьшение выраженности или устранение как отдельных симптомов, так и заболевания в целом.
В жалобах больных со 2-й стадией ХИМ чаще отмечаются нарушения памяти, потеря трудоспособности, головокружение, неустойчивость при ходьбе, реже присутствуют проявления астенического симптомокомплекса. При этом более отчетливой становится очаговая симптоматика: оживление рефлексов орального автоматизма, центральной недостаточности лицевого и подъязычного нервов, координаторные и глазодвигательные расстройства, пирамидная недостаточность, амиостатический синдром, усиление мнестико-интеллектуальных нарушений. В этой стадии возможно вычленить определенные доминирующие неврологические синдромы — дискоординаторный, пирамидный, амиостатический, дисмнестический и др., которые могут помочь при назначении симптоматического лечения.
При 3-й стадии ХИМ более выраженными оказываются объективные неврологические расстройства в виде дискоординаторного, пирамидного, псевдобульбарного, амиостатического, психоорганического синдромов. Чаще наблюдаются пароксизмальные состояния — падения, обмороки. В стадии декомпенсации возможны нарушения мозгового кровообращения в виде «малых инсультов», или пролонгированного обратимого ишемического неврологического дефицита, длительность очаговых расстройств при котором составляет от 24 ч до 2 нед. При этом клиника диффузной недостаточности кровоснабжения мозга соответствует таковой при энцефалопатии средней степени выраженности. Другим проявлением декомпенсации могут быть прогрессирующий «законченный инсульт» и остаточные явления после него. Этой стадии процесса при диффузном поражении соответствует клиническая картина выраженной энцефалопатии. Очаговая симптоматика нередко сочетается с диффузными проявлениями мозговой недостаточности.
При хронической ишемии мозга четко прослеживается корреляция между выраженностью неврологической симптоматики и возрастом пациентов. Это необходимо иметь в виду при оценке значения отдельных неврологических признаков, которые считаются нормальными для лиц пожилого и старческого возраста. Данная зависимость отражает возрастные проявления дисфункций сердечно-сосудистой и других висцеральных систем, воздействующих на состояние и функции головного мозга. В меньшей степени эта зависимость прослеживается при гипертонической энцефалопатии. В этом случае тяжесть клинической картины во многом обусловлена течением основного заболевания и его длительностью.
Наряду с прогрессированием неврологической симптоматики, по мере развития патологического процесса в нейронах головного мозга, происходит нарастание когнитивных расстройств. Это касается не только памяти и интеллекта, нарушающихся в 3-й стадии до уровня деменции, но и таких нейропсихологических синдромов, как праксис и гнозис. Начальные, по существу субклинические расстройства этих функций наблюдаются уже в 1-й стадии, затем они усиливаются, видоизменяются, становятся отчетливыми. 2-я и особенно 3-я стадии болезни характеризуются яркими нарушениями высших мозговых функций, что резко снижает качество жизни и социальную адаптацию больных.
В картине ХИМ выделяют несколько основных клинических синдромов — цефалгический, вестибуло-атаксический, пирамидный, амиостатический, псевдобульбарный, пароксизмальный, вегетососудистый, психопатологический. Особенностью цефалгического синдрома является его полиморфность, непостоянство, отсутствие в большинстве случаев связи с конкретными сосудистыми и гемодинамическими факторами (исключая головную боль при гипертонических кризах с высокими цифрами артериального давления), уменьшение частоты встречаемости по мере прогрессирования болезни.
Вторым по частоте встречаемости является вестибуло-атаксический синдром. Основными жалобами пациентов являются: головокружение, неустойчивость при ходьбе, координаторные нарушения. Иногда, особенно в начальных стадиях, больные, жалуясь на головокружение, не отмечают нарушений координации. Недостаточно показательными бывают также результаты отоневрологического исследования. В более поздних стадиях заболевания субъективные и объективные дискоординаторные нарушения четко взаимосвязаны. Головокружение, неустойчивость при ходьбе частично могут быть связаны с возрастными изменениями вестибулярного аппарата, двигательной системы и ишемической невропатии преддверно-улиткового нерва. Поэтому для оценки значимости субъективных вестибуло-атаксических нарушений важен их качественный анализ при опросе больного, неврологическом и отоневрологическом обследовании. В большинстве случаев эти расстройства обусловлены хронической недостаточностью кровообращения в бассейне кровоснабжения вертебробазилярной артериальной системы, поэтому необходимо основываться не на субъективных ощущениях больных, а искать признаки диффузного поражения отделов мозга, кровоснабжение которых осуществляется из этого сосудистого бассейна. В некоторых случаях у больных с ХИМ 2–3-й стадий атаксические нарушения бывают обусловлены не столько мозжечково-стволовой дисфункцией, сколько поражением лобно-стволовых путей. Возникает феномен лобной атаксии, или апраксии ходьбы, напоминающей гипокинезию больных паркинсонизмом. При КТ-исследовании выявляется значительная гидроцефалия (наряду с корковой атрофией), т. е. возникает состояние, близкое к нормотензивной гидроцефалии. В целом синдром недостаточности кровообращения в вертебробазилярном бассейне диагностируется при ХИМ чаще, чем недостаточность каротидной системы.
Особенностью пирамидного синдрома является его умеренная клиническая манифестация (анизорефлексия, мимическая асимметрия, минимально выраженные парезы, оживление рефлексов орального автоматизма, кистевые симптомы). Отчетливая асимметрия рефлексов указывает либо на имевшийся ранее мозговой инсульт, либо на другое заболевание, текущее под маской ХИМ (например, объемные внутричерепные процессы, последствия травматического повреждения головного мозга). Диффузное и достаточно симметричное оживление глубоких рефлексов, как и патологические пирамидные рефлексы, часто сочетающиеся со значительным оживлением рефлексов орального автоматизма и развитием псевдобульбарного синдрома, особенно в пожилом и старческом возрасте, указывает на многоочаговое сосудистое поражение мозга (при исключении иных возможных причин).
У больных с клиническими проявлениями недостаточности кровообращения в бассейне вертебробазилярной системы часто наблюдаются пароксизмальные состояния. Эти состояния могут быть обусловлены сочетанным или изолированным воздействием на позвоночные артерии вертеброгенных факторов (компрессионные, рефлекторные), что связано с изменением шейного отдела позвоночника (дорсопатии, остеоартроз, деформации).
Достаточно характерными и разнообразными по форме в разных стадиях ХИМ являются психические расстройства. Если в начальных стадиях они носят характер астенических, астенодепрессивных и тревожно-депрессивных нарушений, то во 2-й и особенно в 3-й стадии к ним присоединяются выраженные дисмнестические и интеллектуальные расстройства, формирующие синдром сосудистой деменции, выходящий в клинической картине нередко на первое место.
Электроэнцефалографические изменения неспецифичны для ХИМ. Они заключаются в прогрессирующем снижении β-ритма, нарастании доли медленной θ- и δ-активности, акцентуации межполушарной асимметрии, снижении реактивности ЭЭГ на внешнюю стимуляцию.
КТ-характеристики претерпевают динамику от нормальных показателей или минимальных атрофических признаков в 1-й стадии к более выраженным мелкоочаговым изменениям вещества мозга и атрофическим (наружным и внутренним) проявлениям во 2-й стадии до резко обозначенной корковой атрофии и гидроцефалии с множественными гиподенсивными очагами в полушариях — в 3-й стадии.
Сопоставление клинических и инструментальных характеристик у пациентов с атеросклеротической, гипертонической и смешанной формами ХИМ не выявляет отчетливых различий. При тяжелом течении гипертонической болезни возможны более быстрый темп нарастания психоневрологических расстройств, раннее проявление церебральных нарушений, большая вероятность развития лакунарного инсульта.
Лечение ХИМ должно основываться на определенных критериях, включающих понятия патогенетической и симптоматической терапии. Для правильного определения патогенетической стратегии лечения следует учитывать: стадию заболевания; выявленные механизмы патогенеза; наличие сопутствующих заболеваний и соматических осложнений; возраст и пол пациентов; необходимость восстановления количественных и качественных показателей мозгового кровотока, нормализации нарушенных функций головного мозга; возможность профилактики повторных церебральных дисгемий.
Важнейшим направлением терапии ХИМ является воздействие на имеющиеся факторы риска, такие, как артериальная гипертония и атеросклероз. Лечение атеросклероза проводится по общепринятым схемам с применением статинов, в комплексе с коррекцией режима питания и стиля жизни пациентов. Подбор антигипертензивных средств и порядок их назначения осуществляется врачом-терапевтом с учетом индивидуальных особенностей больных. Комплексная терапия ХИМ включает в себя назначения антиоксидантов, антиагрегантов, препаратов, оптимизирующих метаболизм мозга, вазоактивных препаратов. Антидепрессанты назначаются при выраженных астенодепрессивных проявлениях заболевания. Таким же образом назначаются антиастенические препараты.
Важным компонентом лечения ХИМ является назначение препаратов, обладающих антиоксидантной активностью. В настоящее время в клинической практике используются следующие препараты данного ряда: актовегин, мексидол, милдронат.
Актовегин — современный антиоксидант, представляющий собой депротеинизированный экстракт крови молодых телят. Его основное действие — улучшение утилизации кислорода и глюкозы. Под влиянием препарата значительно улучшается диффузия кислорода в нейрональных структурах, что позволяет уменьшить выраженность вторичных трофических расстройств. Отмечается также значительное улучшение церебральной и периферической микроциркуляции на фоне улучшения аэробного энергообмена сосудистых стенок и высвобождения простациклина и оксида азота. Происходящая при этом вазодилятация и снижение периферического сопротивления являются вторичными по отношению к активации кислородного метаболизма сосудистых стенок (А. И. Федин, С. А. Румянцева, 2002).
При ХИМ целесообразно применение актовегина, особенно при отсутствии эффекта от других методов лечения (Е. Г. Дубенко, 2002). Методика применения заключается в капельном введении 600–800 мг препарата в течение 10 дней, с последующим переходом на пероральное применение.
Постоянным в схеме терапии ХИМ является применение препаратов, оптимизирующих мозговое кровообращение. Наиболее часто используются следующие лекарственные средства: кавинтон, галидор, трентал, инстенон.
Галидор (бенциклан) — препарат, имеющий многонаправленный механизм действия, обусловленный блокадой фосфодиэстеразы, антисеротониновым действием, кальциевым антагонизмом. Он тормозит агрегацию и адгезию тромбоцитов, препятствует агрегации и адгезии эритроцитов, повышая эластичность и осмотическую резистентность последних. Галидор уменьшает вязкость крови, нормализует внутриклеточный метаболизм глюкозы, АТФ, воздействует на фосфокиназу и лактатдегидрогеназу, усиливает оксигенацию ткани. Доказано, что применение данного препарата в течение 8 нед устраняет клинические проявления хронической сосудистой недостаточности мозга у 86% пациентов. Препарат положительно влияет на эмоциональную среду человека, уменьшает забывчивость и рассеянность внимания. Галидор назначается в суточной дозе 400 мг в течение 6–8 нед.
Инстенон — комбинированный препарат нейропротекторного действия, включающий вазоактивный агент из группы пуриновых производных, вещество, влияющее на состояние восходящей ретикулярной формации и корково-подкорковые взаимоотношения, и, наконец, активатор процессов тканевого дыхания в условиях гипоксии (С. А. Румянцева, 2002; В. В. Ковальчук, 2002).
Три компонента инстенона (этофиллин, этамиван, гексобендин) совместно действуют на различные звенья патогенеза ишемического поражения мозга.
Этофиллин, вазоактивный компонент пуринового ряда, активизирует метаболизм миокарда с увеличением ударного объема. Переход гипокинетического типа кровообращения в нормокинетический сопровождается усилением мозгового кровотока. Немаловажным действием компонента являются повышение почечного кровотока и, как следствие, дегидратационный и диуретический эффекты.
Этамиван оказывает ноотропный эффект в виде прямого воздействия на процессы памяти, внимания, умственную и физическую работоспособность в результате повышения активности ретикулярной формации головного мозга.
Гексобендин избирательно стимулирует обмен веществ на основе повышения утилизации кислорода и глюкозы, вследствие усиления анаэробного гликолиза и пентозных циклов. При этом стабилизируются физиологические механизмы ауторегуляции церебрального и системного кровотока.
Инстенон применяют внутримышечно 2,0 мл, курс — 5–10 процедур. Затем продолжается пероральный прием инстенона-форте по 1 таблетке 3 раза в день в течение месяца (С. В. Котов, И. Г. Рудакова, Е. В. Исакова, 2003). Отчетливый регресс неврологической симптоматики отмечается к 15–20-му дню лечения. Особенно хороший эффект отмечается при сочетанном использовании актовегина (капельно) и инстенона (внутримышечные инъекции или пероральное применение). Терапия инстеноном положительно влияет на когнитивные функции, особенно на регуляцию мнестической деятельности и психомоторных функций.
Большое внимание в комплексной терапии ХИМ уделяется препаратам ноотропного действия, которые повышают устойчивость ткани мозга к различным неблагоприятным метаболическим воздействиям (ишемии, гипоксии). К собственно «ноотропным» относятся производные пирацетама (ноотропил, луцетам), энцефабол.
Пирацетам увеличивает синтез макроэргических фосфатов (АТФ), усиливает аэробный метаболизм в условиях гипоксии, облегчает проведение импульса, нормализует соотношение фосфолипидов клеточных мембран и их проницаемость, повышает плотность и чувствительность рецепторов, улучшает взаимодействие между полушариями головного мозга, улучшает метаболические процессы в ЦНС, облегчает нейрональную передачу.
Пирацетам улучшает микроциркуляцию за счет дезагрегантных свойств, облегчает проведение нервного импульса, улучшает взаимодействие между полушариями головного мозга. Препарат нормализует соотношение фосфолипидов клеточных мембран и усиливает их проницаемость, предотвращает адгезию эритроцитов, снижает агрегацию тромбоцитов, уменьшает уровни фибриногена и фактора VIII, снимает спазм артериол. Препарат назначается в суточной дозе 2,4–4,8 г в течение 8–12 нед.
Энцефабол — производное пиритинола. Препарат повышает плотность и чувствительность рецепторов, нормализует нейропластичность. Он обладает нейропротекторным эффектом, стимулирует процессы обучения, улучшает память, способность к запоминанию и концентрацию внимания. Энцефабол стабилизирует клеточные мембраны нейронов за счет ингибирования лизосомальных ферментов и предотвращения образования свободных радикалов, улучшает реологические свойства крови, повышает конформационную способность эритроцитов, увеличивая содержание АТФ в их мембране. Для взрослых средняя суточная доза составляет 600 мг в течение 6–8 нед.
К препаратам антиагрегантного ряда относятся ацетилсалициловая кислота и ее производные (кардиомагнил, тромбо АСС). Учитывая наличие противопоказаний при назначении ацетилсалициловой кислоты, часто применяют другие препараты с антиагрегантной активностью (курантил, тиклид, плавикс).
Симптоматическая терапия ХИМ включает назначение препаратов, уменьшающих проявления различных симптомов заболевания. Всем пациентам со 2–3-й стадиями болезни целесообразно назначение противотревожных или антидепрессантных средств. Наиболее безопасными при длительном применении являются препараты бензодиазепинового ряда.
Грандаксин — атипичное производное бензодиазепина, селективный анксиолитик. Препарат эффективно устраняет тревогу, страх, эмоциональное напряжение без седации и миорелаксации. Препарат обладает вегетокорректирующим действием, что делает возможным его применение у пациентов с выраженным вегетососудистым синдромом.
В неврологической практике используется суточная доза 50–100 мг, длительность употребления определяется индивидуально для каждого пациента.
Распространенность хронической сосудистой патологии головного мозга, прогредиентность течения, высокая степень инвалидизации пациентов определяют социальную и медицинскую значимость проблемы терапии ХИМ. В настоящее время в клинической практике прослеживается тенденция к увеличению использования немедикаментозных методов лечения. Это связано с отсутствием у пациентов феномена привыкания к лекарственным веществам с длительным периодом лечебного последействия.
Учитывая сложность патогенетических механизмов ХИМ, в процессе терапии необходимо добиться нормализации системного и мозгового кровообращения, скорректировать обмен в мозговой ткани, состояние гемореологии. В настоящее время возможности фармакологической коррекции проявлений ХИМ довольно обширны, они позволяют использовать различные препараты, влияющие на все звенья патогенеза постишемического и постгипоксического повреждения нервной ткани.
Таким образом, распознавание причин, выявление факторов риска и, следовательно, реальная возможность эффективного адресного лечения и предупреждение развития хронической патологии сосудов головного мозга предполагает точное знание структурных, физиологических и клинических особенностей проявления заболевания. Это становится возможным благодаря системному подходу к изучению этиологии, патогенеза, клиники и современным методам терапии.
М. В. Путилина, доктор медицинских наук, профессор
РГМУ, Москва
Чем больше поражение, тем хуже проявление
Что касается последствий, которыми грозит отмирание клеток головного мозга, то здесь актуально правило: чем больше поражение, тем хуже проявление. А также при отсутствии лечения, состояние человека ухудшается быстрее.
Вследствие могут появляться судороги, исчезновение мышечных функций или угнетение дыхания. Одновременное проявление таких последствий может привести больного в кому или сопор.
Здесь ничего хорошего ожидать не приходится, так как такой процесс остановить уже невозможно, и при отмирании значительной для жизни части клеток наступает летальный исход.
Лечебная тактика
Лечение органических повреждений головного мозга может быть самым разнообразным и зависит от патогенетического механизма развития повреждения и непосредственной причины.
Лечение органического поражения головного мозга может быть хирургическим и консервативным. Например, развитие высокого внутричерепного давления, которое представляет угрозу жизнедеятельности можно лечить и хирургическим, и консервативным путём. Хирургическое лечение – наложение трепанационного отверстия для декомпрессии головного мозга применимо при формировании выраженной гематомы при травме или геморрагическом инсульте, а консервативная терапия возможна при умеренном увеличении внутричерепного давления без дислокации головного мозга. Для консервативной терапии применяют мочегонные препараты вызывающие форсированный диурез, позволяющие быстро ликвидировать отёки.
Лечение атеросклероза церебральных артерий также может быть как хирургическим, так и консервативным. Хирургическое – проведение ангиографии с установкой стентов расширяющих просвет артерий. Консервативное – антитромботическая терапия и коррекция дислепидемии.