Невралгия относится к сильной стреляющей боли, которая возникает из-за поврежденного или раздраженного нерва. Невралгия может поражать любую часть тела, вызывая легкую или сильную боль. Некоторые лекарства и хирургические процедуры могут эффективно лечить невралгию.
Тяжелая невралгия может повлиять на способность человека выполнять повседневные задачи и может повлиять на качество его жизни.
Невралгия имеет много возможных причин, в том числе:
- инфекции, такие как опоясывающий лишай, болезнь Лайма или ВИЧ
- давление на нервы костей, кровеносных сосудов или опухолей
- другие медицинские условия, такие как заболевание почек или диабет
- старение
В этой статье рассматриваются различные типы невралгии, их симптомы и доступные варианты лечения.
Общая информация
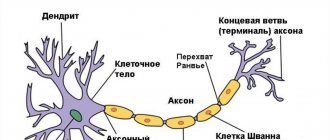
В организме человека имеется 12 пар межреберных нервов. Они берут начало от корешков грудного отдела спинного мозга и охватывают всю грудную клетку, примыкая к брюшине, мышцам, коже и молочным железам. Отдельные волокна каждого нерва отвечают за чувствительность тканей, двигательную функцию и регуляцию работы всех структур. Соответственно, повреждение или воспалительный процесс в каком-либо участке может отдавать боль в самые разные части тела.
Ощущения могут имитировать заболевания внутренних органов: инфаркт миокарда, стенокардию, панкреатит, гастрит, холецистит и т.п. В некоторых случаях точно определить природу боли может только врач после полноценного обследования. Именно поэтому важно при возникновении болей в грудной клетке своевременно обратиться за помощью.
Записаться на прием
Причины постгерпетической невралгии
После того как человек перенёс ветряную оспу, вирус остаётся в организме на всю жизнь. С возрастом иммунная система ослабевает (в частности — от приёма лекарств или химиотерапии) и вирус может активизироваться, в результате чего возникает опоясывающий лишай.
Повреждение нервных окончаний при высыпаниях приводит к возникновению постгерпетической невралгии. Будучи повреждёнными, нервные волокна не могут посылать сигнал от кожи к мозгу так, как они это делают в норме. Вместо этого, ими передаются усиленные сигналы, а пациент чувствует мучительную боль, которая может длиться месяцами или даже годами.
Формы
Специальной классификации заболевания не существует. Выделяют несколько отдельных форм в зависимости от механизма возникновения:
- корешковая: связана с раздражением корешков спинного мозга в месте их выхода из позвоночного столба;
- рефлекторная: связана с перенапряжением мышечных волокон в месте прохождения нерва.
Имеется также классификация невралгии в зависимости от:
- причины: первичная (связана с повреждением или воспалением самого нерва) и вторичная (обусловлена другими заболеваниями);
- локализации: односторонняя и двусторонняя;
- течения болезни: острая и хроническая.
Симптомы невралгии справа и слева
Любая невралгия, в том числе межреберная, – это прежде всего боль. Болезненные ощущения могут носить различный характер (ноющие, тупые, острые, прокалывающие, жгучие) и иметь разную интенсивность. Иногда боль бывает настолько сильной, что заставляет человека принять вынужденную позу и резко ограничить двигательную активность. Межреберная невралгия, имеющая выраженные симптомы, описывается пациентами, как прострел или разряд электрического тока, идущий от позвоночника к грудине.
Торакалгия чаще начинается постепенно, с ощущения покалывания в области межреберных промежутков, затем приобретает выраженную интенсивность. Реже она возникает внезапно. Боль может отдавать в лопатку, зону эпигастрия, сердце, руку и поясницу. Иногда она принимает опоясывающий характер. Она усиливается при перемене положения тела, движениях, кашле и глубоком дыхании.
Как правило, болевые приступы постоянно повторяются, продолжаясь от нескольких секунд до 2-3 минут. Поэтому лечение острой межреберной невралгии справа и слева, в первую очередь, всегда начинается с устранения болевого синдрома.
Помимо торакалгии человека могут беспокоить характерные локальные признаки, обусловленные влиянием симпатических, чувствительных и двигательных нервных волокон. Межреберная невралгия, в зависимости от поражения конкретного нерва, будет иметь характерные симптомы справа, слева или с обеих сторон грудной клетки:
- нарушение чувствительности, ощущение «ползания» мурашек, онемение, покалывание;
- подёргивание мышц;
- усиленное потоотделение;
- изменение цвета кожного покрова.
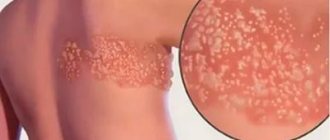
Если невралгия грудной клетки появилась на фоне герпетической инфекции, она может сопровождаться кожными высыпаниями. Последние проступают на 2-4 день после начала торакалгии. Элементы сыпи располагаются на коже межреберного промежутка в виде небольших розовых пятен, которые потом превращаются в везикулы, а затем в корочки. Впоследствии на кожном покрове могут остаться следы пигментации.
Причины
В список основных причин межреберной невралгии входит:
- дегенеративно-дистрофические заболевания позвоночника: остеохондроз, артроз, грыжи и протрузии дисков и т.п.;
- неравномерная или чрезмерная нагрузка на позвоночник и мышцы спины (на фоне ношения тяжестей, нарушений осанки и т.п.);
- деформации позвоночного столба (в первую очередь, сколиоз);
- заболевания нервной системы, в частности, рассеянный склероз;
- инфекционные поражения: туберкулез, опоясывающий лишай, грипп;
- травмы позвоночника и грудной клетки, хирургические вмешательства в этой области;
- опухоли в области ребер, грудины, позвоночного столба;
- прием некоторых лекарственных препаратов;
- повышенная нагрузка на дыхательные мышцы и мускулатуру брюшного пресса;
- увеличение внутрибрюшного давления, в том числе на фоне беременности.
Кроме того, межреберная невралгия может возникать вторично на фоне других заболеваний, например, плеврита, патологии пищеварительной системы, заболеваний почек, тиреотоксикоза, иммунодефицитных состояний. Подростки в период активного роста скелета также могут испытывать сходную симптоматику.
Материал и методы
С целью изучения терапевтического потенциала оригинального препарата мелоксикам (мовалис) при острой НБС было проведено исследование КАРАМБОЛЬ (Клинический Анализ Результатов Аналгезии Мелоксикамом и его Безопасности при Острой Люмбалгии). Работа носила наблюдательный характер — не предполагались вмешательства в обычный лечебный процесс, назначение новых лекарственных средств или терапевтических методов. Длительность применения НПВП для купирования НБС определялась лечащим врачом, исходя из клинических рекомендаций и собственного опыта. Не ограничивалось назначение других препаратов: миорелаксантов, витаминов группы В и ингибиторов протонной помпы (ИПП).
В исследование были включены 2078 пациентов с НБС, средний возраст 46,3±13,4 года, 56,6% — женщины. У 34,8% больных настоящий эпизод НБС возник впервые, у 65,2% — повторно. За предыдущий год у больных наблюдалось от 2 до 12 (в среднем 2,61±1,35) случаев НБС: 2 эпизода — у 59,3%, 3 — у 27,5%, 4 — у 10,5%, 5 и более — у 2,7% пациентов.
Критерии включения
в исследование: возраст 18 лет и старше, факт обращения к врачу в связи с острой выраженной болью в нижней части спины (продолжительность не более 2 нед, выраженность 4 балла и более по числовой рейтинговой шкале — ЧРШ), наличие показаний для назначения мелоксикама, по мнению лечащего врача, согласие пациента на участие.
Критерии невключения:
противопоказания для использования НПВП, наличие симптомов тяжелой угрожающей патологии («красные флажки»), а также выраженная функциональная недостаточность, затрудняющая повторное наблюдение больных.
Анализировались данные, полученные в ходе 2 визитов больных: при 1-м визите проводился стандартный клинический осмотр и опрос до назначения терапии, при 2-м оценивался результат терапии через 14 сут.
Выраженность НБС оценивалась по 10-балльной ЧРШ по следующим критериям: 0 баллов — отсутствие боли, 10 — максимально сильная боль. Общее самочувствие также оценивалось с помощью ЧРШ, где: 0 баллов — отсутствие ухудшения, 10 — максимально выраженное ухудшение самочувствия. В среднем выраженность боли на момент назначения терапии составила 6,69±1,65 балла, ухудшение самочувствия — 5,68±2,09 балла. Сильная боль (7 баллов и более) была зафиксирована у 57,0% пациентов.
При опросе больных, имевших ранее эпизоды НБС, выясняли факт применения НПВП и оценку их действия. Как оказалось, подавляющее большинство (70,2%) пациентов уже получали препараты этой группы. Эффективность НПВП в анамнезе как хорошая была оценена больными в 28,0% случаев, как умеренная — в 54,6% и как низкая — в 17,4%.
У многих пациентов при использовании НПВП в анамнезе отмечались нежелательные реакции (НР): диспепсия (гастралгии, тошнота, чувство тяжести в эпигастрии и др.) — у 44,7% больных, развитие язвы желудка и/или двенадцатиперстной кишки — у 2,7%, кровотечение из желудочно-кишечного тракта (ЖКТ) — у 0,4%, повышение артериального давления (АД) — у 14,1%, отеки — у 6,2%, аллергические реакции — у 3,4%.
Кроме того, анализировали ряд особенностей клинических проявлений острой НБС. При опросе больных были выявлены следующие симптомы: сохранение боли в покое — у 37,2% пациентов, боли в ночное время — у 19,0%, ощущение скованности утром или после пребывания в покое — у 60,7%, иррадиация боли в ногу — у 28,2%, признаки люмбоишиалгии (интенсивные боли в ноге, которые сопровождаются нарушениями чувствительности) — у 9,6%.
Всем пациентам был назначен оригинальный мелоксикам (мовалис) в дозе 15 мг/сут. У большинства больных (86,1%) он применялся по ступенчатой схеме: первые 3—5 сут в виде внутримышечных (в/м) инъекций, с дальнейшим переходом на пероральную форму. У 13,9% пациентов был использован только пероральный прием мелоксикама. По решению лечащих врачей 52,3% пациентов также получали миорелаксанты (толперизон — 31,7%, тизанидин — 18,7%, баклофен — 1,7%), 17,4% — витамины группы В (в основном для в/м введения). Для предупреждения развития НПВП-гастропатии 21,6% больных были назначены ИПП, в основном омепразол.
Результат лечения определялся по частоте полного прекращения боли и динамике ее выраженности (в том случае, если она не прошла полностью), а также общего самочувствия пациентов за 2 нед наблюдения. В дополнение к этому больным было предложено оценить результат терапии по 5-балльной шкале, где: 1 балл означал ухудшение состояния, 5 — отличный результат. Также изучались частота и характер НР, зафиксированных в период наблюдения.
Полученные количественные данные представлены в виде среднего значения и стандартной ошибки средней величины (M±m
). Статистическое различие количественных параметров определялось при помощи
t
-критерия Стьюдента, распределение ранговых переменных — с использованием показателя отношения шансов (ОШ) и точного критерия Фишера. Показатель О.Ш. приведен в работе вместе с соответствующим 95% доверительным интервалом (ДИ).
Симптомы
Основной симптом межреберной невралгии – сильная боль в грудной клетке по ходу нерва. Как правило, она возникает резко и напоминает удар электрическим током, постепенно распространяющийся по ребрам. Характер ощущений может быть разным: стреляющим, пульсирующим, постоянным, жгучим или тупым.
Глубокое дыхание, повороты головы или корпуса, наклоны, нажатия или просто прикосновения к грудной клетке вызывают выраженное усиление боли. Кроме того, характерными признаками невралгии являются:
- сохранение болевых ощущений в ночное время;
- возможность определить эпицентр боли;
- покраснение или побледнение кожи в зоне поражения;
- ощущение покалывания, ползанья мурашек или, наоборот, онемение по ходу пострадавшего нерва;
- небольшие подергивания мышц в зоне поражения.
Как правило, при приступе невралгии, человек старается лежать или сидеть неподвижно в той позе, в которой боль становится чуть меньше.
Если причиной болевого синдрома стал опоясывающий лишай, на коже по ходу пораженного нерва последовательно появляется сначала покраснение, затем многочисленные пузырьки, которые прорываются, образуя корочки. После выздоровления в этой зоне некоторое время сохраняется повышенная пигментация.
Отличия от инфаркта миокарда
Боль в груди, особенно слева, может быть следствием не только межреберной невралгии, но и более серьезных проблем. Наиболее опасным является инфаркт миокарда. Это состояние требует экстренного обращения за медицинской помощью. Характерными отличиями болевых ощущений являются:
- возникновение на фоне физической, реже психоэмоциональной нагрузки;
- распространение на левую руку, плечо, левую половину шеи и нижней челюсти;
- отсутствие изменений при повороте корпуса, наклонах, нажатии на больную область;
- снижение интенсивности при приеме нитроглицерина и его аналогов.
Инфаркт часто сопровождается холодным, липким потом, бледностью кожи, головокружением, страхом смерти.
Важно помнить, что не всегда признаки сердечно-сосудистой катастрофы и межреберной невралгии так кардинально различаются. Точный диагноз может быть поставлен только врачом.
Лечение межреберной невралгии во время беременности
При беременности наличие невралгии считается достаточно серьезной проблемой. Она требует должного внимания, которое поможет избежать осложнений для будущей мамы и малыша.
Всё лечение, которое будет проводится беременной женщине при невралгии, должно быть прописано лечащим врачом. Самостоятельная терапия крайне нежелательна, так как может сильно навредить женщине и ребёнку в утробе.
Многие пациентки предпочитают отказаться от приема медикаментов. Они ограничиваются витаминами и минеральными комплексами, используют мази и тёплые компрессы, соблюдают постельный режим и выполняют простые физические упражнения.
Гимнастика при невралгических болях у беременных очень эффективна. Физические упражнения не дают застаиваться крови в суставах и отделах позвоночника.
Если боль становится невыносимой, назначают с осторожностью новокаиновые блокады.
Диагностика
Межреберная невралгия вне зависимости от выраженности болевого синдрома и его локализации, требует полноценной диагностики. Отличить ее от других патологий помогут следующие обследования:
- опрос и сбор анамнеза: выявление характера ощущений, условий их возникновения, длительности приступа, сопутствующих заболеваний;
- осмотр и пальпация: врач оценивает внешний вид кожных покровов, проверяет реакцию на движения, нажатия, повороты, наклоны, оценивает выраженность рефлексов;
- лабораторная диагностика: общий и биохимический анализ крови, общий анализ мочи: позволяет выявить признаки поражения сердечной мышцы (тесты на тропонины, КФК), воспаление, почечную патологию, заболевания желудочно-кишечного тракта и т.п.; точный набор анализов зависит от локализации очага боли;
- ЭКГ, УЗИ сердца: позволяют выявить или исключить сердечно-сосудистую патологию;
- рентген, КТ или МРТ грудного отдела позвоночника: помогает выявить остеохондроз, остеопороз, опухоли, грыжи и протрузии межпозвоночных дисков и т.п.;
- рентген органов грудной клетки: позволяет оценить состояние легочной ткани, выявить признаки опухолей;
- УЗИ почек, органов брюшной полости (исключает соответствующую патологию);
- ФГДС для исключения патологии пищевода, желудка, двенадцатиперстной кишки;
- миелография, контрастная дискография, электроспондилография для оценки состояния позвоночника, межпозвоночных дисков, спинного мозга и его корешков.
При необходимости назначаются консультации узких специалистов, дополнительные обследования.
Записаться на прием
Методы диагностики
Нужно обратиться к врачу-терапевту. После осмотра и исключения других патологий терапевт направляет к невропатологу, который занимается определением симптомов и лечением межрёберной невралгии. Врач изучает снимки, назначает анализы и медицинские обследования.
Инструментальные диагностические методы обследования:
- Рентгенография. Позволяет исследовать структуру кости. Дает возможность определить наличие нарушений нетравматического или травматического характера. Рентгеновские снимки делают в прямой, косой и боковой проекции.
- Компьютерная томография. Исследует костную и мышечную структуру в комплексе. Чаще используют для обнаружения патологических изменений костных структур.
- Миелография. В спинномозговой канал вводится контрастное вещество. Это основной метод диагностирования мягкотканых структур (нервных корешков и спинного мозга).
- Контрастная дискография. Во время процедуры вводится контрастное вещество в межпозвонковый диск.
- Магнитно-резонансная томография. Позволяет получить изображения органов и тканей. Выявляет патологические изменения мягкотканых структур: нервных тканей, мышц, связок, грыжи и дегенеративные изменения в межпозвоночных грыжах.
- Электроспондилография. С помощью метода компьютерной диагностики возможно оценить состояние позвоночного столба, выявить болезнь на ранней стадии, определить степень поражения и контролировать течение заболевания.
Лечение
Межреберная невралгия требует комплексного и нередко длительного лечения, включающего в себя медикаментозное воздействие, физиотерапию, массаж и т.п.
Медикаментозная терапия
В острой фазе заболевания терапия направлена на купирование болевого синдрома и улучшение состояния пациента. В зависимости от конкретной клинической ситуации назначаются:
- нестероидные противовоспалительные препараты (НПВС): средства на основе диклофенака, нимесулида, ибупрофена мелоксикама и их производных; используются в таблетированной, инъекционной и местной (кремы, мази, пластыри) форме;
- анальгетики: анальгин и средства на его основе; как и НПВС, снимают болевой синдром;
- миорелаксанты для устранения мышечного спазма: мидокалм и т.п.;
- витамины группы: мильгамма, нейромультивит и т.п.; необходимы для восстановления нормальной работы нервных волокон;
- седативные средства для уменьшения психоэмоциональной составляющей боли и улучшения сна.
При необходимости дополнительно могут быть назначены:
- противосудорожные средства: тормозят прохождение болевых импульсов;
- антидепрессанты для снятия напряжения;
- антигистаминные и диуретики: снимают отечность тканей, особенно актуальны при защемлении нервных корешков;
- противовирусные препараты при опоясывающем лишае;
- глюкокортикостероиды при стойком болевом синдроме и тяжелом воспалении, не снимающимся более мягкими средствами.
Физиотерапия и лечебная физкультура
Физиотерапевтические процедуры назначаются после стихания острого болевого синдрома. Ускорить выздоровление помогают:
- УВЧ;
- рефлексотерапия;
- магнитотерапия;
- электрофорез;
- лазерное лечение;
- парафиновые аппликации;
- грязелечение.
Эти процедуры способствуют улучшению кровообращения и обмена веществ в пораженной области и ускоряют регенерацию нервной ткани.
Упражнения лечебной физкультуры назначаются после полного выздоровления. Основная цель гимнастики – разгрузка мышц спины. Комплекс разрабатывается индивидуально. Первые занятия должны проходить под наблюдением специалиста, в дальнейшем допускаются домашние упражнения.
Другие методы лечения
Поскольку очень часто причиной межреберной невралгии является патология позвоночника и спинного мозга, в качестве дополнительных методов воздействия очень часто используются:
- иглоукалывание;
- мануальная терапия;
- лечебный массаж, в том числе с использованием согревающих средств;
- массаж Шиацу (точечный);
- остеопатия;
- подводное вытяжение и другие методики.
Как и все лечебные процедуры, эти методики используются только в условиях клиники и проводятся специалистами с медицинским образованием и соответствующим сертификатом.
Современный подход к лечению тригеминальной невралгии
Тригеминальная невралгия (ТН) (синонимы: tic douloureux, или болезнь Фотергилла) является одной из самых распространенных лицевых болей (прозопалгий) и относится к числу наиболее устойчивых болевых синдромов в клинической неврологии [1]. ТН является типичным примером нейропатической боли (НБ) пароксизмального характера и считается самым мучительным видом прозопалгии. ТН чаще всего имеет хроническое или рецидивирующее течение, сопровождается большим количеством коморбидных расстройств, гораздо труднее поддается лечению, чем многие другие типы хронической боли и приводит к временной или постоянной нетрудоспособности, что делает ее большой экономической и социальной проблемой [2]. Хроническая НБ оказывает значительное отрицательное воздействие на качество жизни пациентов, вызывая нарушения сна, усиление тревоги, депрессии, снижение повседневной активности [3]. Высокая интенсивность и стойкость ТН, ее особый, часто мучительный характер, резистентность к традиционным методам обезболивания придают этой проблеме исключительную актуальность. Тригеминальная невралгия — заболевание, характеризующееся возникновением приступообразной, обычно односторонней, кратковременной, острой, резкой, интенсивной, напоминающей удар электрическим током, боли в области иннервации одной или нескольких ветвей тройничного нерва [4, 5]. Чаще всего поражение возникает в зоне II и/или III ветви и крайне редко — I ветви n. trigeminus [6].
По данным ВОЗ распространенность ТН составляет до 30–50 больных на 100 000 населения, а заболеваемость — 2–4 человека на 100 000 населения. ТН чаще встречается у женщин, чем у мужчин, дебютирует на пятом десятилетии жизни и в 60% случаев имеет правостороннюю локализацию [7, 8].
Согласно Международной классификации головных болей (2-е издание), предложенной Международным обществом головной боли (2003), ТН подразделяется на классическую, вызванную компрессией тригеминального корешка извилистыми или патологически измененными сосудами, без признаков явного неврологического дефицита, и симптоматическую, вызванную доказанным структурным повреждением тройничного нерва, отличным от сосудистой компрессии [9].
Наиболее частой причиной возникновения ТН является компрессия проксимальной части тригеминального корешка в пределах нескольких миллиметров от входа корешка в мост мозга (т. н. «входная зона корешка»). Примерно в 80% случаев происходит компрессия артериальным сосудом (чаще всего патологически извитой петлей верхней мозжечковой артерии). Этим объясняется тот факт, что ТН возникает в пожилом и старческом возрасте и практически не встречается у детей. В остальных случаях таковая компрессия вызвана аневризмой базилярной артерии, объемными процессами в задней черепной ямке, опухолями мостомозжечкового угла и бляшками рассеянного склероза [1, 8, 10, 11].
На экстракраниальном уровне основными факторами, приводящими к возникновению ТН, являются: туннельный синдром — компрессия в костном канале, по которому проходит нерв (чаще в подглазничном отверстии и нижней челюсти), связанная с его врожденной узостью, присоединением сосудистых заболеваний в пожилом возрасте, а также в результате хронического воспалительного процесса в смежных зонах (кариес, синуситы); местный одонтогенный или риногенный воспалительные процессы. Развитие ТН может провоцироваться инфекционными процессами, нейроэндокринными и аллергическими заболеваниями, демиелинизацией корешка тройничного нерва при рассеянном склерозе [7, 12].
В зависимости от воздействия патологического процесса на соответствующий отдел тригеминальной системы выделяют ТН преимущественно центрального и периферического генеза. В возникновении ТН центрального генеза большую роль играют нейроэндокринные, иммунологические и сосудистые факторы, которые приводят к нарушению реактивности корково-подкорковых структур и формированию очага патологической активности в ЦНС. В патогенезе ТН периферического уровня большую роль играют компрессионный фактор, инфекции, травмы, аллергические реакции, одонтогенные процессы [7, 8, 12].
Несмотря на появившееся в последние годы большое количество обзоров литературы и метаанализов, посвященных проблеме лечения НБ [13], к которой относится и ТН, среди исследователей не существует единого мнения относительно основных принципов медикаментозной терапии этого заболевания [14]. Лечение нейропатической боли все еще остается недостаточно эффективным: менее чем у половины пациентов отмечается значительное улучшение в результате проведенного фармакологического лечения [15, 16].
Проблема терапии тригеминальной невралгии на сегодняшний день остается не до конца решенной, что связано с неоднородностью данного заболевания в отношении этиологии, патогенетических механизмов и симптоматики, а также с малой эффективностью обычных анальгетических средств и развитием фармакорезистентных форм ТН, требующих проведения хирургического лечения. В современных условиях лечебная тактика при данном заболевании включает в себя медикаментозные и хирургические методы.
Основными направлениями медикаментозной терапии являются: устранение причины ТН, если она известна (лечение больных зубов, воспалительных процессов смежных зон и др.), и проведение симптоматического лечения (купирование болевого синдрома).
Патогенетическое лечение больных с ТН включает применение препаратов нейрометаболического, нейротрофического, антиоксидантного, антигипоксантного действия. В последние годы обнаружена высокая эффективность использования метаболических препаратов в комплексном лечении НБ [8, 17]. При лечении пациентов с ТН показана высокая эффективность препарата метаболического действия Актовегина — депротеинизированного деривата из крови молодых телят. Основное действие этого препарата заключается в стабилизации энергетического потенциала клеток за счет повышения внутриклеточного транспорта и утилизации глюкозы и кислорода. Актовегин обладает также антигипоксическим эффектом, являясь непрямым антиоксидантом. Кроме того, действие Актовегина проявляется непрямым вазоактивным и реологическим эффектами за счет повышения капиллярного кровотока, снижения периферического сосудистого сопротивления и улучшения перфузии органов и тканей [17]. Такой широкий спектр фармакологического действия Актовегина позволяет использовать его в терапии ТН. В период приступа целесообразно применение Актовегина внутривенно медленно струйно или капельно в течение 10 дней в дозе 400–600 мг/сутки. В межприступном периоде препарат назначается внутрь в дозе 200 мг 3 раза в сутки на протяжении 1–3 месяцев [8]. К патогенетическому лечению больных с ТН можно отнести применение высоких доз витаминов группы B в составе поликомпонентных препаратов, что обусловлено их полимодальным нейротропным действием (влиянием на обмен веществ, метаболизм медиаторов, передачу возбуждения в нервной системе), а также способностью существенно улучшать регенерацию нервов. Кроме того, витамины группы B обладают анальгезирующей активностью. К таким препаратам, в частности, относятся Мильгамма, Нейромультивит, Нейробион, содержащие сбалансированную комбинацию тиамина (B1), пиридоксина (B6), цианокобаламина (B12). Витамин B1 устраняет ацидоз, снижающий порог болевой чувствительности; активирует ионные каналы в мембранах нейронов, улучшает эндоневральный кровоток, повышает энергообеспечение нейронов и поддерживает аксоплазматический транспорт белков. Эти эффекты тиамина способствуют регенерации нервных волокон [18–20]. Витамин B6, активируя синтез миелиновой оболочки нервного волокна и транспортных белков в аксонах, ускоряет процесс регенерации периферических нервов, проявляя тем самым нейротропный эффект. Восстановление синтеза ряда медиаторов (серотонина, норадреналина, дофамина, гамма-аминомасляной кислоты (ГАМК) и активация нисходящих тормозных серотонинергических путей, входящих в антиноцицептивную систему, приводит к снижению болевой чувствительности (антиноцицептивное действие пиридоксина) [18, 21]. Витамин B12 участвует в процессах регенерации нервной ткани, активируя синтез липопротеинов, необходимых для построения клеточных мембран и миелиновой оболочки; уменьшает высвобождение возбуждающих нейротрансмиттеров (глутамата); обладает противоанемическим, гемопоэтическим и метаболическим эффектом [18, 22]. Для быстрого купирования боли и патогенетического нейротропного воздействия при ТН целесообразно использование парентеральной формы препарата Нейробион — комбинированного препарата витаминов группы B, содержащего оптимальное количество витамина B12 как в ампулированной, так и в таблетированной форме. Нейробион применяется в дозе 3 мл в сутки внутримышечно 2–3 раза в неделю — 10 инъекций (при выраженном болевом синдроме можно применять ежедневно в той же дозировке в течение 10–15 дней). Затем для усиления, пролонгирования терапевтического эффекта и профилактики рецидива заболевания назначается Нейробион в таблетированной форме в дозировке по 1 таблетке внутрь 3 раза в день в течение 1–2 месяцев [8].
Также препаратами выбора для лечения ТН являются антиконвульсанты, а карбамазепин стал одним из первых препаратов, официально зарегистрированных для лечения этого состояния [24].
В начале 90-х годов прошлого столетия появилась новая генерация противоэпилептических препаратов, и теперь антиконвульсанты обычно делят на препараты первого и второго поколения.
К антиконвульсантам первого поколения относятся фенитоин, фенобарбитал, примидон, этосуксимид, карбамазепин, вальпроевая кислота, диазепам, лоразепам, клоназепам. Препараты первого поколения практически не рассматриваются в качестве первой линии терапии НБ (за исключением карбамазепина при ТН) из-за недостаточного уровня обезболивающего эффекта и высокого риска возникновения нежелательных реакций. К наиболее частым побочным эффектам антиконвульсантов первого поколения относятся: реакции со стороны ЦНС (сонливость, головокружение, атаксия, седативный эффект или повышенная возбудимость, диплопия, дизартрия, когнитивные расстройства, ухудшение памяти и настроения), гематологические нарушения (агранулоцитоз, апластическая анемия, тромбоцитопения, лейкопения), гепатотоксичность, снижение минеральной плотности кости, кожные высыпания, гиперплазия десен, симптомы со стороны желудочно-кишечного тракта (рвота, анорексия). К антиконвульсантам второго поколения относятся прегабалин (Лирика), габапентин (Нейронтин, Габагамма, Тебантин), ламотриджин (Ламиктал), окскарбазепин (Трилептал), топирамат (Топамакс), леветирацетам (Кеппра), тиагабин (Габитрил), зонисамид (Зонегран), вигабатрин (Сабрил), фелбамат (Талокса). Эти препараты имеют более благоприятные фармакокинетические характеристики и профили безопасности, а также низкий риск лекарственных взаимодействий по сравнению с антиконвульсантами первого поколения [24, 25].
Основные механизмы действия антиконвульсантов 1-го и 2-го поколения представлены в таблице [26].
Первым антиконвульсантом, успешно используемым для лечения ТН, был фенитоин (Дифенин) [27]. Дифенин, производное гидантоина, близкого по химической структуре к барбитуровой кислоте, противопоказан при тяжелых заболеваниях почек, печени, сердечной недостаточности.
Согласно рекомендациям Европейской федерации неврологических сообществ (2009) фармакотерапия ТН основана, прежде всего, на использовании предложенного С. Блюмом в 1962 году карбамазепина (Финлепсина, Тегретола) (200–1200 мг/сутки), который является препаратом первого выбора (уровень доказательности A) [27, 28]. Противоболевое действие этого препарата обусловлено, главным образом, его способностью уменьшать проницаемость для натрия мембран нейронов, участвующих в ноцицептивных реакциях. Обычно назначается следующая схема лечения карбамазепином. В первые два дня суточная доза составляет 200 мг (по 1/2 таблетки утром и вечером), затем в течение двух дней суточная доза увеличивается до 400 мг (утром и вечером), а после этого — до 600 мг (по 1 таблетке утром, в обед и вечером). Если эффект недостаточный, то общее количество препарата в сутки может быть доведено до 800–1000 мг. У части больных ТН (около 15% в популяции) карбамазепин не оказывает анальгезирующего воздействия, поэтому в таких случаях применяется другой антиконвульсант — фенитоин.
Проведенные около 40 лет назад три плацебо-контролируемые исследования, которые включали в себя в общей сложности 150 пациентов с ТН, показали эффективность карбамазепина в отношении как частоты, так и интенсивности пароксизмов [24]. Рядом авторов было показано, что карбамазепин может уменьшить болевую симптоматику приблизительно в 70% случаев. [29]. Однако применение карбамазепина ограничено фармакокинетическими факторами и возникающими в ряде случаев тяжелыми побочными эффектами (например, синдром Стивенса–Джонсона), особенно у пожилых пациентов.
Окскарбазепин (Трилептал) имеет структурное сходство с карбамазепином, но гораздо лучше переносится пациентами и имеет гораздо меньше побочных эффектов. Обычно окскарбазепин используется в начале лечения ТН в дозе 600–1800 мг/сутки (уровень доказательности B) [30].
В качестве дополнительной терапии ТН показана эффективность ламотриджина (Ламиктала) в дозе 400 мг/сутки [31] и баклофена в дозе 40–80 мг/сутки [32], которые относятся к препаратам второй линии (уровень доказательности C). Малые открытые исследования (класс IV) свидетельствуют об эффективности применения клоназепама, вальпроата, фенитоина [33, 34]. Указанная терапия наиболее эффективна при классической форме ТН. При ТН периферического генеза в схемы лечения предпочтительно включать ненаркотические анальгетики, а в случае развития хронического болевого синдрома (более трех месяцев) показано назначение антидепрессантов (амитриптилин) [7, 12].
Габапентин (Нейронтин) — первый в мире препарат, который был зарегистрирован для лечения всех видов нейропатической боли. Во многих исследованиях была показана эффективность габапентина у больных с ТН, не отвечающих на лечение другими средствами (карбамазепин, фенитоин, вальпроаты, амитриптилин); при этом в большинстве случаев наблюдалось полное купирование болевого синдрома [35]. Терапевтическая доза составляет от 1800 до 3600 мг/сутки. Препарат принимают 3 раза в сутки по следующей схеме: 1-я неделя — 900 мг/сутки, 2-я неделя — 1800 мг/сутки, 3-я неделя — 2400 мг/сутки, 4-я неделя — 3600 мг/сутки.
Недавно были опубликованы результаты открытого проспективного 12-месячного исследования 53 пациентов с ТН, в котором оценивалась эффективность прегабалина (Лирики) в дозе 150–600 мг/сутки. Лечение прегабалином привело к обезболиванию или, по крайней мере, к 50%-му снижению интенсивности боли у 25% и 49% пациентов соответственно [36]. В другом мультицентровом проспективном 12-недельном исследовании 65 больных, резистентных к предшествующей анальгетической терапии, лечение прегабалином в средней дозе 196 мг/сутки (в подгруппе монотерапии) и 234 мг/день (в подгруппе политерапии) приводило к уменьшению интенсивности боли ≥ 50% в среднем у 60% больных, а также уменьшало степень выраженности тревоги, депрессии и нарушений сна [37]. При лечении ТН начальная доза прегабалина может составлять 150 мг/сутки в 2 приема. В зависимости от эффекта и переносимости дозу можно увеличить до 300 мг/сутки через 3–7 дней. При необходимости можно увеличить дозу до максимальной (600 мг/сутки) через 7-дневный интервал.
Впервые об использовании леветирацетама (Кеппра) при лечении ТН сообщили в 2004 году K. R. Edwards et al. [38]. Механизм действия леветирацетама неизвестен; имеются данные, полученные в экспериментах на животных, что он является селективным блокатором N-типа кальциевых каналов [39]. Свойства этого препарата особенно подходят для лечения пациентов с ТН с тяжелой болью, нуждающихся в быстром ответе на терапию. Фармакокинетика леветирацетама линейна и предсказуема; концентрация в плазме крови увеличивается пропорционально дозе в пределах клинически обоснованного диапазона от 500 до 5000 мг [40]. В отличие от других антиконвульсантов, особенно карбамазепина, в метаболизм леветирацетама не вовлечена система печеночного цитохрома Р450 и препарат экскретируется через почки [41]. Кроме того, данный препарат характеризуется благоприятным терапевтическим индексом и имеет незначительное число неблагоприятных побочных эффектов (что является основной проблемой при использовании препаратов для лечения ТН) [42]. Побочными эффектами леветирацетама, о которых обычно сообщают, являются: астения, головокружение, сонливость, головная боль и депрессия. В 10-недельном проспективном открытом исследовании показано, что для лечения ТН по сравнению с терапией эпилепсии были необходимы более высокие дозы леветирацетама, составляющих 3000–5000 мг/день (50–60 мг/кг/день), которые, тем не менее, не вызвали значительных побочных эффектов. Это обстоятельство свидетельствует о перспективе использования этого лекарственного средства для лечения ТН [43].
В одном отечественном исследовании отмечены положительные результаты при комбинации карбамазепина и габапентина [44].
С 1970-х годов прошлого столетия для лечения ТН стали использовать антидепрессанты [45]. В настоящее время доказана эффективность использования трициклических антидепрессантов (ТЦА) при лечении ТН [46].
До настоящего времени подбор анальгезирующей терапии НБ является скорее искусством, чем наукой, поскольку выбор препаратов осуществляется в основном эмпирически. Нередки ситуации, когда применение одного препарата оказывается недостаточно эффективным и возникает потребность в комбинации лекарственных средств. Назначение «рациональной полифармакотерапии» (одновременное применение препаратов, обладающих нейротропным, нейрометаболическим и анальгезирующим механизмами действия) позволяет повысить эффективность лечения при меньших дозировках препаратов и меньшем количестве побочных эффектов [47].
Пациентам, длительно страдающим от непереносимой боли, и при неэффективности консервативной терапии в случае классической ТН рекомендуется хирургическое лечение. В настоящее время используются следующие подходы:
1) хирургическая микроваскулярная декомпрессия [48]; 2) стереотаксическая лучевая терапия, гамма-нож [49]; 3) чрескожная баллонная микрокомпрессия [50]; 4) чрескожный глицериновый ризолизис [51]; 5) чрескожное радиочастотное лечение Гассерова узла [52].
Наиболее эффективным методом хирургического лечения ТН является метод P. Janetta, заключающийся в размещении специальной прокладки между тройничным нервом и раздражающим сосудом; в отдаленном периоде эффективность лечения составляет 80% [53–55].
В заключение заметим, что лечение ТН должно носить мультидисциплинарный характер, при этом c пациентом должны быть обсуждены выбор различных методов лечения и риски возможных осложнений.
Литература
- Карлов В. А. Неврология лица. М.: Медицина, 1991. 288 с.
- O’Connor A. B. Neuropathic pain: quality-of-life impact, costs and cost effectiveness of therapy // Pharmacoeconomics. 2009. Vol. 27, № 2. P. 95–112.
- Jensen M. P., Chodroff M. J., Dworkin R. H. The impact of neuropathic pain on health-related quality of life: review and implications // Neurology. 2007. Vol. 68. P. 1178–1182.
- Болевые синдромы в неврологической практике. Под ред. А. М. Вейна. М.: МЕДпресс-информ, 2001. 368 с.
- Love S., Coakham H. B. Trigeminal neuralgia: pathology and pathogenesis // Brain. 2001. Vol. 124, № 12. P. 2347–2360.
- Турбина Л. Г., Гордеев С. А., Зусьман А. А. Тригеминальная невралгия. Эпидемиология, патогенез, клиника, диагностика, лечение // Сборник трудов Московской областной ассоциации неврологов «Всемирный день инсульта в Подмосковье 29 октября 2009 г. »: Сб. статей. М., 2009. С. 65–70.
- Грицай Н. Н., Кобзистая Н. А. Классическая невралгия тройничного нерва и одонтогенный болевой синдром // Новости медицины и формации. 2009. № 299. С. 23–25.
- Товажнянская Е. Л. Невралгия тройничного нерва: современные аспекты комплексной терапии // Междунар. неврол. журн. 2010. № 3 (33). С. 141–145.
- Международная классификация головных болей. 2-е издание. М.: «ГлаксоСмитКляйн Трейдинг», 2003. 380 с.
- Kress B., Schindler M., Rasche D. MRI volumetry for the preoperative diagnosis of trigeminal neuralgia // Eur. Radiol. 2005. Vol. 15. P. 1344–1348.
- Rasche D., Kress B., Stippich C. et al. Volumetric measurement of the pontomesencephalic cistern in patients with trigeminal neuralgia and healthy controls // Neurosurgery. 2006. Vol. 59. P. 614–620.
- Степанченко А. В. Типичная невралгия тройничного нерва. М.: Изд. Группа «ВХМ», 1994. 39 с.
- Saarto T., Wiffen P. J. Antidepressants for neuropathic pain // Cochrane Database Syst. Rev. 2007. Vol. 4: CD005454.
- Chong M. S., Bajwa Z. H. Diagnosis and treatment of neuropathic pain // J. Pain Symptom Manage. 2003. Bd. 25. (Suppl. 5). S. 4–11.
- Dworkin R. H., Backonja M., Rowbotham M. C. et al. Advances in neuropathic pain: diagnosis, mechanism, and treatment recommendation // Arch. Neurol. 2003. Vol. 60. P. 1524–1534.
- Finnerup N. B., Otto M., McQuay H. J. et al. Algorithm for neuropathic pain treatment: an evidence based proposal // Pain. 2005. Vol. 118, № 3. P. 289–305.
- Аметов А. С., Дадаева Е. Е., Строков И. А. с соавт. Актовегин в лечении заболеваний центральной и периферической нервной системы // Рус. мед. журн. 2007. Т. 15, № 24. С. 1824–1827.
- Луцкий И. С., Лютикова Л. В., Луцкий Е. И. Витамины группы B в неврологической практике // Междунар. неврол. журн. 2008. № 2. С. 89–93.
- Ba A. Metabolic and structural role of thiamine in nervous tissues // Cell. Mol. Neurobiol. 2008. Vol. 28. P. 923–931.
- Gibson G. E., Blass J. T. Thiamin-dependent processes and treatment strategies in neurodegeneration // Antioxid. Redox Signal. 2007. Vol. 9. P. 1605–1619.
- Wilson R. G., Davis R. E. Clinical chemistry of vitamin B6 // Adv. Clin. Chem. 1983. Vol. 23. P. 1–68.
- Solomon L. R. Disorders of cobalamin (vitamin B12) metabolism: emerging concept in patophysiology, diagnosis and treatment // Blood Rev. 2007. Vol. 21. P. 113–130.
- Тригеминальная невралгия. Интернет-обзор // Междунар. неврол. журн. 2010. № 2 (32). С. 103–104.
- Wiffen P. J., McQuay H. J., Moore R. A. Carbamazepine for acute and chronic pain. Cochrane Database Syst. Rev. 2005. Vol. 3: CD005451.
- Richter R. W., Portenoy R., Sharma U. et al. Relief of diabetic peripheral neuropathy with pregabalin: a randomised placebo-controlled trial // J. Pain. 2005. Vol. 6. P. 253–260.
- Кукушкин М. Л. Неврогенная (Невропатическая боль) // Междунар. неврол. журн. 2007. № 2 (12). С. 141–145.
- Sindrup S. H., Jensen T. S. Pharmacotherapy of trigeminal neuralgia // Clin. J. Pain. 2002. Vol. 18. P. 22–27.
- Jorns T. P., Zakrzewska J. M. Evidence-based approach to the medical management of trigeminal neuralgia // Br. J. Neurosurg. 2007. Vol. 21. P. 253–61.
- Gronseth G., Cruccu G., Alksne J. et al. Practice parameter: the diagnostic evaluation and treatment of trigeminal neuralgia (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the European Federation of Neurological Societies // Neurology. 2008. Vol. 71. P. 1183–1190.
- Jensen T. S. Anticonvulsants in neuropathic pain: rationale and clinical evidence // European Journal of Pain. 2002. Vol. 6 (Suppl. A). P. 61–68.
- Zakrzewska J. M., Chaudhry Z., Nurmikko T. J. et al. Lamotrigine (lamictal) in refractory trigeminal neuralgia: results from a double-blind placebo controlled crossover trial // Pain. 1997. Vol. 73. P. 223–230.
- Fromm G. H., Terrence C. F. Comparison of L-baclofen and racemic baclofen in trigeminal neuralgia // Neurology. 1987. Vol. 37. P. 1725–1728.
- Камчатов П. В. Невропатическая боль: проблемы и решения // НейроNEWS. 2009. № 4. С. 45–47.
- Attal N., Cruccu G., Haanpaa M. et al. EFNS guidelines on pharmacological treatment of neuropathic pain // European Journal of Neurology. 2006. Vol. 13. P. 1153–1169.
- Cheshire W. Defining the role for gabapentin in the treatment of trigeminal neuralgia: a retrospective study // J. Pain. 2002. Vol. 3. P. 137–142.
- Obermann M., Yoon M. S., Sensen K. et al. Efficacy of pregabalin in the treatment of trigeminal neuralgia // Cephalalgia. 2008. Vol. 28. P. 174–181.
- Perez C., Navarro A., Saldana M. T. et al. Patient-reported outcomes in subjects with painful trigeminal neuralgia receiving pregabalin: evidence from medical practice in primary care settings // Cephalalgia. 2009. Vol. 29. P. 781–790.
- Edwards K. R., O’Connor J. T., Button J. Levetiracetam for the treatment of trigeminal neuralgia // Epilepsia. 2004. Vol. 45 (Suppl. 7). P. 306.
- Lukyanetz E. A., Shkryl V. M., Kostyuk P. G. Selective blockade of N-type calcium channels by levetiracetam // Epilepsia. 2002. Vol. 43. P. 9–18.
- Patsalos P. N. Pharmacokinetic profile of levetiracetam: toward ideal characteristics // Pharmacol. Ther. 2000. Vol. 85. P. 77–85.
- Brockmoller J., Thomsen T., Wittstock M. et al. Pharmacokinetics of levetiracetam in patients with moderate to severe liver cirrhosis (Child-Pugh classes A, B, and C): characterization by dynamic liver function tests // Clin. Pharmacol. Ther. 2005. Vol. 77. P. 529–541.
- Zakrzewska J. M. Consumer views on management of trigeminal neuralgia // Headache. 2001. Vol. 41. P. 369–376.
- Jorns T. P., Johnston A., Zakrzewska J. M. Pilot study to evaluate the efficacy and tolerability of levetiracetam (Keppra®) in treatment of patients with trigeminal neuralgia // European Journal of Neurology. 2009. Vol. 16. P. 740–744.
- Степанченко А. В., Шаров М. Н. Применение габапентина при лечении обострений невралгии тройничного нерва // Боль. 2005. Т. 3, № 8. С. 58–61.
- Braune S. Evidence-based pharmacotherapy of neuropathic pain syndromes // MMW Fortschr. Med. 2004. Vol. 146, № 50. P. 49–51.
- Cruccu G. Treatment of painful neuropathy // Curr. Opin. Neurol. 2007. Vol. 20, № 5. P. 531–535.
- Hall G. C., Carroll D., Parry D., McQuay H. J. Epidemiology and treatment of neuropathic pain: The UK primary care perspective // Pain. 2006. Vol. 122. P. 156–162.
- Janetta P. Trigeminal neuralgia: treatment bymicrovascular decompression // Neurosurgery/Eds. Wilkins R., Regachary S. New York: McGrawy-Hill, 1996. P. 3961–3968.
- Perez C., Galvez R., Huelbes S. et al. Validity and reliability of the Spanish version of the DN4 (Douleur Neuropathique 4 questions) questionnaire for differential diagnosis of pain syndromes associated to a neuropathic or somatic component // Health Qual Life Outcomes. 2007. Vol. 5. P. 66.
- Mullan S., Lichtor T. Percutaneous microcompression of the trigeminal ganglion for trigeminal neuralgia // J. Neurosurg. 1983. Vol. 59. P. 1007–1012.
- Hakanson S. Trigeminal neuralgia treated by the injection of glycerol into the trigeminal cistern // Neurosurgery. 1981. Vol. 9. P. 638–646.
- Sweet W. H., Wepsic J. G. Controlled thermocoagulation of trigeminal ganglion and root for differential destruction of pain fibers. Part I: trigeminal neuralgia // J. Neurosurg. 1974. Vol. 39. P. 143–156.
- Barker F. G., Jannetta P. J., Bissonette D. J. et al. The long-term outcome of microvascular decompression for trigeminal neuralgia // N. Engl. J. Med. 1996. Vol. 334. P. 1077–1083.
- Tyler-Kabara E. C., Kassam A. B., Horowitz M. H. et al. Predictors of outcome in surgically managed patients with typical and atypical trigeminal neuralgia: Comparison of results following microvascular decompression // J. Neurosurg. 2002. Vol. 96. P. 527–531.
- Jannetta P. J. Microsurgical management of trigeminal neuralgia // Arch. Neurol. 1985. Vol. 42. P. 800.
С. А. Гордеев*, доктор медицинских наук Л. Г. Турбина**, доктор медицинских наук, профессор А. А. Зусьман**, кандидат медицинских наук *Первый МГМУ им. И. М. Сеченова, **МОНИКИ им. М. Ф. Владимирского, Москва
Контактная информация об авторах для переписки
Осложнения
Осложнения межреберной невралгии возникают довольно редко, однако в тяжелых случаях без соответствующего лечения пациент может столкнуться со следующими проблемами:
- сильный спазм дыхательной мускулатуры, ограничивающий вдох и выдох;
- невозможность встать с кровати из-за значительного усиления боли;
- чрезмерно выраженный болевой синдром, не снимающийся обычными анальгетиками и НПВС;
- нарушения сердечного ритма из-за мышечных спазмов и патологии нервов;
- снижение подвижности ног.
Кроме того, осложнения могут быть спровоцированы попытками лечиться вне клиники. Абсцессы и флегмоны после иглоукалывания, параличи и снижение чувствительности после мануальной терапии – это далеко не полный список проблем. Именно поэтому не стоит лечить межреберную невралгию как самостоятельно, так и с помощью сомнительных специалистов.
Профилактика
Профилактика межреберной невралгии – это, в основном, общие мероприятия, направленные на укрепление мышечного каркаса и оздоровление организма. Неврологи рекомендуют:
- вести активный образ жизни, заниматься спортом на любительском уровне;
- минимизировать переохлаждения и простудные заболевания;
- следить за своей осанкой;
- избегать поднятия тяжестей;
- поддерживать высокий уровень иммунитета;
- сбалансировано питаться, при необходимости дополнительно принимать витамины, особенно группы В;
- своевременно лечить хронические заболевания;
- избегать стрессов, полноценно отдыхать и обеспечивать себе минимум 8 часов ночного сна каждые сутки.
Выполнение этих простых правил существенно снизит риск развития межреберной невралгии.
Профилактика межреберной невралгии
Главная мера профилактики – это занятия гимнастикой. Нужно выполнять упражнения, способствующие развитию мышц, укреплению и подвижности позвоночника. Избегайте сквозняков, неудобных поз и избыточных физических нагрузок. Всё должно быть в меру.
Важно контролировать осанку, не поднимать чрезмерные тяжести, рационально и сбалансированно питаться, принимать витамины, избегать голоданий и монодиет.
Не забывайте вовремя проводить терапию заболеваний, которые могут стать причиной развития невралгии.
Лечение в клинике «Энергия здоровья»
Врачи клиники «Энергия здоровья» всегда придут на помощь пациентам с межреберной невралгией. Мы предлагаем каждому клиенту:
- полноценное обследование с консультациями узких специалистов для точной постановки диагноза;
- индивидуальный подбор схемы лечения;
- услуги квалифицированного мануального терапевта;
- собственный кабинет ЛФК для максимально эффективных и безопасных занятий;
- современные методы физиотерапии;
- лечебный массаж;
- медикаментозные блокады при выраженном болевом синдроме.
Регулярное наблюдение невролога после стихания острого периода заболевания поможет предотвратить повторные приступы.
Преимущества клиники
В отделении неврологии клиники «Энергия здоровья» каждого пациента ждут специалисты самого высокого уровня и современное оборудование для диагностики и лечения заболеваний. Мы придерживаемся комплексного подхода к терапии и используем не только лекарственные препараты, но и физиотерапию, ЛФК и массаж.
Лечение назначается только после тщательного обследования и контролируется специалистом до полного выздоровления пациентов. Адекватные цены, удобное расположение, собственная парковка – мы делаем все для удобства клиентов.
Если межреберная невралгия мешает жить, ходить и двигаться, не откладывайте лечение в долгий ящик. Записывайтесь в клинику «Энергия здоровья» и избавьтесь от боли.
Эпидуральное введение анестетиков и стероидных гормонов
Эпидуральная блокада позвоночника предусматривает введение препаратов в эпидуральное пространство, что приводит к утрате чувствительности в области воздействия. Это значит, что данная процедура предусматривает введение действующего вещества непосредственно в источник боли. Достижение лечебного эффекта в данном случае возможно за счёт следующих факторов:
- обезболивающие свойства препарата;
- максимально возможная концентрация в поражённой области;
- рефлекторное действие на всех уровнях нервной системы.