Мозг человека не только непрерывно трудится в течение жизни человека, но и стареет вместе с ним. Под действием лет, образа жизни человека и прочих факторов начинаются различные деструктивные процессы в нем. Некоторые из них могут серьезно сказаться на жизнедеятельности в целом. Так, например, одним из неприятных вариантов является атрофия головного мозга.
Она представляет собой изменений, приводящие к истощению тканей и утрате функций органа. Как правило, когда говорят про атрофию мозга, имеют в виду, что начались процессы омертвения нервных клеток, а также присутствует разрыв нейронных связей внутри групп, связанных либо по химическим признакам, либо функционально. На фоне атрофии начинает снижаться объем мозговой ткани. Иногда такую ситуацию в народе называют усыханием мозга.
Статья по теме Ученые опровергли. Высшее образование не влияет на молодость мозга? На фоне отмирания клеток начинают проявляться серьезные осложнения. Так, например, страдают когнитивные способности, то есть человек начинает хуже говорить и мыслить, у него отмечаются проблемы с ориентацией в пространстве, ухудшается понимание и логика, страдают такие способности, как рассуждение, вычисление, обучение. Могут развиться и проблемы с движением. При этом стоит понимать, что отмирание нейронов не происходит одномоментно — нередки ситуации, когда между началом деструктивного процесса и появлением больших поврежденных участков в мозгу проходит несколько десятков лет.
Разрушение в мозге человека может быть очаговым, то есть когда затрагивается какой-то один фрагмент, а может стать и генерализованным, когда дегенеративные процессы отмечаются во всех областях. При том острая очаговая атрофия обычно расценивается специалистами как признак болезни или травмы. Бывают и врожденные проявления, которые, как правило, дают первые симптомы еще в детском возрасте.
Атрофия головного мозга: причины, симптомы, диагностика
Атрофические изменения коры головного мозга приводят к разрушению нейронных связей, снижению активности функциональных центров. Состояние приводит к нарушению внутримозгового метаболизма, слабоумию, формированию ряда психических заболеваний (Альцгеймера, боковой амиотрофический склероз, деменция).
Клинические симптомы зависят от вида, стадии, степени заболевания. Мультисистемная форма сопровождается диффузной гибелью нейронов, постепенной утратой функций организма.
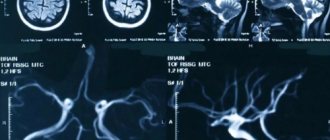
Атрофия мозга на МРТ
Что подразумевается под отмиранием нейронов?
В общем случае атрофические изменения головного мозга не считаются болезнью. Атрофия может появиться не только в результате прогрессирования заболевания, но и сама стать причиной развития недуга.
Точнее говоря, атрофия головного мозга – это патологическая активность, которая разглаживает ткани мозговой коры, уменьшает размеры, вес и убивает нейронные сети ГМ. Следовательно, это затрагивает интеллектуальную деятельность и другие функции человека.
Данная патология больше всего присуща людям в старческом возрасте. Каждый знает о том, что люди в возрасте 70-80 лет начинают страдать слабоумием, частичной потерей памяти и аналогичными проблемами. Но и нельзя сказать, что такое не сможет случиться с молодым человеком или даже с новорожденным ребенком.
Такие изменения приводят к переменам в характере человека и его жизни. Отсюда мы и сделаем вывод. Под отмиранием нейронов головного мозга подразумевается:
- ухудшение или полная потеря памяти;
- речевые нарушения;
- нарушение моторики;
- снижение интеллекта.
Причины возникновения атрофии мозга
После 50 лет увеличивается риск нейродегенеративных состояний. Повышают вероятность появления нозологической формы провоцирующие факторы:
- Снижение функции почек (недостаточность);
- Длительное увеличение внутричерепного давления (гидроцефалия);
- Частое употребление алкоголя, наркотические средства;
- Инфекционное поражение коры мозга (ретровирусы, полиомиелит, энцефалит);
- Черепно-мозговая травма;
- Сосудистые заболевания (тромбоз, атеросклероз, аневризма);
- Метаболические состояния;
- Психические болезни – Альцгеймера, синдрома Иценко-Кушинга, Паркинсона, Уиппла, Геллервордена-Шпатца.
Увеличивает вероятность нозологии – метаболические расстройства, родовые травмы, половые инфекции, недостаток витаминов группы B, фолиевой кислоты.
Основные причины возникновения атрофии коры мозга
Научные исследования показывают высокую вероятность поражения кортикальных и субкортикальных структур у людей 50-55 лет из-за генетической предрасположенности. Кортикальная атрофия развивается у пациентов, страдающих наследственной хореей Хантингтона.
Другие причины:
- Черепно-мозговые травмы, сопровождающиеся гематомой, гибелью нейронов, формированием кист;
- Хронический алкоголизм, наркомания, прием некоторых медикаментов обеспечивает уменьшение толщины полушарий мозга, подкоркового шара. Длительная спиртовая интоксикация нарушает внутриклеточный метаболизм, обеспечивает постепенное отмирание нейронов;
- Хроническую церебральную (мозговая) ишемию формируют сосудистые заболевания (атеросклероз, гипертоническая болезнь). Недостаток поступления кислорода способствует необратимой гибели тканей;
- Врожденная гидроцефалия у новорожденных приводит к повышению внутричерепного давления, атрофии мозгового вещества;
- Более семидесяти процентов случаев заболевания у людей старше 55 лет приходится на долю нейродегенеративных заболеваний – Пика, Леви, Альцгеймера, Паркинсона. Нозологии формируют старческое слабоумие.
Менее частые этиологические факторы нозологии – гипоксия новорожденных, гидроцефалия, множественные врожденные кисты у ребенка.
Причины церебральной атрофии новорожденных
Основным этиологическим фактором уменьшения толщины полушарий новорожденных является внутриутробная гипоксия, проблемы во время родов. Повреждения головы малыша при прохождении по родовым путям провоцируют черепно-мозговую травму, способствуют появлению гидроцефалии (водянки).
Причины атрофических церебральных изменений новорожденных:
- Повреждение костей черепа;
- Увеличение количества спинномозговой жидкости (гидроцефалия);
- Внутриутробные инфекции (цитомегалия, герпес, менингит).
Не существует эффективных методов лечения атрофии новорожденных. Своевременное выявление с помощью МРТ позволяет назначить поддерживающую терапию, уменьшить прогрессирование заболевания. Умеренные изменения коррелируются медикаментозной терапией. Ребенок сможет посещать детский сад, учиться в специальной школе.
Классификация
Демиелинизирующее заболевание нервной системы классифицируется на различные типы, в основе которых лежит разрушение миелиновой оболочки. В связи с этим рассматриваемая патология подразделяется соответствующим образом на рассеянный склероз, болезнь Марбурга, болезнь Девика, прогрессирующую мультифокальную лейкоэнцефалопатию и синдром Гийена-Барре.
Рассеянный склероз
Рассеянный склероз характеризуется как тяжелое хроническое и дезиммуно- нейродегенеративное заболевание ЦНС, склонное к прогрессированию. В большинстве случаев заболевание встречается в молодом возрасте и почти всегда приводит к инвалидности. Этому демиелинизирующему заболеванию ЦНС по МКБ-10 присвоен код G35.
В настоящее время причины развития рассеянного склероза до конца не изучены. Большинство ученых склоняются к мультифакторной теории развития этого заболевания, когда сочетается генетическая предрасположенность и внешние факторы. К числу последних относятся:
- инфекционные заболевания;
- состояние хронической интоксикации;
- прием некоторых лекарственных средств;
- смена места жительства с резкой сменой климата;
- недостаток клетчатки и высококалорийная диета.
Прогрессирование рассеянного склероза характеризуется развитием следующей симптоматики:
- нарушения чувствительности (мурашки по коже, онемение, покалывание, жжение, зуд);
- расстройство зрения (нарушение цветопередачи, снижение остроты зрения, размытость картинки);
- дрожание конечностей или туловища;
- головные боли;
- нарушения речи и затруднение глотания;
- мышечные спазмы;
- изменения походки;
- когнитивные нарушения;
- непереносимость тепла;
- головокружение;
- хроническая усталость;
- нарушение либидо;
- тревожность и депрессия;
- нестабильность стула;
- бессонница;
- вегетативные расстройства.
Лечение рассеянного склероза осуществляется с помощью таких методов, как:
- плазмаферез;
- прием цитостатиков;
- назначение иммуносупрессоров;
- применение иммуномодуляторов;
- прием бета интерферонов;
- гормональная терапия.
- симптоматическая терапия с назначением антиоксидантов, ноотропных препаратов и витаминов.
В период ремиссии пациентам показано санаторно-курортное лечение, массаж, лечебная физкультура. При этом должны быть исключены все тепловые процедуры. Для облегчения симптомов заболевания назначаются препараты: снижающие мышечный тонус, устраняющие тремор, нормализующие мочеиспускание, стабилизирующие эмоциональный фон, противосудорожные средства.
Болезнь Марбурга
Геморрагическая лихорадка или болезнь Марбурга представляет собой острую инфекционную патологию, вызванную марбургским вирусом. Он проникает в организм через поврежденную кожу и слизистую оболочку глаз и полости рта.
Симптоматика заболевания зависит от стадии патологического процесса. Инкубационный период длится от 2 до 16 дней. Болезнь имеет острое начало и характеризуется повышением температуры тела до высоких показателей. Наряду с температурой может появиться озноб. Нарастают признаки интоксикации, такие как разбитость, головная боль, боль в мышцах и суставах, интоксикация и обезвоживание. Через 2-3 дня после этого присоединяются расстройство функционирования ЖКТ и геморрагический синдром.
Все симптомы усиливаются к концу первой недели. Также могут наблюдаться кровотечения, из носа, желудочно-кишечного тракта, половых путей. К началу 2 недели все признаки интоксикации достигает своего максимума. При этом возможны судороги и потеря сознания. По анализу крови происходят специфические изменения: тромбоцитопения, пойкилоцитоз, анизоцитоз, зернистость эритроцитов.
При подозрении у человека болезни Марбурга он экстренно госпитализируется в инфекционное отделение и должен находиться в изолированном боксе. Период выздоровления может затянуться до 21-28 дней.
Болезнь Девика
Оптикомиелит или болезнь Девика по хронической картине похож на рассеянный склероз. Это аутоиммунное заболевание, причины возникновения которого до сих пор не выяснены. В качестве одной из причин его развития отмечается увеличение проницаемости барьера между мозговой оболочкой и сосудом.
Некоторые аутоиммунные заболевания способны спровоцировать прогресс болезни Девика:
- ревматоидный артрит;
- системная красная волчанка;
- синдром Шегрена;
- дерматомиозит;
- тромбоцитопеническая пурпура.
Болезнь имеет специфическую симптоматику. Клинические проявления обусловлены нарушением проводящих импульсов. Кроме того, поражается зрительный нерв и ткань спинного мозга. В большинстве случаев болезнь заявляет о себе нарушением зрения:
- пелена перед глазами;
- боль в глазницах;
- размытость зрения.
При прогрессировании заболевания и отсутствии адекватного лечения больной рискует полностью потерять зрение. В некоторых случаях возможен регресс симптоматики с частичным восстановлением функций глаз. Иногда случается так, что миелит предшествует невриту.
Оптиконевромиелит имеет два варианта течения: поступательное нарастание симптоматики с одновременным поражением ЦНС. В редких случаях встречается монофазное течение болезни. Оно характеризуется устойчивым прогрессом и усугублением симптоматики. В этом случае повышен риск летального исхода. При правильно подобранном лечении патологический процесс замедляется, но при этом полное выздоровление не гарантируется.
Второй вариант, наиболее распространенный, характеризуется поочередной сменой ремиссии и обострения и обозначается понятием «рецидивирующее течение». Также сопровождается зрительными нарушениями и расстройством функции спинного мозга. В период ремиссии человек ощущает себя здоровым.
Для выявления болезни Девика проводится комплекс мероприятий. Помимо стандартных диагностических процедур проводится люмбальная пункция с анализом ликвора, офтальмоскопия и МРТ позвоночника и головного мозга.
Прогрессирующая мультифокальная лейкоэнцефалопатия
Люди с иммунным дефицитом могут столкнуться с прогрессирующей многоочаговой мультифокальной лейкоэнцефалопатией. Это инфекционное заболевание, спровоцированное проникновением в организм вируса JC, относящегося к семейству Полиомавирусов. Особенностью патологии является то, что происходит несимметричное и многоочаговое поражение головного мозга. Вирусом поражаются оболочки нервных окончаний, состоящие из миелина. Поэтому данное заболевание принадлежит к группе демиелинизирующих патологий.
Почти 85% пациентов с таким диагнозом являются больными СПИДом или ВИЧ инфицированными. В группу риска входят пациенты со злокачественными опухолями.
Основные симптомы заболевания:
- перепады настроения;
- зрительные нарушения;
- парестезия и паралич;
- нарушение памяти.
Синдром Гийена-Барре
Острое воспалительное заболевание, характеризующееся «демиелинизирующей полирадикулоневропатией». В ее основе лежат аутоиммунные процессы. Болезнь проявляется сенсорными расстройствами, мышечной слабостью и болью. Для нее характерны гипотония и расстройство сухожильных рефлексов. Также может наблюдаться дыхательная недостаточность.
Все пациенты с таким диагнозом должны госпитализироваться в отделение интенсивной терапии. Поскольку существует риск развития дыхательной недостаточности и может потребоваться подключение к ИВЛ, в отделении должна быть реанимация.
Субатрофия мозга – первая стадия старческого слабоумия
До возникновения клинических симптомов развиваются субатрофические изменения. Внешние симптомы отсутствуют. Состояние сопровождается частичным снижением функции сегмента полушарий.
Морфологические виды субатрофии:
- Лобная;
- Лобно-височная;
- Теменно-затылочная.
Первая разновидность характеризуется снижением умственной активности, потерей речевых и двигательных функций.
Повреждение лобно-височных областей приводит к снижению слуховой способности человека, утрачиваются коммуникативные функции (сложности общения с другими людьми), нарушается функционирование сердечнососудистой системы.
Субатрофия уменьшает объем серого и белого вещества. Возникают нарушения проводниковой, двигательной функции, мелкой моторной активности.
Особенности кортикальной атрофии
Отмирание корковых клеток начинается с лобных долей, где располагаются функциональные центры контроля движения, речи. Постепенно атрофия распространяется на окружающие структуры. У пожилых людей патология приводит к старческому слабоумию.
Диффузные кортикальные изменения сопровождаются расстройством микроциркуляции, прогрессирующими клиническими симптомами. Нарушается мелкая моторика верхних конечностей, координация движений. Патологический комплекс приводит к болезни Альцгеймера, старческому слабоумию.
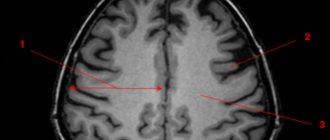
МРТ при кортикальной атрофии показывает уменьшение размеров лобных долей. Если изменения с обеих сторон, нарушается работа внутренних органов, контролируемых лобными долями.
Врожденная корковая атрофия новорожденных локализуется с одной стороны. Симптоматика выражена слабо. С помощью реабилитационных процедур удается социализировать ребенка.
Симптомы
Демиелинизация всегда проявляется неврологическим дефицитом. Этот признак свидетельствует о начале процесса разрушения миелина. В него вовлекается и иммунная система. Атрофируются ткани мозга — спинного и головного, а также наблюдается расширение желудочков.
Проявления демиелинизации находятся в зависимости от вида заболевания, причинных факторов и локализации очага. Симптоматика может отсутствовать, когда поражение мозгового вещества незначительное, до 20%. Это обусловлено компенсаторной функцией: здоровые ткани мозга выполняют задачи пораженных очагов. Неврологическая симптоматика проявляется редко — только при повреждении более 50% нервной ткани.
В качестве общих признаков демиелинизирующих заболеваний головного мозга отмечаются следующие:
- параличи;
- ограниченная подвижность мышц;
- тонические спазмы конечностей;
- нарушение функционирования кишечника и мочевого пузыря;
- псевдобульбарный синдром (нарушение произношения звуков, затруднение глотания, изменение голоса);
- нарушение мелкой моторики рук;
- онемение кожи и покалывание;
- зрительная дисфункция (снижение остроты зрения, размытость картинки, колебания глазных яблок, искажения цвета).
Нейропсихологические нарушения, характерные для рассматриваемой патологии, вызваны ухудшением памяти и снижением мыслительной деятельности, а также изменениями поведения и личностных качеств. Это проявляется развитием неврозов, депрессии, слабоумием органического генеза, эмоциональными перепадами, выраженной слабостью и снижением работоспособности.
Клинические симптомы мультисистемной атрофии
Диффузная нейродегенерация сопровождается проблемами со стороны половой, мочевыводящей сферы. Некроз многих отделов мозга одновременно сопровождается разнообразными клиническими симптомами:
- Мышечный тремор при Паркинсонизме;
- Нарушение походки, координации подвижности;
- Потеря эрекции;
- Вегето-сосудистые расстройства.
До появления магнитно-резонансной томографии ранняя диагностика заболевания проблематична. Только ядерно-магнитный резонанс верифицирует уменьшение толщины мозговой паренхимы.
Клинические симптомы мозговой атрофии
Проявления патологии во многом определяются причинами и провоцирующими факторами. У большинства пожилых людей присутствует деменция, синдром лобной доли, внутренняя полиорганная патология.
Чем проявляется синдром лобной доли:
- Отсутствие аппетита;
- Потеря памяти, интеллектуальной активности;
- Частые эмоциональные срывы;
- Отсутствие коммуникации с окружающими людьми;
- Раздражительность;
- Отсутствие самокритики.
Психоорганический синдром сопровождается цереброастеническими расстройствами, аффективными нарушениями, амнезией.
Адекватная оценка окружающих событий, самокритика у пациента отсутствует. Появляется примитивность мышления, одностороннее представление сути детали. Речевой запас уменьшается, появляется парамнезия.
Сопутствующие аффективные расстройства приводят к депрессивному синдрому, неадекватному психическому состоянию. Плаксивость, обидчивость, раздражительность, необоснованная агрессия – типичные проявления патологии.
Болезнь Альцгеймера
Это прогрессирующее заболевание с нарастающими нарушениями памяти, мышления, интеллекта, речи, праксиса и узнавания, приводящее в итоге к слабоумию. Данные о распространенности заболевания противоречивы. По некоторым сведениям, она составляет 4–5% среди лиц старше 60 лет. Основными клиническими формами заболевания являются собственно болезнь Альцгеймера (с началом преимущественно в пресенильном возрасте) и сенильная деменция альцгеймеровского типа (с началом преимущественно в старческом возрасте). Выделяются также атипичная форма болезни с преобладанием атрофии лобных долей и деменция альцгеймеровского типа в рамках синдрома Дауна. Здесь представлено описание основных форм болезни.
1. Болезнь Альцгеймера. Примерно в 80% случаев начинается в возрасте 45–65 лет, реже — в возрасте около 40 или после 65 лет. Длительность болезни составляет в среднем 8–10 лет, возможно затяжное (более 20 лет) и катастрофическое течение (от 2 до 4 лет). Различают три стадии течения болезни.
| | Читайте о диагностике и лечении болезни Альцгеймера |
Инициальная стадия включает этап «сомнительной» деменции и этап «мягкой» деменции. Первый этап проявляется легкими нарушениями памяти, мышления, речи, праксиса, личности, которые заметны в основном самим пациентам и которые какое-то время им удается скрывать или компенсировать. На этапе мягком деменции нарушения становятся более серьезными. Снижается память на текущие события, страдают хронологический и пространственный виды памяти.
Выявляются нарушения разных операций мышления. Обнаруживаются расстройства речи, праксиса, узнавания, психопатоподобные изменения личности. Степень выраженности нарушений такова, что больные уже не справляются самостоятельно с профессиональными обязанностями и другими видами социальной активности, такими как покупки, оплата счетов, прием гостей, составление текстов и т. п.
С самообслуживанием больные справляются, хотя и нуждаются в контроле и побуждении извне. Нередко в этой стадии наблюдаются аффективные и бредовые расстройства. Это субдепрессии, иногда хронические и сочетающиеся с тревогой, истериформными и ипохондрическими проявлениями; эпизодические или протрагированные бредовые идеи ущерба, воровства, реже — идей отношения, преследования или ревности. У части пациентов выявляется повышенная истощаемость, бывают головные боли, продолжительность начальной стадии составляет от 4–8 до 15–20 лет. При этом у части пациентов преобладают нарушения памяти, у другой, большей — очаговые нарушения (афазия и др.).
В стадии умеренной деменции нарушения познавательной сферы и высших корковых функций достигают степени, когда пациенты уже не справляются с профессиональными и общественными обязанностями. Они нуждаются в помощи даже в быту и самообслуживании. Появляются неврологические нарушения, такие как мышечная скованность, акинезии, гиперкинезы, припадки. Критическое отношение к болезни тем не менее сохраняется. Наряду с дефицитарными иногда наблюдаются продуктивные нарушения: эпизоды галлюцинаторной спутанности, состояние психомоторного возбуждения, часто не связанное с ухудшением соматического состояния. Окончательно формируется характерный для этой стадии афато-апракто-агностический синдром (синдром трех А), ослабление памяти приобретает характер прогрессирующей амнезии. Конфабуляций и экмнезии чаще не бывает.
Стадия тяжелой деменции характеризуется распадом памяти, мышления и интеллекта, а также высших корковых функций. Больным необходима помощь даже в элементарном самообслуживании. В основном только при болезни Альцгеймера наблюдаются столь глубокие — до маразма — нарушения, равно как эмбриональная поза, контрактуры, множественные насильственные двигательные феномены, насильственные смех и плач, эпиприпадки. Одновременно различаются выраженные соматические изменения: похудание, крайнее одряхление, булимия, эндокринные расстройства.
2. Сенильная деменция альцгеймеровского типа. Примерно в 80% случаев начинается в возрасте 65–85 лет. Длительность заболевания колеблется от 4 до 15 лет и более. В начальной стадии болезни развиваются значительные нарушения памяти на текущие события, нередко с оживлением воспоминаний о далеком прошлом. Страдают операции мышления, а также интеллект (креативность, планирование, прогнозирование и др.). Характерны изменения личности: эгоцентризм, сужение интересов, эмоциональное обеднение, конфликтность, оппозиционность и внушаемость. Наблюдаются также нравственное снижение, расторможенность влечений.
Свойственная больным подозрительность позднее перерастает в склонность к бредообразованию. Впрочем, у половины больных встречаются психотические эпизоды с бредом малого размаха. Наблюдаются также субдепрессивные состояния, особенно угрюмо-мрачная подавленность. Во второй стадии болезни нарушения памяти приобретают характер прогрессирующей амнезии. Могут быть скудные конфабуляции, а также состояния амнестической дезориентировки со «сдвигом ситуации в прошлое». На стадии умеренной деменции становятся отчетливыми и нарушения высших корковых функций. На стадии тяжелой деменции наблюдается полный распад мнестико-интеллектуальных функций, выявляются также серьезные неврологические нарушения.
Этиология болезни Альцгеймера не установлена. Можно, по-видимому, считать доказанной роль генетических факторов в развитии семейных форм болезни. Тем не менее эта роль остается неясной в отношении спорадических форм, составляющих около 90% от всех случаев заболевания. Существенное значение имеет старение.
Ведущее место в лечении больных занимает заместительная терапия, направленная на преодоление нейротрансмиттерного дефицита. Для восполнения холинергической недостаточности могут быть рекомендованы такрин, амиридин, экселон, мемантин, арисепт, реминил. Для устранения дефицита других нейромедиаторных систем рекомендуют другие препараты, в частности юмекс и циталопрам. Для повышения выживаемости нейронов назначают ноотропы, в особенности церебролизин, а также вазоактивные препараты, в частности сермион или ницерголин. Может оказаться полезным назначение противовоспалительного лечения, например индометацина. Терапия психотических нарушений проводится с помощью антидепрессантов, нейролептиков, транквилизаторов. Прогноз заболевания неблагоприятен.
Виды и классификация атрофии головного мозга
По степени опасности разделяют два вида атрофических изменений мозга:
- Физиологическая;
- Патологическая.
Первый вид является естественным. На протяжении развития человека сопровождает вначале гибель пупочных артерий, артериального протока (новорожденных). После полового созревания утрачиваются ткани вилочковой железы.
В пожилом возрасте возникают дегенеративные изменения половой сферы. У людей преклонного возраста появляется кортикальная деструкция, инволюция лобной части. Состояния является физиологическими.
Виды патологической атрофии:
- Дисфункциональная – развивается при снижении функциональной активности мозга;
- Компрессионная – провоцируется повышенным давлением на мозговые ткани (гидроцефалия, гематома, обильное скопление крови);
- Ишемическая (дисциркуляторная) возникает по причине сужения просвета артерий атеросклерозом, сгустками крови, повышенной неврогенной активностью. Генерализованная церебральная гипоксия сопровождается не только умственным слабоумием, склеротическими внутримозговыми изменениями;
- Нейротическая (неврогенная) формируется из-за снижения поступления нервных импульсов к внутреннему органу. Состояние формируется из-за постепенных кровоизлияний, присутствия внутримозговых опухолей, атрофии зрительного или тройничного нерва. Возникает при хронической интоксикации, воздействии физических факторов, лучевой терапии, длительном лечении нестероидными противовоспалительными препаратами;
- Дисгормональная – возникает на фоне эндокринного дисбаланса со стороны яичников, семенников, щитовидной железы, молочных желез.
Морфологические виды атрофии мозга:
- Гладкая – поверхность мозга сглаживается;
- Бугристая – неравномерное распределение участков некроза формирует особую структуру;
- Смешанная.
Классификация по распространенности повреждения:
- Очаговая – прослеживаются лишь отдельные участки атрофического повреждения мозговой коры;
- Диффузная – распространяется по всей поверхности паренхимы;
- Частичная – некроз ограниченной части мозга;
- Полная – атрофические изменения белого и серого вещества, дегенерация тройничного и зрительного нерва.
Характер морфологических изменений мозга выявляет магнитно-резонансное сканирование. Проводить сканирование следует после появления первых клинических симптомов.
Известно, что возрастные изменения проявляются во всех органах и системах организма человека. При этом особое значение имеют процессы, происходящие в период старения нервной системы, чему посвящен настоящий обзор, в котором обобщены основные факты в этой области.
Старение центральной нервной системы (ЦНС) сопровождается выраженными в различной степени атрофическими процессами. Масса головного мозга медленно, но неуклонно уменьшается. Кора больших полушарий, а в последующем, и мозжечка, становится тоньше. По данным В.В. Фролькис, масса мозга человека в возрасте от 60 до 75 лет снижается на 6%, причем неравномерно в разных отделах. Кора больших полушарий уменьшается на 4%, наибольшие изменения (на 12—15%) происходят в лобной доле. Отмечены гендерные различия степени атрофии мозга при старении. Масса головного мозга женщин примерно на 110—115 г меньше, чем у мужчин. Между 40 и 90 годами масса мозга уменьшается у мужчин на 2,85 г в год, а у женщин — на 2,92 г [1]. Твердая мозговая оболочка становится толще, склерозируется, срастается с костями черепа. Мягкая мозговая оболочка также заметно утолщается, извилины истончаются, борозды расширяются и углубляются. Паутинная оболочка прогрессирующе гиперплазируется и склерозируется с возрастом. По данным H. Brody [2] и H. Chugani и соавт. [3], и масса мозга снижается на 6—7% к 80 годам, мозжечок теряет с возрастом до 25% клеток Пуркинье, ядра таламуса — до 18%; наиболее часто изменения проявляются в префронтальной и медиально-височной областях. По данным E. Kensinger и соавт. [4], в префронтальной области наблюдается атрофия и белого и серого вещества. Уменьшение объема серого вещества обусловлено снижением количества нейронов ввиду их дегенерации. В белом веществе отмечаются аксональные патологические изменения и замедленная нейротрансмиссия. При этом R. Cabeza и соавт. [5] установили, что уменьшение межполушарной асимметрии, наблюдаемое у пожилых людей, наиболее выражено в префронтальной коре. До сих пор остается неясным, является ли билатеральное выравнивание отражением компенсаторной активизации одного из полушарий или же это результат патологических изменений.
Еще одной областью головного мозга, где возрастные изменения наиболее выражены, является гиппокамп [6]. Учитывая роль гиппокампа в формировании памяти, становится понятно, что функциональные и структурные изменения в этой зоне при старении обусловливают трудности запоминания контекста, в котором была получена информация [7, 8].
Таким образом, большинство исследователей мозга человека указывают на преимущественную потерю нейронов в коре, гиппокампе и мозжечке. В большинстве подкорковых образований клеточный состав остается неизменным до старческого возраста [1]. При этом филогенетически более «новые» структуры мозга, связанные с познавательной функцией, в большей степени подвержены возрастной потере нейронов, чем филогенетически «старые» (ствол мозга).
В процессе старения сами нейроны и их отростки уменьшаются в размерах, в них накапливаются липофусцин и жировые вакуоли. Миелиновые волокна истончаются. При электронно-микроскопическом исследовании обнаруживается старческий хроматолиз нейронов, их склеротические изменения и превращение в «клетки-тени». Выявляются не только признаки повреждения и дистрофии нейронов (гомогенизация цитоплазмы, смещение и пикноз ядер, цитолиз, тигролиз) различной выраженности, но и признаки гипертрофии внутриклеточных структур, что указывает на адаптивные процессы в условиях возрастной дегенерации нейронов [9, 10]. В связи с гибелью нейронов возникает один из типичных морфологических признаков стареющего мозга — разрежение клеток. Пустоты в участках полного исчезновения нейронов содержат гранулярный базофильный материал и вакуоли, а также происходит их замещение глиальными элементами [11, 12].
При старении головного мозга в коре больших полушарий, главным образом в лобных долях, а также в гиппокампе и подкорковых узлах увеличивается число глиальных элементов и выявляются старческие (сенильные) бляшки. Они располагаются рядом с сосудами микроциркуляторного русла коры и представляют собой скопления аргирофильного бесструктурного материала, содержащие амилоид и окруженные переплетениями утолщенных аксонов и клетками макро- и микроглии, имеющими мало цитоплазмы [13, 14].
При старении уменьшается плотность синапсов. Однако утрата синапсов происходит не во всех отделах ЦНС в равной степени. Так, в лобной доле достоверно доказано уменьшение количества синапсов с возрастом, в то время как в височной возрастные изменения не наблюдаются. Изменения в состоянии синапсов отмечаются не только в коре, но и в подкорковых структурах. Например, возрастные нарушения пространственной памяти объясняются снижением специфичности, эффективности и пластичности синаптической передачи в гиппокампе. При старении уменьшается способность формирования новых синапсов. Редукция синаптической пластичности в старости может способствовать снижению памяти, ухудшению двигательной активности и развитию других нарушений. При этом ухудшаются межнейронные контакты в различных областях ЦНС, нейроны как бы подвергаются деафферентации, в связи с чем нарушается их ответная реакция на сигналы внешней среды, нервные и гормональные стимулы, т. е. повреждаются синаптические механизмы деятельности мозга [1].
По мере увеличения возраста существенно изменяется состояние медиаторных систем мозга. Одним из наиболее характерных феноменов старения является дегенерация дофаминергической системы мозга, что непосредственно связано с развитием в старческом возрасте таких заболеваний, как паркинсонизм. Нарушения деятельности холинергической медиаторной системы мозга играют одну из основных ролей в расстройствах памяти, восприятия и других познавательных процессов, возникающих при болезни Альцгеймера [15].
Старение сопровождается также изменением активности и содержания в ткани мозга человека энзимов, имеющих отношение к синтезу и разрушению тирозингидроксилазы, ДОФА-декарбоксилазы в черной субстанции, хвостатом ядре и скорлупе; холинацетилазы и ацетилхолинестеразы — в коре, стриатуме, гиппокампе и мозжечке, и следовательно, синтез ацетилхолина в этих структурах уменьшен. Напротив, в среднем мозге увеличивается содержание моноаминоксидазы. Нарушение обмена нейромедиаторов в дофаминергических нейронах головного мозга влечет за собой его снижение в базальных ганглиях, хвостатом ядре и скорлупе, что и вызывает нарушение двигательной активности. Уменьшение содержания серотонина и норадреналина, снижение содержания и скорости обмена дофамина в гипоталамусе связывают с развитием депрессии у лиц пожилого возраста [16].
Возрастное ухудшение кровоснабжения головного мозга по экстра- и интракраниальным сосудам сопровождается изменениями мелких сосудов: склерозом и гиалинозом стенок, сужением просвета. При старении снижается мозговой кровоток, нарушаются функции гематоэнцефалического барьера, уменьшается сопряжение между мозговым кровотоком и метаболизмом глюкозы в связи с использованием в качестве энергетического субстрата кетоновых тел, снижаются уровни тканевого дыхания и окислительного фосфорилирования, а также внутриклеточный рН в мозге, что характеризует изменения церебрального энергетического обмена на всех уровнях. Такие изменения при нормальном старении выражены относительно слабо, тем не менее они повышают чувствительность мозга к окислительному стрессу и другим повреждающим факторам [17—19].
Возрастные изменения сосудистых сплетений проявляются склерозом, образованием кист, кальцификацией, появлением псаммозных телец. Процессы обызвествления в них прогрессируют с возрастом: при компьютерной томографии они выявляются у 1 из 3 — 50-летних, у 3 из 4 — 60-летних и у 5 из 6 — 80-летних пациентов [11].
В процессе старения имеет место постепенное снижение высших психических функций — восприятия, внимания, памяти, мышления. Снижаются скорость обработки информации, объем оперативной памяти, способность к обучению и запоминанию новой информации [20, 21].
Для пожилых людей характерны эмоциональная неустойчивость, снижение умственной работоспособности, повышение порога безусловных рефлекторных реакций, трудности выработки условных рефлексов, а также более медленное их угасание по сравнению с молодым возрастом [22, 23].
По мере того, как человек становится старше, процесс восприятия новой информации и ее кодирования для последующего хранения требует все большего времени, что связано со сниженной эффективностью нервной передачи и сенсорным дефицитом, который ограничивает способность человека быстро и точно воспринимать информацию, предъявляемую для запоминания [24, 25]. У пожилых людей, кроме того, снижается способность извлекать хранящиеся в памяти сведения. Отчасти это обусловлено тем, что им сложнее дифференцировать необходимый фрагмент информации от обильных запасов сведений и знаний, накопленных в течение долгих лет жизни. Этот процесс отграничения (дифференцировки) может быть особенно трудным в случае, когда новая информация сходна по содержанию с давно усвоенной. Вследствие этого пожилые люди демонстрируют гораздо худшие показатели по сравнению с молодыми, в тестах на свободное вспоминание, когда их просят вспомнить заученную информацию, давая при этом минимум подсказок. Однако эта разница сводится к минимуму, когда пожилым испытуемым дается достаточное количество подсказок и ориентиров, чтобы сузить фокус поиска в памяти нужной информации, или когда их просят выбрать правильный ответ из небольшого числа вариантов [26—28].
Считается, что люди пожилого возраста обладают лучшей памятью на события, происшедшие в давнем прошлом, чем на недавние события. Это в основном связано с тем, что давние события либо имеют для человека особое личное значение, либо настолько особенны по содержанию, что не могли в течение жизни быть «стерты» из памяти более поздними событиями [29, 30]. Пожилые люди в течение жизни многократно обращаются к этим воспоминаниям, что повышает их доступность для извлечения из памяти, по сравнению с ежедневными событиями, значительная часть которых со временем забывается. Следует иметь в виду, что гораздо труднее выявить ошибки испытуемых в воспроизведении давних событий по сравнению с событиями текущими, когда ошибки припоминания оказываются очевидными. Так, кратковременная память значительно ослабевает с возрастом и часто оказывается нарушенной у пожилых людей. Возрастные различия долговременной памяти гораздо менее выражены и, как считается, могут быть следствием использования неэффективных стратегий кодирования или дефицита функции воспроизведения [31, 32]. Семантическая память в позднем возрасте не нарушается. Прогрессирующее снижение памяти у некоторых людей отмечается уже между 50—60 годами, что, вероятно, является результатом дегенеративных изменений в нейронах, отложения липофусцина, образования сенильных бляшек в ткани мозга [27].
Речь при старении сохраняется относительно хорошо [3]. Пожилые люди 60—70 лет используют в своей речи более разнообразные грамматические формы по сравнению с более старшей возрастной группой. Беглость речи у пожилых не отличается от лиц более молодого возраста. Однако имеются изменения в процессах понимания чужой речи в связи с сенсорным дефицитом и замедлением скорости обработки информации. В отношении письменной речи также наблюдаются определенные изменения с возрастом. Понимание и восприятие замедляются, пожилым людям становится труднее уловить смысл прочитанного.
Другой особенностью нейродинамических нарушений является уменьшение способности концентрировать внимание в течение длительного времени, поэтому пожилые люди часто отвлекаются на посторонние стимулы при выполнении тех или иных заданий, особенно это выражено, когда необходимо запомнить информацию на фоне «шума» [33]. Им также трудно работать с несколькими источниками информации. Последнее может быть связано с уменьшением способности переключать внимание, т. е. с определенной интеллектуальной ригидностью.
В связи с морфологическими изменениями головного мозга биоэлектрическая активность его также медленно и прогрессирующе изменяется. Начиная с возраста 50 лет наблюдается перестройка спектра ритмов ЭЭГ, выражающаяся в снижении амплитуды и относительного количества альфа-ритма и тета-волн и в нарастании мощности бета-ритма [34, 35]. Что касается медленноволновой активности, то здесь полученные результаты противоречивы. По данным одних исследований [36, 37], имеет место возрастание мощности медленных ритмов и реже выявлялось [38—40] отсутствие изменений и снижение мощности медленных ритмов. Ряд авторов отмечают, что доминирующая частота после 60—70 лет имеет тенденцию к снижению, а по данным визуального анализа ЭЭГ преобладают тета- и дельта-волны. Считается, что замедление ЭЭГ связано ишемией, которая приводит к прогрессирующему увеличению количества пограничных с нормой и патологически измененных ЭЭГ [41]. Есть данные, что существенные отклонения фоновой ЭЭГ у лиц после 70 лет могут обусловливаться нарушениями функции нормальной регуляции сна и бодрствования. К 90—100 годам продолжает снижаться частота доминантного ритма, увеличивается представленность медленной активности, появляется ее асимметрия в височных отведениях. Количественный анализ показывает снижение мощности доминантного ритма и уменьшение его различий по разным зонам по сравнению с 60-летними здоровыми. Тета-ритм связан с памятью и эмоциональной регуляцией [42, 43]. Поскольку нарушения памяти являются одним из наиболее значимых проявлений старения головного мозга, во многом этим объясняется снижение мощности тета-ритма [44, 45]. Также отмечено снижение мощности альфа-ритма. Альфа-1-ритм связан с вниманием и трудностью выполняемого задания, тогда как альфа-2 является нейрофизиологическим коррелятом сложной семантической памяти [46]. Одновременно снижается реактивность альфа-ритма на активирующие нагрузки, а мощность бета-активности при функциональных нагрузках возрастает [47]. Н.В. Вольф и А.А. Глухих [34] обнаружили в своих исследованиях увеличение мощности высокочастотных бета-2 и гамма-ритмов во всех отведениях по сравнению с группой молодого возраста, причем эти различия были наиболее выражены во фронтальных отделах полушарий. У пожилых наблюдается также снижение возможности усвоения навязанных ритмов, диапазон усвоения ритма сужен и сдвигается в сторону низких частот.
Наблюдается также устойчивое увеличение латентности волны Р300 вызванных потенциалов с возрастом (латентность Р300 удлиняется на 1,25 мс в год, а амплитуда уменьшается со скоростью 0,09 мкВ в год) и уменьшение амплитуды зрительных вызванных потенциалов. При исследовании слуховых вызванных потенциалов было отмечено увеличение латентности N1 и P2, а их амплитуды меняются в зависимости от вида стимула: амплитуда N1 увеличивается в ответ на речевой стимул по сравнению с неречевым [48]. Амплитуда P2, по данным J. Lister и соавт. [49], меньше у людей пожилого возраста в сравнении с более молодыми из-за снижения активности процессов торможения. Однако K. Rufener и соавт. [48] в своем исследовании не выявили какой-либо значимой модуляции P2 у пожилых по сравнению с молодыми. С возрастом происходит падение скорости распространения возбуждения по нервам, замедляется синаптическое проведение [50, 51].
По данным В.Ф. Фокина и соавт. [52, 53], качественный анализ характера изменений при старении может быть представлен в отношении двух параметров: усредненного уровня постоянных потенциалов (УПП) и межполушарной разности в височных отведениях. При этом, возможно, картина церебрального энергообмена будет меняться в зависимости от биологического возраста, социального и психологического статуса, региона проживания и других факторов.
Имеются данные, что в лобных областях, где преобладают возрастные изменения — снижение кровотока и гипометаболизм глюкозы, регистрируется вторичное небольшое нарастание УПП, отражающее снижение церебрального рН. В пожилом возрасте отмечается определенное расхождение между динамикой метаболизма глюкозы и изменением КЩР: потребление глюкозы при старении снижается, но pH в мозговой ткани растет, что может быть обусловлено комплексом причин: снижением кровотока и энергетического обмена, деструктивными процессами [18].
Проводились исследования распределения УПП у пожилых северян, которые показали, что к характерным изменениям при старении у них относятся: низкие значения УПП в лобных отведениях, повышение значений в центральных и теменных отведениях, а также повышение индивидуальной вариабельности показателей межполушарных различий. Отмечено сглаживание межполушарной асимметрии у мужчин-северян в лобных, а у женщин-северянок — в центральных отведениях и правополушарное доминирование в центральных отведениях у мужчин [54].
Таким образом, в процессе старения наиболее значимые изменения наблюдаются в медиально-височной и префронтальной областях головного мозга, что в свою очередь приводит к снижению когнитивных функций: уменьшению скорости обработки информации, объема оперативной памяти, способности к обучению и запоминанию новой информации. Морфологические изменения головного мозга обусловливают перемены его функциональной активности, которая отражается на ЭЭГ, при анализе вызванных потенциалов, а также УПП.
Работа выполнена в рамках проектной части государственного задания в сфере научной деятельности
Министерства образования и науки РФ на 2014—2016 гг.,
№ 2025 Северному (Арктическому) федеральному университету им. М.В. Ломоносова.
Конфликт интересов отсутствует.
Формы мультисистемной атрофии
Опасность множественных поражений мозговых структур определяется комплексом патологических повреждений со стороны полушарий, подкорковых образований, мозжечка, спинномозгового ствола, белого вещества. Сопутствующие изменения зрительного нерва приводит к слепоте, тройничного нерва – нарушению иннервации лица.
Формы мультисистемной атрофии:
- Оливопонтоцеребеллярная – повреждения мозжечка с нарушением подвижности;
- Стриатонигральная дегенерация – мышечный тремор с проявления Паркинсонизма;
- Синдром Шая-Дрейджера – вегето-сосудистая дистония, снижение артериального давления;
- Амиотрофия Кугельберга-Веландера – атрофия мозга с гипотрофией мышц, гиперплазией соединительнотканных волокон.
Симптоматика определяется преимущественной формой поражения.
Демиелинизирующее заболевание ЦНС
Демиелинизирующие заболевания головного и спинного мозга – это патологические процессы, приводящие к разрушению миелиновой оболочки нейронов, нарушению передачи импульсов между нервными клетками мозга. Считается, что в основе этиологии заболеваний лежит взаимодействие наследственной предрасположенности организма и определенных факторов внешней среды. Нарушение передачи импульсов приводит к патологическому состоянию центральной нервной системы.
Какие это заболевания
Существуют следующие виды демиелинизирующих заболеваний:
- к демиелинизирующим заболеваниям центральной нервной системы относится рассеянный склероз. Демиелинизирующее заболевание рассеянный склероз – это наиболее часто встречающаяся патология. Рассеянный склероз характеризуется разнообразной симптоматикой. Первые симптомы появляются в возрасте 20-30 лет, чаще болеют женщины. Рассеянный склероз диагностируется по первым признакам, которые впервые описал врач-психиатр Шарко – непроизвольные колебательные движения глаз, дрожание, скандированная речь. Также у пациентов отмечается задержка мочеиспускания или очень частое мочеиспускание, отсутствие брюшных рефлексов, бледность височных половин дисков зрительных нервов;
- ОДЭМ, или острый рассеянный энцефаломиелит. Начинается остро, сопровождается выраженными общемозговыми расстройствами и проявлениями инфекции. Заболевание часто возникает после воздействия бактериальной или вирусной инфекции, может развиться спонтанно;
- диффузно-диссеминированный склероз. Характеризуется поражением спинного и головного мозга, проявляется в виде судорожного синдрома, апраксии, нарушений психики. Смерть наступает в период от 3 до 6-7 лет с момента диагностирования заболевания;
- болезнь Девика, или острый оптиконевромиелит. Заболевание начинается как острый процесс, протекает тяжело, прогрессирует, поражая зрительные нервы, что вызывает полную или частичную потерю зрения. В большинстве случаев наступает летальный исход;
- болезнь Бало, или концентрический склероз, энцефалит периаксиальный концентрический. Начало заболевания острое, сопровождается лихорадкой. Патологический процесс протекает с параличами, зрительными нарушениями, эпилептическими припадками. Течение заболевания быстрое – смерть наступает через несколько месяцев;
- лейкодистрофии – в этой группе находятся заболевания, которые характеризуются поражением белого вещества мозга. Лейкодистрофии относятся к наследственным заболеваниям, в результате дефекта генов нарушается формирование миелиновой оболочки нервов;
- прогрессирующая мультифокальная лейкоэнцефалопатия характеризуется снижением интеллекта, эпилептическими припадками, развитием деменции и другими расстройствами. Продолжительность жизни больного не более 1 года. Заболевание развивается в результате снижения иммунитета, активации вируса JC (полиомавируса человека 2), часто обнаруживается у больных ВИЧ-инфекцией, после трансплантации костного мозга, у болеющих злокачественными заболеваниями крови (хронический лимфолейкоз, болезнь Ходжкина);
- диффузный периаксиальный лейкоэнцефалит. Наследственное заболевание, чаще поражает мальчиков. Вызывает расстройство зрения, слуха, речи, другие нарушения. Быстро прогрессирует – продолжительность жизни чуть больше года;
- синдром осмотической демиелинизации – встречается очень редко, развивается в результате нарушения электролитического баланса и ряда других причин. Быстрый рост уровня натрия приводит к потере клетками мозга воды и различных веществ, становится причиной разрушения миелиновых оболочек нервных клеток мозга. Поражается один из задних отделов мозга – Варолиев мост, наиболее чувствительный к миелинолизу;
- миелопатии – общий термин для поражений спинного мозга, причины которых разнообразные. К этой группе относятся: спинная сухотка, болезнь Канавана, другие заболевания. Болезнь Канавана – генетическое, нейродегенеративное аутосомно-рецессивное заболевание, поражает детей, вызывает повреждение нервных клеток головного мозга. Заболевание чаще всего диагностируется у евреев ашкенази, проживающих в Восточной Европе. Спинная сухотка (локомоторная атаксия) – это поздняя форма нейросифилиса. Заболевание характеризуется поражением задних столбов спинного мозга и спинальных нервных корешков. Заболевание имеет три стадии развития с постепенным нарастанием симптомов поражения нервных клеток. Нарушается координация при ходьбе, больной легко теряет равновесие, часто нарушается работа мочевого пузыря, появляется боль в области нижней конечности или в нижней части живота, падает острота зрения. Самая тяжелая третья стадия характеризуется утратой чувствительности мышц и суставов, арефлексией сухожилий ног, развитием астереогноза, больной не может передвигаться;
- синдром Гийена-Барре – встречается в любом возрасте, относится к редкому патологическому состоянию, которое характеризуется поражением периферических нервов организма собственной иммунной системой. В тяжелых случаях происходит полный паралич. В большинстве случаев больные полностью выздоравливают при адекватном лечении;
- невральная амиотрофия Шарко-Мари-Тута. Хроническое наследственное заболевание, которое характеризуется прогрессированием, поражает периферическую нервную систему. В большинстве случаев происходит разрушение миелиновой оболочки нервных волокон, существуют формы заболевания, при которых обнаруживается патология осевых цилиндров в центре нервного волокна. В результате поражения периферических нервов происходит угасание сухожильных рефлексов, атрофия мышц нижних, а затем верхних конечностей. Заболевание относится к прогрессирующим хроническим наследственным полиневропатиям. В эту группу входят: болезнь Рефсума, синдром Русси-Леви, гипертрофическая невропатия Дежерина-Сотта и другие редкие заболевания.
Генетические заболевания
Когда происходит повреждение нервной ткани, организм отвечает реакцией – разрушением миелина. Заболевания, которые сопровождаются разрушением миелина, подразделяются на две группы – миелинокластии и миелинопатии. Миелинокластии – это разрушение оболочки под воздействием внешних факторов.
Миелинопатия – это генетически обусловленное разрушение миелина, связанное с биохимическим дефектом строения оболочки нейронов. В то же время, такое распределение на группы считается условным – первые проявления миелинокластии могут говорить о предрасположенности человека к заболеванию, а первые проявления миелинопатии могут быть связаны с повреждениями под воздействием внешних факторов.
Рассеянный склероз считают заболеванием людей с генетической предрасположенностью к разрушению оболочки нейронов, с нарушением метаболизма, недостаточностью иммунной системы и наличием медленной инфекции. К генетическим демиелинизирующим заболеваниям относятся: невральная амиотрофия Шарко-Мари-Тута, гипертрофическая невропатия Дежерина-Сотта, диффузный периаксиальный лейкоэнцефалит, болезнь Канавана и многие другие заболевания. Генетические демиелинизирующие заболевания встречаются реже, чем демиелинизирующие заболевания с аутоиммунным характером.
Основные стадии атрофических мозговых изменений
Заболевание имеет пять степеней течения. По клиническим симптомам удается верифицировать нозологии, начиная с второй-третьей стадии.
Степени кортикальной атрофии:
- Клинически симптомы отсутствуют, но патология быстро прогрессирует;
- 2 степень – характеризуется снижением коммуникабельности, отсутствием адекватной реакции на критические замечания, увеличивается число конфликтов с окружающими людьми;
- Отсутствие контроля поведения, беспричинный гнев;
- Потеря адекватного восприятия ситуации;
- Исключение психоэмоцинальной составляющей поведенческих реакций.
Выявления любого симптома требует дополнительного изучения структуры мозга.
Принципы диагностики атрофии
Первоначальный этап предполагает сбор анамнеза, осмотр, физикальное обследование. Второй этап – клинико-инструментальные методы (УЗИ, КТ, МРТ головного мозга, сцинтиграфия, ПЭТ/КТ). Повреждение зрительного нерва подтверждается офтальмоскопией, тонометрией, контрастной КТ или МРТ-ангиографией.
Лучшим способом выявления патологии мягких тканей головного мозга является МРТ. Процедуру нужно выполнять несколько раз (с разницей через месяц), чтобы выявить атрофию разной глубины, распространенности.
Магнитно-резонасное обследование выявляет самые мелкие локальные очаги, помогает правильно установить степень прогрессирования болезни.
Диагностика и дифдиагностика
Церебральная артрофи это болезнь, для диагностирования которой может понадобиться анамнез подробных сведений о пациенте.
Изучается история болезни, проводится опрос больного о его условиях жизни и самочувствии.
Но для точного установления диагноза, профессионалы отправляют больного на прохождение таких диагностических исследований:
- КТ головы;
- диффузную оптическую томографию;
- МЭГ (измерение и визуализация магнитных полей);
- двухфотонной или однофотонной эмиссионной томографии;
- МРТ головы.
А также в редких случаях возможна дифференциальная диагностика. Имея анамнез пациента, при помощи специально созданной компьютерной программы можно установить диагноз методом исключения. По фактам и симптомам, которые проявляются у больного, компьютер сводит круг всевозможных болезней к одной.
При невозможности провести полную, можно сделать частичную дифференциальную диагностику.