Врожденные пороки развития плода не так часто, как мы уже говорили, встречаются – приблизительно каждая 30 беременность имеет клинически значимые изменения у плода, хотя небольшие отклонения или особенности в развитии того или иного органа у плода встречаются намного чаще.
Именно факт относительной редкости патологии плода и вызывает беспечность у будущих мам, и мотивация у них самая простая – мы с мужем здоровы, а, значит, и дети наши тоже здоровы! Увы, не все так безоблачно и просто!
Достаточно распространенной (5 на 1000 родов), но редко диагностируемой во время беременности патологией, и почти никогда не диагностируемой ранее 20 недели беременности является агенезия мозолистого тела мозга (АМТ). Среди всех пороков развития плода на долю этой патологии приходится 2-3%.
— Что это такое – мозолистое тело, и почему это оно появилось в мозге, откуда там мозоли могли взяться? – возмущенно поинтересуетесь вы.
— Это маленькая, но важная деталь мозга, обеспечивающая обмен информацией между правым и левым полушариями мозга. Без него правое и левое полушарие живут сами по себе, и две половины мозга имеют независимые возможности для участия в процессах сознания, накопления памяти, коммуникации и регуляции двигательной активности.
Создается ставшей притчей прецедент, когда «правая рука не ведает, что творит левая» – а, значит, при агенезии мозолистого тела в неврологическом развитии человека ожидается значительный интеллектуальный дефицит. Кроме того, судороги, большие размеры головы, гигантские кисты мозга и церебральный паралич (до 30%) также являются последствиями АМТ.
Какие Вам следует сделать выводы:
- диагностика пороков развития плода — дело ответственное, не терпящей спешки и поверхностного подхода к исследованию.
- в каждом триместре беременности могут быть обнаруженные новые, свойственные только этому периоду развития плода, патологии. Не пропускайте сроки скрининговых исследований
- опыт врача-исследователя + качественное оборудование – залог не только своевременной диагностики пороков развития плода, включая и агенезию мозолистого тела, а также залог рационального выбора дальнейшей акушерской тактики.
Исследование плода и плаценты при врожденных пороках развития, несовместимых с жизнью
Врожденные пороки развития (ВПР) плода считают важнейшей медицинской и социальной проблемой, поскольку они занимают ведущее место в структуре причин перинатальной, неонатальной и младенческой заболеваемости, смертности и инвалидности [1]. Также актуальной является проблема прерывания беременности в поздние сроки по медицинским показаниям со стороны плода, так как на ее долю приходится около 20% от общего числа абортов, а количество осложнений возрастает в 3–4 раза при прерывании беременности во втором триместре по сравнению с первым [2]. Согласно данным ВОЗ, ВПР отмечают у 4–6% детей. В России ежегодно более 50 000 детей рождаются с ВПР, число пациентов с ВПР превышает 1,5 млн человек. При наличии у плода ВПР, несовместимых с жизнью, или сочетанных пороков с неблагоприятным прогнозом для жизни и здоровья, при ВПР, приводящих к стойкой потере функций вследствие тяжести и объема поражения при отсутствии методов эффективного лечения, женщине предоставляется информация о возможности искусственного прерывания беременности по медицинским показаниям [3]. При отказе женщины прервать беременность из-за наличия ВПР, несовместимых с жизнью, или иных сочетанных пороков беременность ведется в соответствии с разделом I настоящего порядка. Высокие затраты на лечение, уход и реабилитацию детей с ВПР обусловливают необходимость разработки и совершенствования не только методов контроля, диагностики и профилактики ВПР у детей, но и изучения патоморфологии плода и последа [4].
В последние десятилетия интенсивно изучаются многочисленные антенатальные факторы, приводящие к повреждению нервной системы плода — внутриутробные инфекции, генетические дефекты, проблемы резус-конфликта, воздействие на плод лекарственных веществ и целый ряд других факторов. Нередко причинами врожденных пороков развития плода и последа являются инфекционные причины: инфекционные фетопатии формируются с 16-й недели, когда происходит генерализация инфекции у плода, вследствие чего могут возникать такие пороки развития, как фиброэластоз эндокарда, поликистоз легких, микро- и гидроцефалия (ранние фетопатии) [5].
Большое количество работ посвящено методам прерывания беременности в позднем сроке по медицинским показаниям со стороны плода — врожденным порокам развития плода, реабилитации женщин после элиминации плода [6–11]. В то же время недостаточно описаны результаты патологоанатомического исследования плода и плаценты при врожденных пороках, несовместимых с жизнью. Наше исследование посвящено прерыванию беременности во втором триместре по медицинским показаниям со стороны плода. Данная публикация посвящена вопросам патологоанатомического исследования плода и последа.
Целью данного исследования было выявить структуру врожденных пороков развития плода, несовместимых с жизнью, приведших к прерыванию беременности по медицинским показаниям, их сочетания со структурными изменениями в последе.
Материалы и методы исследования
Исследование одобрено локальным этическим комитетом ФГБОУ ВО ОмГМУ МЗ РФ, Омск (№ 63 от 09.10.2014 г.) и выполнено на базе БУЗОО ГКПЦ, Омск. Прерывание беременности во II триместре по медицинским показаниям проводилось согласно Распоряжению Министерства здравоохранения Омской области № 308-р от 17.09.2013 г. в указанном учреждении, где был создан центр по прерыванию беременности второго триместра и женщине выдавалось заключение перинатального консилиума специалистами (акушер-гинеколог, перинатолог, неонатолог и др.). Гистологическое исследование элиминированных плодов и плацент проведено согласно рекомендациям А. П. Милованова и осуществлялось в патологоанатомическом отделении БУЗОО ОДКБ, Омск.
Основным показанием к прерыванию беременности на всех этапах являлись ВПР плода, несовместимые с жизнью. При наличии у плода ВПР, несовместимого с жизнью, или наличии сочетанных пороков с неблагоприятным прогнозом для жизни и здоровья, при ВПР, приводящих к стойкой потере функций вследствие тяжести и объема поражения при отсутствии методов эффективного лечения, предоставлялась информация о возможности искусственного прерывания беременности по медицинским показаниям. Искусственное прерывание беременности проводилось при наличии информированного добровольного согласия женщины.
На первом ретроспективном этапе (до внедрения в практику регламентирующих документов [3, 12]) проведен анализ гистологического исследования плацент после прерывания беременности у 150 женщин, которые в зависимости от метода прерывания были разделены на две группы: группу А составили 75 женщин, которым проведено прерывание беременности в поздние сроки методом трансвагинального трансцервикального амниоцентеза: амниоинфузия 10% раствором хлорида натрия. Группу Б составили 75 женщин, которым с целью прерывания беременности в поздние сроки для возбуждения и стимуляции родовой деятельности использовали гель динопростон для эндоцервикального введения. Более подробно методы прерывания беременности, их эффективность и исходы описаны в наших предыдущих публикациях [13–15]. Критериями включения пациенток в группы А и Б были следующие: срок беременности 18–21 неделя 6 дней, возможность родоразрешения через естественные родовые пути и отсутствие противопоказаний к применению гипертонического раствора хлорида натрия (10% NaCl) и простагландинов. Пациентки обеих групп были идентичны по возрасту, особенностям менструальной функции, наличию экстрагенитальных и гинекологических заболеваний, паритету. Все пациентки были консультированы в медико-генетическом отделе.
На втором этапе под проспективным наблюдением было 195 беременных, разделенных на две группы. Основную группу составили 98 женщин, которым проведено прерывание беременности в поздние сроки следующим комбинированным методом: мифепристон перорально и введение ламинарий в цервикальный канал. В группу сравнения были включены 97 женщин, прерывание беременности которым проводилось по схеме ВОЗ. Критерии включения в группы: пациентки, которым дано заключение консилиума врачей для прерывания беременности по медицинским показаниям со стороны плода в сроки гестации 18–21 неделя согласно приказам МЗСР РФ № 736 от 03 декабря 2007 г. [16] и № 572н от 01.11.2012 [3].
На проспективном этапе исследования материалом для изучения послужили результаты патоморфологического исследования плодов (аутопсийного материала) и последов (макроскопическое и микроскопическое). В работе использованы антропометрические, органометрические, гистологические методы. С целью уточнения гестационного возраста плода и дополнительных скрытых аномалий развития в соответствии с имеющимися стандартами использовали антропометрические и органометрические исследования [17–20]. Гистологические исследования органов плода, плодных оболочек, пуповины и плаценты проводили на парафиновых срезах, изготовленных по общепринятой методике и окрашенных гематоксилином и эозином, а также избирательно пикрофуксином по методу Ван Гизона. Для гистологического исследования предварительно материал фиксировали в 10% нейтральном формалине, после промывки и стандартной проводки заливали в парафин. Парафиновые срезы толщиной 3–5 мкм окрашивали гематоксилином и эозином. Элементы соединительной ткани определяли пикрофуксином по методу Ван-Гизона. Методы гистологического исследования выполнялись по прописям, изложенным в классических руководствах по гистологической технике и гистохимии. Обследование элиминированных плодов включало тщательную визуальную оценку имеющихся стигм эмбриогенеза, врожденных пороков. Для гистологического исследования отбирали фрагменты органов с целью изучения их гистоархитектоники [17].
Использовался способ статистической обработки результатов по критерию t таблиц Стьюдента, позволяющий вычислить степень достоверности различий при небольшом числе наблюдений. Перед каждым вычислением достоверности различий между количественными признаками, а также для выбора критерия корреляции оценивали нормальность их распределения по критерию Колмогорова–Смирнова. В случае ненормального распределения количественных признаков или неравенстве дисперсий применялся U-критерий Манна–Уитни. Для факторов, имеющих биноминальное распределение, дополнительно были рассчитаны 95% доверительные интервалы.
Результаты исследования
Пациентки всех групп были идентичны по возрасту, особенностям менструальной функции, наличию экстрагенитальных и гинекологических заболеваний, паритету. Эффективность прерывания беременности в поздние сроки методом амниоцентеза составила 93,3%, при применении простагландинов — 92%, на проспективном этапе не имела достоверных различий и составила 99,0% в основной группе и 96,9% — в группе сравнения.
В структуре выявленных ВПР плода на первом месте в основной группе были врожденные пороки сердечно-сосудистой системы (34 наблюдения — 34,7%), на втором — пороки центральной нервной системы (ЦНС) (29 наблюдений — 29,6%), на третьем — множественные пороки развития (13–13,3%), на четвертом — пороки мочевыводящей системы (9–9,2%) (табл. 1). В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата (7–7,1%) и другие (6–6,1%): кожи и мышц, желудочно-кишечного тракта, легких, шеи и лица, прочие. В группе сравнения на первом месте также были врожденные пороки сердечно-сосудистой системы (32 наблюдения — 33,0%), на втором — пороки ЦНС (30 наблюдений — 30,9%), на третьем — множественные пороки развития (15–15,5%), на четвертом — пороки мочевыводящей системы (10–10,3%). В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата (8–8,2%) и другие (2–2,1%): кожи и мышц, желудочно-кишечного тракта, легких, шеи и лица, прочие.
Среди пороков сердечно-сосудистой системы в обеих группах чаще наблюдались транспозиция магистральных сосудов, дефекты межжелудочковой и межпредсердной перегородок, общий артериовенозный канал, тетрада Фалло, сочетанные пороки сердца, аномалии Эбштейна, гипоплазия левого отдела, прочие врожденные пороки сердечно-сосудистой системы.
В структуре пороков ЦНС чаще наблюдалась гидроцефалия, анэнцефалия, синдром Арнольда–Киари и Денди–Уокера, микроцефалия, агенезия мозолистого тела, акрания, spina bifida (спинномозговая грыжа). Гидроцефалия — заболевание, характеризующееся избыточным накоплением цереброспинальной жидкости в желудочках и подоболочечных пространствах головного мозга, сопровождающееся их расширением и атрофией мозгового вещества.
В ходе ретроспективной оценки исследования последов в группе А в подавляющем большинстве наблюдений (78,7%) определялись серозно-гнойный и гнойно-некротический децидуит и лишь в небольшом проценте случаев (21,3%) наблюдался серозный децидуит. Также в этой группе отмечалось наличие дисциркуляторных нарушений (выраженный отек стромы ворсин, тромбоз межворсинчатого пространства, ретроплацентарные гематомы). В группе Б серозный париетальный децидуит определялся в большинстве случаев (54,7%), воспалительные изменения не определялись в 38,7% наблюдений, серозно-гнойный париетальный децидуит обнаружен в 6,6% случаев.
На ретроспективном этапе при исследовании последа в большей степени были обнаружены патологическое строение и пороки развития пуповины, чем в плаценте. Так, на первом месте среди признаков патологического строения пуповины была тощая пуповина: 19 наблюдений в основной группе (19,4%) и 21 (21,6%) в группе сравнения (табл. 2). На втором месте определялись ложные узлы пуповины: 16 (16,3%) и 17 (17,5%) соответственно исследуемым группам, на третьем месте — истинные узлы пуповины: 14 (14,2%) и 15 (15,5%). Нередко в структуре патологических вариантов строения пуповины было оболочечное прикрепление пуповины: 12 (12,2%) и 9 (9,3%) соответственно. Реже были выявлены гипо- и гиперизвитая пуповина: 8 (8,2%) и 7 (7,2%) соответственно исследуемым группам; единственная артерия пуповины: 6 (6,1%) и 4 (4,1%); гематома пуповины: 1 (1,0%) в основной группе и 2 (2,1%) в группе сравнения. Всего при исследовании нарушения строения пуповины были выявлены в 76 случаях основной группы и в 75 — группы сравнения, в целом в исследовании — в 77,4% наблюдениях.
При гистологическом исследовании плаценты отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения (23 наблюдения — 23,5% в основной группе и 29–30,0% в группе сравнения). Серозный париетальный децидуит определялся в 17,3% наблюдений основной группы и 16,5% группы сравнения. Такие скудные изменения в плаценте, выявленные при исследовании, свидетельствуют о том, что ВПР плода, несовместимые с жизнью, чаще сочетаются с патологией строения пуповины, чем с нарушениями строения и пороками развития плаценты. Также относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения указывают на то, что прерывание беременности проводилось современным медикаментозным способом, который имитирует спонтанную сократительную деятельность матки и не вызывает грубых изменений в плаценте.
Таким образом, в структуре выявленных ВПР плода, несовместимых с жизнью, в исследуемых группах на первом месте были врожденные пороки сердечно-сосудистой системы, на втором — пороки ЦНС, на третьем — множественные пороки развития, на четвертом — пороки мочевыводящей системы. В остальных наблюдениях выявлены ВПР опорно-двигательного аппарата и другие: желудочно-кишечного тракта, дыхательной системы, шеи и лица, прочие.
При гистологическом исследовании плаценты ретроспективного этапа (до внедрения в акушерскую практику современных методов производства позднего индуцированного аборта) при проведении амниоинфузии гипертоническим раствором в подавляющем большинстве определялись серозно-гнойный и гнойно-некротический мембранит, при применении динопростона чаще наблюдался серозный париетальный децидуит. После внедрения в работу акушерско-гинекологической службы регламентирующего Приказа 572н при гистологическом исследовании плаценты у пациенток второго этапа обеих групп отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения.
При исследовании последа чаще встречались пороки развития пуповины, чем плаценты. На первом месте среди признаков патологического строения пуповины была тощая пуповина, на втором месте — ложные узлы пуповины, на третьем — истинные узлы. Реже определялось оболочечное прикрепление пуповины. Значительно реже были выявлены гипо- и гиперизвитая пуповина, единственная пупочная артерия; гематома пуповины. При гистологическом исследовании плаценты отмечалась относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения. Скудные изменения в плаценте (в сравнении с изменениями в пуповине), выявленные при исследовании, свидетельствуют о том, что врожденные пороки развития плода, несовместимые с жизнью, чаще сочетаются с патологией строения пуповины, чем с плацентарными пороками. Также относительная сохранность амниального эпителия, полнокровие сосудов и незначительные воспалительные изменения указывают на то, что прерывание беременности проводилось современным медикаментозным способом, который имитирует спонтанную сократительную деятельность матки и не вызывает грубых изменений в плаценте.
Литература
- Филиппов О. С., Токова З. З., Гата А. С., Куземин А. А., Гудимова В. В. Аборт: особенности статистики в Федеральных округах России // Гинекология. 2021. Т. 18. № 1. С. 92–96.
- Краснопольский В. К., Мельник Т. Н., Серова О. Ф. Безопасный аборт. М.: ГЭОТАР-Медиа, 2009. 48 с.
- Приказ Минздрава России от 12 ноября 2012 г. № 572 н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)».
- Акушерство. Национальное руководство / Ред. Э. К. Айламазян и др. М.: ГЭОТАР-Медиа, 2015. 1197 с.
- Кузьмин В. Н., Арсланян К. Н., Харченко Э. И. Современный взгляд на проблему внутриутробной инфекции // Лечащий Врач. 2021. № 3. C. 44.
- Дикке Г. Б., Хамошина М. Б. Контраверсии безопасного и небезопасного аборта // Доктор.Ру. 2014. T. 8. № 96. C. 73–77.
- Кравченко Е. Н., Коломбет Е. В. Реабилитация женщин после позднего индуцированного аборта при врожденных пороках развития плода // Лечащий Врач. 2021. № 8. С. 60.
- Радзинский В. Е. Медикаментозный аборт в различные сроки беременности. Рук-во по амбулаторно-поликлинической помощи в акушерстве и гинекологии / Под ред. В. Е. Радзинского, 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2014.
- American College of Obstetricians and Gynaecologists (ACOG). A clinician’s guide to medical and surgical abortion. NAF’s textbook; 2012. Available at: https://www.prochoice.org.
- Royal College of Obstetricians and Gynaecologists (RCOG). The care of women requesting induced abortion. London (England): Royal College of Obstetricians and Gynaecologists (RCOG); 2011. Nov. 130 p. (Evidence-based Clinical Guideline; no. 7). Available at: https://www.rcog.org.uk.
- Safe abortion: technical and policy guidance for health systems. 2 nd ed. World Health Organization, Department of Reproductive Health and Research; 2012. Available at: https://www.who.int/.
- Медикаментозное прерывание беременности. Клинические рекомендации МЗ РФ (протокол лечения) № 15–4/10/2–6120 от 15 октября 2015 г. 34 с.
- Коломбет Е. В., Кравченко Е. Н., Сабитова Н. Л., Цыганкова О. Ю., Безнощенко А. Б., Яминова Д. М., Андрюшкив В. Б. Способ прерывания беременности в поздние сроки беременности по медицинским показаниям. Патент на изобретение № 2580165 от 3.04.2015 г. Опубликовано: 10.04.2016 г. Бюллетень № 10.
- Кравченко Е. Н., Коломбет Е. В. Эффективность современных методов прерывания беременности в поздние сроки // Российский вестник акушера-гинеколога. 2021. 3. С. 64–68.
- Кравченко Е. Н., Коломбет Е. В. Поздний индуцированный аборт при врожденных пороках развития плода, несовместимых с жизнью // Гинекология. 2021. T. 18. № 5. C. 44–49.
- Приказ Министерства здравоохранения и социального развития Российской Федерации от 3 декабря 2007 г. № 736 «Об утверждении перечня медицинских показаний для искусственного прерывания беременности».
- Милованов А. П. Патология системы мать–плацента–плод: руководство для врачей. М.: Медицина, 1999. 447 с.
- Гагаев Ч. Патология пуповины / Под ред. В. Е. Радзинского. М.: ГЭОТАР, 2011, 96 с.
- Причины и дифференцированное лечение раннего невынашивания беременности (руководство для врачей) / Под ред. А. П. Милованова, О. Ф. Серовой. М.: Студия МДВ. 2011. 216 с.
- Экстраэмбриональные и околоплодные структуры при нормальной и осложненной беременности при номальной и осложненной беременности / Под ред. В. Е. Радзинского, А. П. Милованова. М.: МИА, 2004. 393 с.
Е. Н. Кравченко*, 1, доктор медицинских наук, профессор Е. В. Коломбет* А. Е. Любавина**, кандидат медицинских наук
* ФГБОУ ВО ОмГМУ МЗ РФ, Омск ** БУЗОО ОДКБ, Омск
1 Контактная информация
На фотоматериалах из собственной практики д-ра Р. Шухнина:
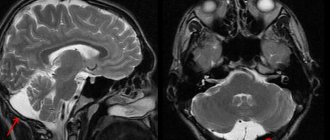
УЗИ, 26 недель беременности. Голова плода. Коронарное сечение. Отчетливая визуализация мозолистого тела мозга (стрелки)
УЗИ, 29 недель беременности. Голова плода. Коронарное сечение. Отчетливы симптомы агенезии мозолистого тела мозга (расширение затылочных рогов боковых желудочков, расширение 3-го желудочка мозга, радиальное отхождение извилин от его крыши)
Тот же плод. Профиль лица с признаками патологических отклонений: укорочение костной спинки носа.
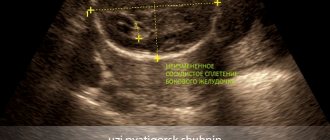
Нейросонография. Пациент 2 мес. Гидроцефалия. Отчетливая визуализация мозолистого тела в коронарном сечении.
Копирование и распространение информации без согласия автора запрещено!
аномалии развития плода гидроцефалия пренатальная диагностика в Пятигорске узи мозга плода