На языке медицинских специалистов разных стран мира болезнь Бехтерева носит различные названия: анкилозирующий спондилоартрит (АС), болезнь Штрюмпелля – Бехтерева – Мари. Все перечисленные понятия указывают на общую патологию: воспаление межпозвонковых суставов с последующим уменьшением их подвижности – анкилозом. Такое осложнение вызвано сращением суставных концов вследствие их увеличения в размерах по мере прогрессирования воспалительного процесса. Соединение позвонков блокирует позвоночный столб в жестком костном футляре, делая его неподвижным. Заболевание заставляет пациента принимать классическую склоненную форму (так называемая «поза просящего человека») и причиняет боль при попытках изменить положение тела.
Статистика и этиология заболевания
Первые упоминания о случаях анкилозирующего спондилоартрита встречаются в медицинских записях европейского Средневековья. Врачи того времени были немало удивлены, обнаружив скелеты с характерным окостенением позвоночника, отдельные элементы которых образовывали прочный «костный» столб. В середине 19 века болезнь стала предметом всеобщего изучения медиков, о чем свидетельствуют сохранившиеся записи на жалобы пациентов и обследования умерших людей. Труды русского врача Владимира Бехтерева, немца Адольфа Штрюмпеля и француза Пьера Мари приняты за основу этиологии и изучаются в медицинских заведениях в настоящее время.
Актуальная статистика болезни позвоночника Бехтерева свидетельствует о гендерной привязке. У мужчин она встречается в 4-6 раз чаще и имеет более агрессивное, ускоренное течение, чем у женщин. У последних отмечается:
- низкая степень болевого синдрома;
- сохранность функции позвоночника в полном объеме в течение длительного времени;
- артриты протекают с продолжительной ремиссией;
- признаки сакроилеита (воспаление крестцово-подвздошного сустава) регистрируются сравнительно редко.
Область развития патологического процесса – позвоночник, крупные суставы нижних конечностей и крестцово-подвздошное соединение. При внесуставной локализации первые признаки заболевания – поражение глазных яблок в виде покраснения склеры, воспаления радужной оболочки или роговицы. Характерные признаки отмечаются у 5-10% заболевших, что в некоторых случаях позволяет поставить точный диагноз на начальной стадии развития болезни Бехтерева. Реже встречается альтернативный дебют патологии в виде воспаления стенок аорты или мышечных волокон сердечной мышцы, развивающихся на фоне активно протекающего патологического процесса в суставах позвоночного столба.
Болезнь Бехтерева
Анкилозирующий спондилит (АС) – хроническое воспалительное заболевание позвоночника (спондилит) и крестцово-подвздошных суставов (сакроилеит), а также периферических суставов (артрит), энтезисов (энтезит), в ряде случаев глаз (увеит) и корня аорты (аортит), которым заболевают, как правило, до 40 лет и при котором более чем в 90% случаев выявляется генетический маркер HLA-B27 [1,7].
Рисунок 1. Анкилозированный позвоночник.
История Анатомические и клинические описания пациентов с АС датируются XVI веком. Первое описание этого заболевания в литературе относится к 1559 г., когда итальянский анатом и хирург Р. Коломбо описал в своей книге два скелета с характерными для АС изменениями. Недавно было опубликовано сообщение, что три фараона XVIII и XIX династий Древнего Египта (Аменхотеп II, Рамзес II и сын последнего Меренптах) также имели рентгенологически подтвержденный АС . Вероятно, наиболее старый задокументированный семейный случай болезни относится к семье Медичи (XV–XVI в. н. э.), правившей во Флоренции. АС был обнаружен у двух представителей этого рода после вскрытия семейного склепа и сопоставления патологоанатомических находок с описанием их заболевания современниками . Первыми качественными описаниями АС считаются сообщения русского невролога В.М. Бехтерева в 1893 г., немецкого врача А. Штрюмпеля в 1897 г., французского врача П. Мари в 1898 г. Поэтому АС называют болезнью Бехтерева и болезнью Мари-Штрюмпелля.
Рисунок 2. Буклет американского врача Д. Теккера. Он описал клинический случай больного Леонарда Траска с деформацией позвоночника, клинической картиной, сходной с АС. В 1833 году, Траск упал с лошади, что усугубило состояние и привело к тяжелой деформации.
Ш.Ф. Эрдес приводит следующие названия, которые носил АС в течение своей истории:
- болезнь Бехтерева;
- анкилозирующий спондилит;
- анкилозирующий спондилоартрит;
- болезнь Мари-Штрюмпеля;
- болезнь Штрюмпелля-Бехтерева-Мари;
- chronic ankylosing inflammation of the vertebral column (Strümpell, 1897);
- pelvospondylitisossificans (Romanus,1951);
- rheumatoid ossifying pelvispondylitis;
- rheumatoid spondylitis (ARA 1941);
- bamboo spine;
- poker back;
- spondylitis ankylopoetica (Fraenlel, 1904);
- spondylitis deformans (Goldwaite, 1899);
- atrophic spondylitis;
- spondylarthritis ankylopoetica;
- ankylosing spondyloarthritis;
- atrophic ligamentous spondylitis;
- ossifying ligamentous spondylitis (Knaggs, 1924);
- rhizomelic spondylosis (Marie, 1898);
- spondylitis rhizomelique;
- syndesmophite ossificante (Simmonds, 1931);
- ankylosing spondylitis (Tichy, 1961; ARA,1963) .
Ныне существующая концепция АС связана с развитием рентгенографии. В 1930-х годах Кребс, немецкий радиолог, изучил относительно большое количество пациентов с АС и описал, что рентгенографически сакроилеит присутствует почти у всех этих пациентов и возникает на ранних стадиях заболевания. Эти данные впоследствии были подтверждены Форестье во Франции и Скоттом в Англии и легли в основу центральной роли радиографического сакроилеита в критериях AС. В 70-х Молл и Райт создали концепцию группы взаимосвязанных заболеваний (так называемых серонегативных спондилоартритов), куда вошли: АС, псориатический артрит, реактивный артрит, артрит, ассоциированный с болезнью Крона, болезнью Уиппла, болезнью Бехчета . Для этих заболеваний типичен отрицательный ревматоидный фактор. Они считались взаимосвязанными из-за наличия предполагаемого генетического фона, схожих клинических проявлений, таких как вовлечение крестцово-подвздошных суставов или позвоночника, периферических суставов, кожи и слизистых оболочек, а также из-за отсутствия подкожных узелков. Позднее болезнь Бехчета и болезнь Уиппла исключили из группы спондилоартритов. В 1990 г. появились первые классификационные критерии серонегативных спондилоартритов Амора, а вскоре и вторые, разработанные Европейской группой по изучению спондилоартритов в 1991 г. В 1995 г. была сформирована международная группа экспертов по АС (ASAS – ASsesment in Ankylosing Spondylitis working group) при Европейской антиревматической лиге (EULAR), которая стала координировать процессы разработки новой классификации, методов диагностики, мониторинга и лечения спондилоартритов (рисунок 3) [2]. .
Рисунок 3. Критерии аксиального спондилоартрита, предложенные экспертами ASAS.
Эпидемиология
Распространенность АС широко варьирует: от 0.1% до 1.4% (Норвегия). Ни при одной из ревматических болезней нет такого четкого сцепления с антигеном гистосовместимости, как при АС: у 90-95% больных обнаруживают HLA-B27. Распространенность АС зависит от частоты носительства HLA-B27. HLA-B27 чаще встречается у населения северных стран. АС распространен в первую очередь среди молодых мужчин (15-30 лет), у женщин заболевание встречается реже, соотношение мужчин и женщин 2:1[3]. У 80 % пациентов первые симптомы проявляются в возрасте до 30 лет, а в возрасте старше 45 лет обнаруживаются впервые менее чем у 5% больных [5]. .
Генетические аспекты
Близнецовые исследования подтверждают, что предрасположенность к AС почти полностью определяется генетически. Так, в двух исследованиях утверждается, что АС наследуется более чем в 90% случаев. Наследуемость клинических проявлений болезни также значима и включает в себя возраст первого появления симптомов (наследуемость 40%), активность заболевания, измеряемую с помощью широко используемых опросников BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) и BASFI (Bath Ankylosing Spondylitis Functional Index) (наследуемость 51% и 76% соответственно), а также рентгенологическую тяжесть течения (наследуемость 62%). Ассоциация HLA-B27 с АС является одной из самых сильных известных в настоящее время генетических ассоциаций с общим заболеванием. Тем не менее, исследования в семьях предполагают, что менее 50% от общего генетического риска обусловлено изолированными мутациями HLA-B27 и вполне вероятно вовлечение в процесс нескольких других генов . У родственников первой степени родства риск возникновения АС в 5-16 раз больше, чем у HLA-B27-позитивных лиц в общей популяции, что лишний раз подтверждает существование других модифицирующих факторов риска АС, кроме HLA-B27. Наиболее вероятные модели заболевания предполагают, что гены-модификаторы эффекта HLA-B27 и определяют риск возникновения АС у его носителей. Исследования рисков повторного появления АС (у родственников заболевшего) показывают, что эту болезнь нельзя рассматривать как моногенную. Риск повторного проявления в семье болезни зависит от ее генетической модели. Частота моногенных заболеваний снижается примерно вдвое при каждом отдалении от пробанда по генеалогическому древу. Частота полигенных заболеваний снижается примерно на квадратный корень из исходной частоты при тех же условиях. АС, по-видимому, находится где-то между этими двумя моделями; HLA-B27 практически стопроцентно обуславливает наследование АС, но на его пенетрантность в значительной степени влияют другие гены . В выводах исследований семей с АС предполагается, что в возникновение его вовлекается умеренное количество генов со значительным эффектом; наиболее близкие модели предполагают, скорее всего, набор из пяти генов, однако другие подходящие модели говорят о диапазоне от 3 до 9 вовлеченных генов. Вполне вероятно, что в дополнение к главному HLA-B27 имеется небольшое количество генов с умеренным детерминирующим эффектом и большое количество генов с малым эффектом. Таким образом, крупные семьи с множественными случаями проявления болезни, типичными для заболеваний с моногенной этиологией, крайне редки при АС [5].
Гены MHC
Главный комплекс гистосовместимости (MHC) в коротком плече 6 хромосомы тесно связан с АС . Хотя большая часть генетических ассоциаций этого локуса зависит от ассоциации АС с HLA-B27, взаимодействия, очевидно, гораздо более сложны.
- Подтипы HLA-B27 и B27. Примерно 8% европейцев являются носителями HLA-B27, по сравнению, например, с частотой встречаемости его примерно в 5% у китайцев. HLA-B27-носительство более распространено у северных европейцев и редко встречается у африканцев и австралийских аборигенов. Распространенность АС в целом соответствует распространенности HLA-B27 в популяции. В большинстве исследований от 80% до 95% больных АС являются носителями HLA-B27. Несмотря на это, лишь у немногих из носителей HLA-B27 развивается АС. Таким образом, скрининг на носительство HLA-B27 в популяции не представляет ценности, но у пациентов с болями в спине является полезным компонентом диагностического процесса. Существуют убедительные доказательства в конкретных группах населения, что различные подтипы HLA-B27 имеют разные по силе связи с возникновением АС. Сейчас насчитывается до 45 подтипов HLA-B27. Быстрое увеличение числа подтипов, происходящее в течение последних 5 лет, связано с расширением использования HLA-типирования на основе анализа ДНК. В большинстве случаев описанные подтипы встречались лишь у некоторых непораженных индивидуумов, и, следовательно, невозможно сказать, являются ли они связанными с АС. Тем не менее, некоторые подтипы достаточно распространены, что относительно можно сопоставить с их связью с АС. Сообщается, что АС (не только недифференцированный спондилоартрит) возникает при наличии следующих подтипов: B * 2701, * 2702, * 2703, * 2704, * 2705, * 2706, * 2707, * 2708, * 2710, * 2714, * 2715, и * 2719.
- Другие гены комплекса гистосовместимости. МНС локализован в 6 хромосоме (6p21.3), содержит около 220 генов, многие из которых выполняют иммунорегулирующие функции. Существуют убедительные доказательства того, что МНС содержит несколько других, не относящихся к HLA-B27 генов, детерминирующих восприимчивость к болезни, в том числе HLA-B60 (аллель HLA-B), а также не-HLA-B гены. Ассоциация HLA-B60 с АС гораздо слабее, чем ассоциация HLA-B27; отношение шансов для него составляет 3,6. Так что неизвестно, является ли HLA-B60 геном, вызывающим заболевание, или же маркером МНС-гаплотипа, несущего другие болезнетворные гены. Ассоциация гена HLA-B60 с болезнью хорошо известна среди HLA-B27-положительных пациентов, а также есть данные, демонстрирующие его роль в случаях HLA-B27-негативного АС [5] .
Гены, не входящие в МНС
Механизм развития болезни
Несмотря на активное изучение и собранную статистику, происхождение заболевания остается невыясненным. Большинство специалистов склоняются к версии генетической предрасположенности: наличие у больных антигена HLA-В27 переходит к родственникам первой степени в 25-30%, а в кругу семьи встречается лишь в 7-8% случаев. У жителей приэкваториальных областей патология практически не диагностируется, а по мере движения к полюсам ее частота возрастает до 30-40%.
Описывая причины болезни Бехтерева, специалисты говорят о неадекватном иммунном ответе по отношению костно-мышечной системы позвоночного столба. Ее ткани воспринимаются организмом как чужеродные, и возникает эффект их отторжения, характерный для всех аутоиммунных заболеваний. Последующий воспалительный процесс запускает вещество цитокин, состоящее из пептидных сигнальных молекул ФНО-α, названных факторами некроза опухоли альфа. Вследствие ее активного воздействия позвоночник постепенно становится окостеневшим и обездвиженным. Подтверждением негативного влияния молекулы ФНО-α является максимальная концентрация цитокина в крестово-подвздошном соединении.
Ускорить переход болезни Бехтерева на новые стадии могут сопутствующие патологии или неблагоприятные внешние факторы. В их числе обычно называют хронические инфекционные заболевания, переохлаждение организма, травмы таза или позвоночника, последствия которых не удалось полностью устранить. В группе риска находятся лица с гормональными нарушениями, инфекционно-аллергическими заболеваниями, хроническими воспалительными процессами в органах таза и кишечника.
Подробное описание исследования
Наследственная спастическая параплегия (НСП), или болезнь Штрюмпеля, включает в себя группу редких наследственных заболеваний, которые характеризуются:
- Развитием нижнего спастического парапареза — уменьшение силы в мышцах нижних конечностей, вплоть до ее полного отсутствия;
- Прогрессирующим ухудшением ходьбы;
- Гиперефлексией — патологическим усилением рефлексов.
В основном заболевание наследуется по аутосомно- доминантному типу, т.е. развивается у потомков примерно в 50% случаев. Также описаны случаи аутосомно-рецессивного наследования (болезнь проявляется только при наследовании «дефектного» гена от обоих родителей) и наследования, связанного с Х-хромосомой, когда «дефектный» ген расположен в Х-хромосоме.
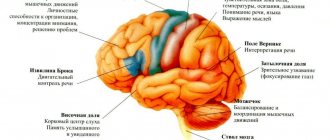
Самым главным клиническим проявлением болезни Штрюмпеля служит нижний спастический парапарез, в результате которого мышцы перестают получать нервные импульсы и постепенно теряют мышечную силу. Также могут развиваться и другие неврологические симптомы, например, глазодвигательные, когнитивные нарушения и пр.
На сегодняшний день известно 32 хромосомных участка, нарушения в которых могут привести к развитию патологии.
Для аутосомно-доминантной болезни Штрюмпеля описано 10 локусов (участков), для аутосомно-рецессивной — 14 локусов, для Х-сцепленной формы — 3.
Ген SPG4 локализован в хромосомной области 2p22.3 и кодирует белок — спастин. В гене SPG4 идентифицировано более 500 мутаций. Данный ген задействован в развитии примерно 40% случаев всех аутосомно-доминантных спастических параплегий.
Белок спастин — представитель семейства ААА-белков, АТФаз особого класса с множественными видами клеточной активности. Эти белки вовлечены в целый ряд клеточных процессов, таких как клеточный цикл, внутриклеточный транспорт, протеолиз (процесс расщепления белков). Спастин участвует в процессах формирования и разрушения специальных белковых компелксов, которые важны для поддержания целостности нейронов и передачи нервного импульса.
Мутации гена изменяют структуру белка спастина, в результате чего нейроны повреждаются и не могут полноценно проводить нервные импульсы.
Средний возраст начала клинических проявлений болезни — 30-40 лет, хотя заболевание может быть диагностировано и у ребенка.
Степень выраженности симптомов и скорость их прогрессирования могут значительно различаться. Заболевание может медленно прогрессировать с рождения и стабилизироваться к подростковому возрасту. В этом случае возможно сохранение способности к самостоятельному передвижению. У других пациентов течение непрерывное.
Наличие характерных клинических проявлений патологии, а также отягощенный семейный анамнез позволяют предположить спастическую параплегию Штрюмпеля. Генетическое исследование используется для подтверждения предварительно поставленного диагноза.
Симптомы у мужчин и женщин
В числе признаков заболевания все без исключения пациенты отмечают болезненность в спине, ногах и ягодицах с одновременным ощущением скованности в позвоночнике. Дискомфорт усиливается во второй половине ночи вследствие длительного лежачего положения. Также в числе симптомов болезни Бехтерева – скованность в груди, болезненность пяточных костей, неприятные ощущения при попытках смены положения тела.
В большинстве случаев признаки болезни Бехтерева обнаруживаются без видимых внешних причин. Но у патологии имеется ряд предвестников, которые нельзя игнорировать. В их числе:
- скованность спины, заметная ограниченность движений, справиться с которой удается с помощью горячего душа;
- слабость по утрам, быстрая утомляемость;
- слабовыраженные боли в спине без четкой локализации;
- болезненность в области крестца, таза и ребер, которые усиливаются при кашле, чихании или разговоре;
- дискомфорт при сидении на жесткой поверхности;
- изменение походки, связанное с болью в пятках;
- покраснение глаз, сопровождаемое зудом и жжением.
- уменьшение амплитуды движения шейного отдела позвоночника.
Нередко болезнь Бехтерева «прячется» под признаки ревматоидного артрита с болью в сердце и мелких суставах конечностей. Иногда заболевание на острой стадии удается обнаружить случайно в ходе комплексной диагностики организма или при подозрении на прочие заболевания. На рентгенографии заметно окостенение и срастание межпозвоночных суставов, что позволяет с уверенностью говорить о развитии патологии опорно-двигательного аппарата.
У вас появились симптомы болезни Бехтерева?
Точно диагностировать заболевание может только врач. Не откладывайте консультацию — позвоните по телефону
Что такое болезнь Штрюмпеля
Болезнь Штрюмпеля, также известная как семейная спастическая параплегия – патологический процесс из группы дегенеративных миелопатий. Данному заболеванию характерно поражение передних и боковых столбов спинного мозга. При этом спинномозговые структуры поражаются преимущественно в поясничном отделе позвоночного столба, в более редких случаях в грудном отделе.
При данном заболевании затрагиваются пирамидные пути спинного мозга. В результате этого происходит поражение центральной нервной системы, последствием чего становятся нарушения со стороны опорно-двигательного аппарата. В подавляющем большинстве случаев болезнь Штрюмпеля затрагивает нижние конечности, механизм ее развития заключается в прогрессирующем парапарезе нижних конечностей. По мере развития заболевания нарастает гипертонус мышечных структур нижних конечностей.
Согласно статистике, манифестация заболевания приходится на возраст от 10 до 30 лет. Однако в обширном понимании дебют болезни Штрюмпеля возможен в любом возрасте от рождения и вплоть до 80 лет. Что касается причин возникновения данной патологии, речь идет о генетической предрасположенности, обусловленной генными мутациями.
Классификация патологического процесса тесно сопряжена с причинами его развития и включает такие виды спастической параплегии:
- аутосомно-доминантная – заболевание наблюдается у одного из родителей, риск его развития у ребенка составляет порядка 50%;
- аутосомно-рецессивная – оба родителя являются носителями дефектного гена (только носителями), риск возникновения патологии у ребенка – порядка 25%;
- Х-сцепленная – носителем дефектного гена выступают только женщины, однако, болезнь развивается у ребенка мужского пола.
Возможные осложнения
При отсутствии или добровольном отказе пациента от лечения болезни Бехтерева патология развивается следующим образом:
- боли в спине и бедрах становятся постоянными, усиливаясь при длительном покое тела;
- позвоночный столб утрачивает гибкость, и движения пациента становятся затрудненными;
- пациенту сложнее дышать;
- воспалительный процесс перемещается от тазовой области выше к грудной клетке.
При умеренной физической нагрузке боль становится менее выраженной, тогда как в длительном состоянии покоя неприятные ощущения усиливаются. При отсутствии лечения и игнорировании признаков заболевания позвоночник принимает чуть согнутую форму, руки деформируются в локтях, спина сутулится, ноги сгибаются в коленях. Со временем перечисленные изменения приобретают необратимый характер. Патология значительно осложняет работу внутренних органов, вследствие чего развиваются воспаление легких, остеопороз, поражение глаз с потерей зрения, поражение сосудистой системы с возрастанием риска инфаркта миокарда, почечная недостаточность.
Классификация форм
На основании данных исследований специалисты различают следующие формы заболевания:
- центральная, локализированная на позвоночнике;
- кифозная, при которой воспаление затрагивает позвонки шейного и грудного отдела;
- ригидная, приводящая к сглаживанию естественных изгибов спины;
- ризомелическая, область локализации которой – позвоночник и корневые суставы;
- периферическая, захватывающая суставы нижних конечностей;
- скандинавская, для которой характерно поражение суставов кистей рук;
- висцеральная, в которой сочетаются признаки любой из перечисленных форм с одновременным воспалением почек, сердца или артерий.
Диагностика
Получить исчерпывающую картину заболевания и уточнить область ее локализации удается с помощью следующих методов исследования:
- рентгенография, на которой будут заметны патологии крестцово-подвздошной области, откуда начинается развитие заболевания;
- магнитно-резонансная томография;
- генная диагностика на предмет наличия в организме антигена HLA-B27;
- общеклинический анализ крови, где на воспалительный процесс указывает резкий рост скорости оседания эритроцитов.
Лечение и прогноз
Лечение заболевания необходимо в течение всей жизни пациента с коррекцией набора препаратов в зависимости от достигнутых результатов и видимых изменений в состоянии больного. В комплекс включают:
- гормональные препараты для снятия воспаления;
- иммуносупрессоры для подавления процесса угнетения «чужеродных» тканей позвоночника со стороны иммунной системы организма;
- методы физиотерапии и ЛФК.
Новую страницу в истории лечения болезни Бехтерева удалось открыть после создания препаратов-ингибиторов ФНО, блокирующих активность молекул ФНО-α. Они не влияют на иммунную систему, но приостанавливают синтез веществ, активизирующих воспалительный процесс в суставах. Благодаря их приему удается приостановить распространение воспаления и сохранить подвижность костных сочленений, одновременно исключив процесс их сращивания. В числе дополнительных рекомендаций при болезни Бехтерева – криотерапия, массаж и мануальная терапия, хлоридно-натриевые ванны. Их сочетание увеличивает длительность ремиссий и облегчает пациенту прохождение фазы обострения.
Лечение
Болезнь Штрюмпеля, лечение которой может быть лишь симптоматическим, является сложным заболеванием с психологической стороны. Больным необходимо оказывать всестороннюю моральную поддержку, курсы симптоматического лечения проводить не реже двух раз в год.
Терапия заболевания направлена, прежде всего, на снятие мышечного гипертонуса, используются миорелаксанты (мидокалм, баклосан, сирдалуд и другие). Также используются ортопедические способы воздействия (ношение ортезов и других устройств), нейропротекторные препараты (витамины группы В). Больным показаны физиотерапевтические процедуры, парафиновые аппликации, массаж по расслабляющей методике, метаболические препараты.
При постоянном и полноценном лечении прогрессирование заболевания идет очень медленно и человек может долго значимо не терять качества жизни.
Как записаться на прием к специалисту в АО «Медицина» (клиника академика Ройтберга) в Москве
Записаться на прием к специалистам АО «Медицина» (клиника академика Ройтберга) можно на сайте – интерактивная форма позволяет выбрать врача по специализации или осуществить поиск сотрудника любого отделения по имени и фамилии. Расписание каждого доктора содержит информацию о приемных днях и доступных для визитов пациентов часах.
Администраторы клиники готовы принять заявку на прием или вызов врача на дом по телефону +7 (495) 775-73-60.
Удобное расположение на территории центрального административного округа Москвы (ЦАО) – 2-й Тверской-Ямской переулок, дом 10 – позволяет быстро добраться до клиники от станций метро «Маяковская», «Новослободская», «Тверская», «Чеховская» и «Белорусская».