Церебральная ишемия, если говорить проще, это недостаточное поступление крови в мозг ребенка. Это может повлечь за собой инвалидность и даже становится причиной летальных исходов. В большинстве случаев диагностируется гипоксически-ишемическая энцефалопатия, и не сугубо ишемия у недавно рожденных малышей. Гипоксически-ишемическая энцефалопатия означает, что в клетки не поступают нужные дозы кислорода, потому в мозге начинаются патологические процессы.
- Причины
- Патогенез (суть патологии)
- Факторы риска патологии
- Степени
- Признаки тяжелой ишемии
- Церебральная ишемия при недоношенности и у доношенных детей
- Результаты гипоксии
- Диагностика
- Лечение
- Профилактика ишемии
Признаки и симптомы ишемии головного мозга у новорожденных
Заболевание проявляет себя явными симптомами, которые обращают на себя внимание.
- Ребенок легко возбудим, плачет без причин, плохо спит, вздрагивает, у него наблюдается тремор.
- Мышечный тонус понижен, малыш мало двигается, с трудом сосет и глотает.
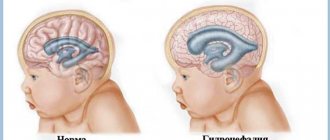
- Родничок увеличен, внутричерепное давление повышено из-за того, что в головном мозге скапливается жидкость.
- Возникают судороги, подергивания конечностей и головы, а также коматозные состояния с потерей координации движений, сознания.
- Кожа новорожденного приобретает мраморный оттенок.
- Нарушается работа ЖКТ – наблюдаются вздутие, запор, понос.
Клинические проявления
Симптомы заболевания существенно различаются на разных стадиях. И если первая степень не требует помещения ребенка в стационар и признаки проходят за несколько дней после заболевания, то вторая и третья требуют пристального внимания врачей и в случае необходимости реанимационных мероприятий.
Симптомы ЦИ 1 степени
Патологическому состоянию характерны легкие поражения тканей центральной нервной системы, с последующим развитием кислородного голодания. Причиной заболевания обычно становятся сложные роды с получением травм, асфиксии. Симптоматика слабовыраженная. Поэтому определить наличие заболевания затруднительно. Из-за этого могут развиваться неблагоприятные последствия.
При этом наиболее характерными проявлениями являются:
- Сильные головные боли и мигрени. Проявляются в виде беспокойного поведения, проблема со сном и напряжения. Ребенок будет часто плакать.
- Возможны повышения тонуса мускулов. Мышечная система постоянно напряжена. При ощупывании пальцами плотная. Степень гипертонуса определяется специалистом, поскольку мышечное напряжение нормально для младенцев.
- Усиленная реакция на сухожильные рефлексы. Информацию собирают при постукивании по коленному суставу пальцами. При этом очень быстро сгибается конечность.
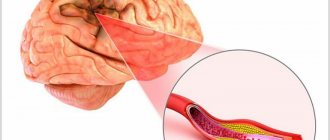
Как возникает церебральная ишемия?
В 70% случаев ишемия возникает у плода еще в утробе матери и связана с образованием тромба в одном из сосудов, питающих головной мозг, или с недостаточным развитием сосуда. Чаще всего заболевание диагностируют у недоношенных детей, у которых сосудистая система еще не полностью сформирована.
В результате в жизненно важный орган поступает недостаточное количество крови, а вместе с ней – кислорода. Промедление с оказанием медицинской помощи ведет к поражению более крупных участков головного мозга, кровоизлиянию в мозг и другим тяжелым последствиям.
Преждевременные роды являются главной причиной младенческой смертности и серьезным фактором утраты человеческого потенциала выживших детей в течение последующей жизни. По данным зарубежных авторов, во всем мире ежегодно рождаются несколько миллионов детей с очень низкой массой тела (ОНМТ) [1]. В США 90% из 65 000 новорожденных младенцев с ОНМТ переживают неонатальный период из-за больших успехов в интенсивной терапии, однако у 5—10% этих детей позже обнаруживают детский церебральный паралич [2].
Внедрение современных медицинских технологий в последнее десятилетие отмечено снижением перинатальной и младенческой смертности. Вместе с тем повышение коэффициента выживаемости детей с ОНМТ и экстремально низкой массой тела (ЭНМТ) при рождении влечет за собой повышение заболеваемости и формирование ранней инвалидности [3]. Среди причин детской инвалидности патология нервной системы занимает первое место, а вклад перинатальных поражений достигает 60—80% всех неврологических заболеваний [4]. В России ежегодно из числа освидетельствованных инвалидов с детства признаются трудоспособными не более 2,5—5% по сравнению с 50% за рубежом [5].
Среди факторов, неблагоприятно влияющих на антенатальный период, большое значение имеет нарушение маточно-плацентарного кровообращения, причиной которого могут быть как экстрагенитальная, так и соматическая патология матери [6]. Нарушения маточно-плацентарного кровотока в свою очередь приводят к развитию гипоксии, являющейся центральным звеном патогенеза антенатального повреждения плода, и в первую очередь центральной нервной системы (ЦНС). В работах многих авторов установлен целый комплекс физиологических приспособительных реакций плода к неблагоприятным условиям развития, в частности к гипоксии [7—10]. Однако информации о биохимическом статусе нервной ткани плода и новорожденного при данной патологии недостаточно. Большой интерес в этом плане представляет изучение метаболизма глюкозы, особенностей свободнорадикального окисления и обмена глутамата, процессов некроза и апоптоза.
Внутриутробно плод находится в состоянии гипоксии, однако эта среда для него является физиологической, более того, на ранних этапах эмбрионального периода она необходима для нормальной дифференцировки клеток. Оксигенация плода зависит от градиентов парциального давления кислорода между материнской и плацентарной кровью, плодной кровью и плодной тканью. Известно, что в первые недели после зачатия в эмбриональном периоде уровень парциального давления кислорода (рО2) чрезвычайно низок и составляет около 18—20 мм рт.ст. Предположительно, это необходимо для защиты эмбриона, который очень чувствителен к повреждающему действию реактивных форм кислорода [11]. Гипоксия в эмбриональном периоде вызывает ангиогенез и является предпосылкой для поддержания плюрипотентности стволовых клеток [12]. Примечательно, что в I триместре беременности эмбриональные стволовые клетки развиваются при уровне рО2 около 10—15 мм рт.ст., тогда как в эндометрии рО2 составляет около 25 мм рт.ст. Стволовые клетки демонстрируют более эффективный рост и дифференцировку при низких давлениях кислорода — 10—15 мм рт.ст. [13]. Длительная гипоксия будет стимулировать ангиогенез посредством транскрипционной и посттранскрипционной регуляции факторов роста: фактор роста эндотелия сосудов, эритропоэтин, фактор роста плаценты и ангиопоэтин1 [14].
Основным регулятором адаптивных ответов клетки на гипоксию является индуцированный гипоксией фактор1 (ИГФ-1), гетеродимерный транскрипционный фактор, включающий субъединицы (ИГФ-1α и ИГФ-1β). ИГФ-1α стабилизируется, когда концентрация кислорода ниже определенного критического порога, таким образом, накапливаясь в гипоксической среде. ИГФ-1β присутствует в ядре клетки, и в условиях гипоксии он димеризуется с ИГФ-1α, улучшая доставку кислорода в ткань [15, 16]. На 14—16-й неделе беременности рО2 поднимается до стабильных значений 45—50 мм рт.ст. и сохраняется таковым до конца беременности. На поздних сроках беременности скорость пролиферации и дифференцировки клеток снижается [17, 18]. Процессы перекисного окисления липидов присутствуют с самого начала беременности, что способствует нормальному развитию плода. В конце I триместра физиологический окислительный стресс вызывает регрессию ворсинок, которые были сформированы на всей поверхности хорионического мешка, чтобы сформировать окончательную дискоидную плаценту [19]. Постнатальное увеличение концентрации кислорода вызывает всплеск образования его активных форм, при этом экспрессия антиоксидантных ферментов, таких как супероксиддисмутаза, каталаза и глутатионпероксидаза, динамически увеличиваются в течение последних недель беременности. Аналогичным образом повышается доступность наиболее важных неферментативных антиоксидантов: глутатиона, гемоксигеназы, витаминов С и Е, β-каротинов и т. д. [20]. Недоношенный ребенок более подвержен риску свободнорадикального повреждения [21]. Считается, что использование высоких концентраций кислорода во время реанимации новорожденных вызывает гипероксемию. При этом была обнаружена значительная корреляция между окисленным глутатионом (GSSG), рО2 и активностью ферментов окислительно-восстановительного цикла глутатиона [22, 23]. Многие заболевания, связанные с недоношенностью, такие как ретинопатия, бронхолегочная дисплазия, внутрижелудочковые кровоизлияния, связаны со свободнорадикальным повреждением в результате незрелости антиоксидантной системы недоношенных детей [24].
Нервная ткань является наиболее уязвимой при воздействии гипоксии. Гипоксия приводит к нарушению обмена кислорода и углекислоты, что в свою очередь вызывает метаболические расстройства и гемодинамические нарушения [25]. Известны следующие механизмы, лежащие в основе церебрального повреждения при гипоксии-ишемии: местные нарушения обмена макроэргических соединений, чрезмерное перекисное окисление липидов и нарушение Na+/K+-АТФазной активности, внеклеточное накопление К+ и внутриклеточное накопление Са2+, внутриклеточный ацидоз, нарушение обмена нейротрансмиттеров [26]. Основные звенья гипоксически-ишемического стресса представлены P. Marro [27].
— Недостаток кислорода. Дефицит кислорода как акцептора электронов в тканях приводит к нарушению транспорта электронов в цикле Кребса и дыхательной цепи, восполнению энергии путем увеличения мозгового кровотока и анаэробного метаболизма [28].
— Глутамат-кальциевый каскад. Повышение концентрации глутамата активирует N-метил-D-аспартат (NMDA)-рецепторы, что сопровождается увеличением внутриклеточного Са2+ [29]. Нарушения в митохондриях и эндоплазматическом ретикулуме могут привести к дальнейшему накоплению внутриклеточного Ca2+. Повышение концентрации Са2+ внутри клетки способствует образованию свободных радикалов, что в свою очередь вызывает перекисное окисление липидов клеточной и внутриклеточной мембран. Наряду с этим накопление внутриклеточного Са2+ закономерно сопровождается повышением его концентрации в ядре клетки. Избыток внутриядерного Са2+ является фактором активации протоапоптотических генов, которые запускают генетически запрограммированную гибель клетки — апоптоз [30].
— Роль свободных радикалов. Гипоксия-ишемия вызывает неадекватное насыщение митохондриальной цитохромоксидазы, нарушение транспорта электронов в митохондриях, что приводит к повышению концентрации супероксид-аниона и поступлению свободных радикалов из митохондрий в цитоплазму [31]. Повышение концентрации внутриклеточного Са2+ активирует NO-синтетазу, циклооксигеназу и липооксигеназу, что способствует образованию свободных радикалов. Их избыток приводит к дополнительному высвобождению возбуждающих аминокислот и активации NMDA-рецепторов [32].
— Факторы воспаления. Действие гипоксии — ишемии на микроглию способствует синтезу цитокинов, интерлейкина-1β (ИЛ-1β), фактора некроза опухоли α (TNFα) [33]. Активность ИЛ-1β сопровождается продукцией специфических протеаз и развитием апоптоза. Избыточное образование TNFα обладает прямым токсическим эффектом и вызывает сосудистую инфильтрацию с высвобождением цитотоксических факторов, активных форм кислорода и цитокинов [34].
— Роль оксида азота (NO). NO-синтетаза содержится в эндотелиальных клетках, астроцитах, нейронах. Существует 3 изоформы NO-синтетазы: нейронная (регулирует синаптогенез и ремоделирование и зависит от Са2+); эндотелиальная (регулирует сосудистый тонус, особенно вазодилатацию, и зависит от Са2+); индуцируемая (присутствует в макрофагах и астроцитах, индуцируется цитокинами, независима от Са2+) [35]. Активация NMDA-рецепторов вызывает продукцию нейронной NO-синтетазы, которая способствует образованию радикала оксида азота (NO.) и повреждению нейрональной ДНК [36].
— Апоптоз. Описанные выше процессы развиваются в первые минуты острой гипоксии, после чего включается механизм апоптоза [37]. Гипоксия через ряд звеньев патогенеза способствует накоплению внутриклеточного Са2+, активации эндонуклеаз, повреждению экспрессии генов. Это приводит к растормаживанию фагоцитарной активности глиальных клеток и нейронов, которые фагоцитируют поврежденный нейрон, вызывая уменьшение его размера и секвестрацию [38].
Наиболее значительные потери клеток нервной ткани развиваются спустя 2—6—48 ч после рождения, вследствие патологического окислительного стресса. В таких условиях в первые часы и сутки жизни после рождения у новорожденных, перенесших гипоксию, развивается выраженный дисбаланс в системе регуляции церебрального кровообращения, который обостряет течение ишемического процесса [39].
Особенностью недоношенных детей является незрелость антиоксидантной системы, поскольку физиологическое увеличение антиоксидантной способности происходит в конце беременности, именно поэтому они более подвержены воздействию окислительного стресса, особенно когда их состояние требует проведения респираторной терапии [40]. В связи с этим возникает необходимость изучения окислительного стресса у этих детей, в частности путем измерения продуктов перекисного окисления липидов и компонентов антиоксидантной системы.
Известно, что антиоксиданты обладают противовоспалительной активностью, а систему глутатиона рассматривают как критический фактор развития воспаления и иммунных ответов [41, 42]. Это подтверждается изменением уровня цитокинов, острофазных белков и глутатиона во время воспаления [43, 44]. Система глутатиона включает его формы, ряд ферментов его синтеза и катаболизма, и механизмы транспорта. Все эти компоненты вносят важный вклад в изменение глутатионового статуса [45].
Изучая классификацию церебральных поражений у новорожденных, необходимо отметить, что наиболее популярной у неонатологов является классификация гипоксической энцефалопатии по H. Sarnat и M. Sarnat [46]. Она объединяет клинические признаки церебральной ишемии и результаты электроэнцефалографии (ЭЭГ). В данной классификации оцениваются основные показатели новорожденного: уровень сознания, нерво-мышечный статус, рефлексы, вегетативная функция, наличие судорог, ЭЭГ. В зависимости от выраженности церебральной дисфункции устанавливают I, II или III стадию энцефалопатии. Канадские неонатологи модифицировали классификацию Sarnat, дополнив ее расстройствами терморегуляции и исключив ЭЭГ и некоторые другие показатели [47]. Неонатологи Великобритании используют классификацию гипоксических церебральных нарушений L. Dubowitz и соавт.[48]. В международной классификации болезней 11-го пересмотра (МКБ-11) гипоксически-ишемические поражения головного мозга у новорожденных относятся к группе «неврологических расстройств, характерных для перинатального и неонатального периодов» [49]. Основным отличием от классификации 10-го пересмотра является то, что в МКБ-11 данная группа дополнена заболеваниями, которые ранее не выделяли отдельно. Например, перинатальный артериальный инсульт и неонатальный церебральный синовенозный тромбоз. В то же время из предложенной классификации была исключена врожденная гидроцефалия. Диагноз асфиксии новорожденного поместили в «группу других нарушений, возникающих в перинатальном периоде». При этом отдельно выделили асфиксию новорожденного с оценкой по шкале Апгар 0—3 балла и асфиксию новорожденного с оценкой по шкале Апгар 4—6 баллов. Что касается церебральных повреждений гипоксически-геморрагического характера, то их отнесли к группе «геморрагических и гематологических нарушений у плода и новорожденного». При этом несколько изменилась классификация внутрижелудочковых кровоизлияний. В МКБ-11 принято выделять 4 степени внутрижелудочковых кровоизлияний, в то время как в МКБ-10 3-я и 4-я степени были объединены.
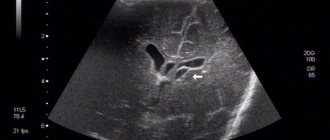
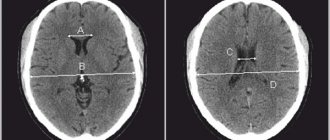
Симптомы тяжелого повреждения ЦНС могут проявляться не сразу после рождения, а спустя несколько часов. При этом клиническая симптоматика не всегда отражает истинную степень тяжести заболевания. В связи с этим особую актуальность приобретает прижизненная оценка изменений, возникающих в клетках нервной ткани в раннем неонатальном периоде. Ультразвуковое исследование (УЗИ) позволяет выявить структурные изменения головного мозга новорожденных при перинатальном гипоксическом поражении ЦНС. Анализ ультразвуковых и патоморфологических данных свидетельствует о том, что характер ишемического поражения головного мозга зависит не только от тяжести перинатальной гипоксии, но и от зрелости ребенка [50]. У доношенных новорожденных ишемия мозга сопровождается возникновением избирательного нейронального некроза, субкортикальной и мультикистозной энцефаломаляциями, инфарктами мозга [51]. Тяжелая перинатальная гипоксия у недоношенных 34—37-й недель гестации, как правило, приводит к развитию перивентрикулярной лейкомаляции. В связи с выхаживанием глубоко недоношенных детей с ЭНМТ при УЗИ стали чаще выявлять такие формы ишемического повреждения, как диффузная лейкомаляция и перивентрикулярный геморрагический инфаркт. Следует отметить, что в первые 24—48 ч дебюта неонатального артериального ишемического инсульта данный метод не обладает достаточной чувствительностью и специфичностью, так как очаг ишемического поражения начинает появляться только на 2—3-и сутки от начала ишемии, что связано с ходом патогистологических процессов. Выраженность воспалительной реакции, интенсивность некроза и апоптоза достигают своего пика через 48—72 ч после нарушения кровообращения [52]. Это приводит к изменению эхогенности поврежденной мозговой паренхимы. Дальнейшая оценка эволюции ишемического очага не уступает по информативности магнитно-резонансной томографии (МРТ) [53, 54]. Повысить чувствительность УЗИ на ранних сроках церебрального повреждения помогает применение ультразвуковой допплерографии. Дуплексное сканирование позволяет объективно оценить гемодинамические характеристики церебральных сосудов. Ценность ультразвуковой допплерографической методики в остром периоде заболевания — выявление фазы вазодилатации, наиболее раннего признака ишемического повреждения, возникающего уже через 30 мин после развития сосудистой катастрофы и сохраняющегося в течение первых 5—6 сут [55]. Вазодилатация развивается в ответ на действие различных метаболитов и способствует увеличению поступления в ишемизированную ткань глюкозы и кислорода. Ее характерными признаками являются повышение скорости кровотока и снижение индексов периферического сопротивления в поврежденном сосудистом бассейне [56, 57]. МРТ стала наиболее информативным методом диагностики перинатальных повреждении головного мозга. Наличие различных импульсных последовательностей обеспечивает высокую чувствительность и специфичность, даже на ранних сроках развития сосудистой катастрофы [58, 59]. МРТ с получением диффузионно-взвешенных изображений и построением карт измеряемого коэффициента диффузии (ИКД) позволяет выявить ишемический очаг уже через 30 мин от момента его возникновения. ИКД служит количественной характеристикой диффузии в ткани и отражает наличие внутриклеточного отека [60]. Представленные диагностические методы необходимы для выявления, определения локализации, степени тяжести повреждения мозга и прогноза. Недостатками их являются короткий временной диагностический интервал и ограниченная возможность повторного исследования [61]. В течение последних 20 лет для прогнозирования исходов церебрального повреждения у новорожденных изучается диагностическая ценность биомаркеров [62, 63]. Учитывая патофизиологические изменения, происходящие в результате повреждения ткани головного мозга, были подробно изучены нейропротеины, кальций-связывающий белок, вазоактивные вещества, маркеры окислительного стресса, медиаторы воспаления и т. д. [64—67]. Однако, несмотря на перспективность изучения биомаркеров, отсутствуют данные о практическом их применении в медицине.
Лечение гипоксических поражений головного мозга является предметом жарких дискуссий и крайних мнений — от полного отказа в необходимости лечения нейротропными препаратами до агрессивной полипрагмазии [26]. Согласно современным воззрениям гипоксически-ишемическая энцефалопатия возникает при асфиксии, как правило, в структуре полиорганных расстройств, поэтому основной принцип терапии заключается в выведении ребенка из асфиксии и поддержании витальных функций [68]. Специфическое лечение гипоксически-ишемической энцефалопатии — терапия отека головного мозга и нейропротекция, которая подразумевает в первую очередь контроль объема цереброспинальной жидкости (ЦСЖ), церебральной перфузии и объема вещества мозга. Церебральная перфузия зависит от артериального притока, венозного оттока и интенсивности метаболизма нервной ткани. На этом этапе большое значение имеет адекватность проводимой искусственной вентиляции легких и эффективность гипотермии. Необходимо отметить, что гипотермия проводится у новорожденных с гестационным возрастом не менее 36 нед при наличии по крайней мере одного из признаков, изложенных в специальных критериях [69]. Контроль объема жидкости в ЦСЖ-путях осуществляется за счет торможения выработки ЦСЖ и улучшения ее оттока. Контроль объема мозга подразумевает усиление активного транспорта и стабилизацию мембран нейронов. Следует отметить, что на данный момент применение лекарственных препаратов в неонатологии ограничено из-за высокого риска развития побочных эффектов и отсутствия доказательной базы. Однако поиск таких препаратов продолжается по настоящее время. В частности, за последние два десятилетия произошли значительные изменения в понимании роли эритропоэтина в качестве нейропротектора. Доказано, что эритропоэтин участвует в нейрогенезе и ангиогенезе во время эмбрионального развития и активируется после травмы головного мозга [70], а также оказывает цитопротективное действие на эндотелиальные, глиальные клетки и нейроны [71]. Впервые нейропротективная роль эритропоэтина была выявлена в нескольких исследованиях in vitro
и
in vivo
[72]. При этом удалось выяснить, что эритропоэтин обладает антиапоптотическим [73], антиоксидантным [74] и противовоспалительным эффектами [75]. Кроме того, он ослабляет эффекты воспаления, снижая реактивный астроцитоз и подавляя активацию микроглии, и уменьшает количество иммунных клеток в месте воспаления [76]. Известно, что отсутствие эндогенного эритропоэтина увеличивало ишемическое повреждение головного мозга и ухудшало выживаемость нейронов [77]. Установленные защитные эффекты эритропоэтина во время ишемии и реперфузии побудили использовать рекомбинантный эритропоэтин у недоношенных детей с церебральной ишемией, внутрижелудочковыми кровоизлияниями и перивентрикулярной лейкомаляцией [78]. Так, в одном из исследований оценивали эффективность и безопасность применения эритропоэтина при неонатальной гипоксически-ишемической энцефалопатии. В данное исследование были включены 167 новорожденных с умеренным и тяжелым церебральным поражением. Всех детей разделили на две группы. Дети первой группы получали стандартную терапию гипоксически-ишемической энцефалопатии, а детям второй группы к стандартной терапии был добавлен эритропоэтин в дозировке 300 и 500 ЕД/кг. Препарат вводили в первые 48 ч через день в течение 2 нед. Оказалось, что летальность и инвалидность на 19,2% чаще встречалась в группе детей, не получавших эритропоэтин [79].
Таким образом, проблема церебрального повреждения ишемического типа у недоношенных новорожденных является весьма актуальной. Прежде всего это подтверждается высокой частотой встречаемости данной патологии и большим риском летального исхода и инвалидизации детей. Остается открытым вопрос комплексной диагностики церебральных нарушений у недоношенных детей, потому как не существует единого алгоритма, объединяющего данные клинической картины, инструментальных и лабораторных методов исследования. Большой интерес представляет поиск предикторов неблагоприятного исхода с целью оптимизации лечебных подходов.
Авторы заявляют
оботсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Анурьев А.М. — https://orcid.org/0000-0002-6724-5067; e-mail
Горбачев В.И. — https://orcid.org/0000-0001-6278-9332
Как цитировать:
Анурьев А.М., Горбачев В.И. Гипоксически-ишемические поражения головного мозга у недоношенных новорожденных. Журнал неврологии и психиатрии им. С.С. Корсакова.
2019;119(8 вып. 2):63-69. https://doi.org/10.17116/jnevro201911908263
Автор, ответственный за переписку:
— Анурьев Алексей Михайлович — e-mail
Причины
В подавляющем большинстве случаев причины церебральной ишемии у новорожденных заключаются в различных нарушениях вынашивания плода в последние недели, а также в нестандартных ситуациях при родах.
- Отслоение плаценты или нарушение кровотока в ней.
- Пережатие пуповины, удушье плода.
- Врожденные пороки сердца.
- Проблемы кровообращения.
- Внутриутробная гипоксия.
- Занесение инфекции при родах.
- Открытость артериального протока.
- Острая плацентарная недостаточность.
Этиология
Причины проблем с сердцем у детей условно делятся на крупные подгруппы. Разберем каждую отдельно.
Со стороны матери
Если во время беременности женщина переболела краснухой, системной красной волчанкой, сифилисом, токсоплазмозом, если у нее есть сахарный диабет или другие хронические заболевания, то всё это отражается на плоде.
Список разрешенных препаратов для беременных строго ограничен, большинство антибиотиков, варфарин и другие лекарственные вещества (их называют тератогенными) слишком токсичны для плода. Их прием повышает риск самопроизвольного аборта (выкидыша) или различных аномалий развития ребенка.
Прием алкоголя, курение и употребление наркотиков беременными также приводит к врожденным патологиям у детей.
Генетические нарушения
Чаще всего это хромосомные аномалии. Но генетическая предрасположенность и мутации не рассматриваются как единственная причина кардиологических патологий. В 90% случаев причина проблем с сердцем – мультифакторная.
Вредные привычки
Про то, как состояние организма матери влияет на детей, мы уже поговорили. Но факторы риска развития проблем с сердцем у детей аналогичны таковым у взрослых:
- Курение;
- Алкоголь;
- Малоподвижный образ жизни;
- Наркотические вещества;
- Стресс;
- Инфекции;
- Высокий уровень холестерина.
Этот список актуален скорее для подростков 14-17 лет, чем малышам. Однако надо понимать, что никотин и продукты метаболизма этанола разрушают миокард и сосудистую стенку у ребенка точно так же, как и у взрослого. «Баловство» за гаражами может обернуться инфарктом в 30 лет.
Статистика показывает, что за последнее десятилетие возрос процент детей с избыточной массой тела, что тоже негативно влияет на сердце. Инфаркт миокарда в связи с ожирением и другими факторами риска «помолодел» и уже встречается у девушек и юношей 20-30 лет, что ещё в 2000-ых годах считалось казуистикой.
Факторы риска
Различные сосудистые и неврологические патологии, проблемы с артериальным давлением (особенно наследственные) у матери должны насторожить врача, который ведет беременность. Также факторами риска возникновения у ребенка церебральной ишемии являются:
- возраст матери более 35 лет;
- эндокринные заболевания;
- преждевременные, затяжные роды;
- многоплодная беременность;
- поздний токсикоз;
- несоблюдение матерью здорового образа жизни;
- обострение хронических или острые заболевания у матери при вынашивании плода.
Почему возникает
Гипоксические проявления наблюдаются в случае, если женщина беременна либо при родах. Кислородное голодание провоцируется обстоятельствами:
- Наличие инфекций в организме беременной, дисфункции сердечно-сосудистой, эндокринной систем, ОРЗ.
- При употреблении алкогольных напитков, курении.
- При позднем токсикозе, уменьшенном объёме околоплодных вод, беременности более одного плода, поздней родовой деятельности.
- Плацентарной и пуповинной патологии.
- Если ребёнок недоношенный.
- При трудных родах, заключающихся в том, что малыш обвит пуповиной, роды продолжаются больше положенных сроков по причине большого плода, травмы во время родов и другие проблемы родовой деятельности.
- Маме ребёнка больше 34 лет или меньше 18.
Все эти факторы нарушают ток крови между плацентой и маткой, что проявляется гипоксическим состоянием.
Диагностика
В основном заболевание диагностируют в течение первых нескольких часов.
О наличии патологии свидетельствуют отклонения при проверке рефлексов, общем анализе крови. Обычно анализ показывает повышенное содержание в организме углекислого газа.
При обнаружении явных симптомов тяжелого заболевания проводят магнитно-резонансную томографию, а также электроэнцефалографию, выявляющие скрытые судороги и др. отклонения в работе головного мозга.
Диагностические критерии
Первоначальная диагностика заключается в осмотре ребенка, и оценке его состояния по шкале Апгар.
Определение ph венозной крови для выявления ацидоза
Обследования новорождённого включает следующие исследования:
- Анализ крови (сниженная концентрация кислорода).
- Нейро-санография.
- Компьютерная томография.
- Магнито-резонансная томография.
- Допплер-энцефалограмма.
Церебральная ишемия 2 степени
Опасная форма заболевания. Для нее характерны:
- выраженные апноэ (остановки дыхания во сне);
- снижение хватательных, сосательных рефлексов;
- слабый мышечный тонус;
- увеличение формы головы за счет скопления жидкости;
- нарушение координации;
- потери сознания;
- изменения цвета кожи.
Чаще всего ишемия 2 степени проявляет себя в первые сутки жизни новорожденного, а симптомы могут наблюдаться в течение 2-4 недель. В это время за ребенком тщательно наблюдают врачи, он проходит курс терапии. При необходимости проводят хирургическую операцию по удалению тромба.
Профилактика ишемии
Нужно заблаговременно говориться к беременности. Подготовку начинают за пол года, в крайнем случае за 3 месяца до зачатия. И готовиться должна не только будущая мама, но и отец ребенка. При гестации женщина должна вовремя проходить все осмотры, особенно в первом триместре. Сдаются анализы и проводится ультразвуковая диагностика.
До беременности и во время нее женщину обследуют на инфекции. Как известно, после зачатия латентные инфекции могут обостриться и проявиться. Маме нужно отказаться от курения, алкоголя, наркотиков и других привычек, вредящих ей и малышу. Особенно негативно влияет курение на процесс поступления кислорода к плоду. Если врач обнаружил осложнения беременности, женщине важно вовремя лечь на сохранение.
Церебральная ишемия 3 степени
Наиболее тяжелая форма, при которой:
- у младенца отсутствуют рефлексы;
- ребенок впадает в кому;
- нарушается ритм сердца;
- резко повышается артериальное давление;
- возникают проблемы с самостоятельным дыханием;
- наблюдается косоглазие.
Опытный врач уже в первые 5 минут жизни новорожденного может определить наличие признаков и симптомов церебральной ишемии 3 степени. В этом случае ребенка отправляют в реанимацию, при необходимости подключают к аппарату искусственной вентиляции легких.
Результаты гипоксии
Нехватка кислорода для мозга может иметь такие результаты:
- Тяжелая церебральная ишемия
Это состояние в четверти-половине случаев приводит к летальному исходу. Малыши не проживают и нескольких дней. Другой вариант развития событий — пневмония или другая инфекция, которая убивает ребенка чуть позже. Большинство тех, кто не умер, получают диагноз аутизма, ДЦП или слабоумия. И только у 10% выживших не отмечается последствий.
- Средняя ишемия
Тяжелые отдаленные последствия, согласно статистике, имеют от 30 до 50% малышей.
- Ишемия легкой степени
Исход в большинстве случаев благополучный, инвалидизации не отмечается.
Лечение церебральной ишемии у новорожденных
Цель лечения – восстановить нормальное кровообращение в тканях головного мозга, не допустить патологических изменений и устранить последствия ишемии. Для болезни 1-й степени лечение обычно заключается в назначении массажа для улучшения кровообращения.
При заболеваниях 2-ой и 3-ей степени применяют медикаментозную терапию и хирургическое вмешательство для удаления тромба в сосуде и восстановления структуры сосудистого русла. В сложных случаях младенец проходит восстановительный курс интенсивной терапии.
Особенности патологии у доношенных и недоношенных младенцев
Характер поражения анатомических структур мозга при гипоксии или асфиксии, зависит от гестационного срока. Так, при рождении недоношенного младенца существует риск формирования перивентрикулярной лейкомаляции. При данном заболевании происходит поражение белого вещества с дальнейшим образованием очагов некроза. Патологии подвержены дети, родившиеся на сроке раньше 31 акушерской недели.
У доношенных детей поражению преимущественно подвергается серое вещество. Степень осложнений зависит от масштабов нарушения и анатомического расположения нейронов. В случае тяжелой остро развивающейся гипоксии патологические изменения наблюдаются в области ствола головного мозга, координирующего работу сердца и дыхания. Отклонения могут вызвать грозные последствия и нанести непоправимый вред здоровью малыша.
Прогноз и последствия церебральной ишемии
Гораздо эффективнее ликвидировать саму ишемию после рождения младенца, нежели лечить ее осложнения. Среди последствий церебральной ишемии 2 степени:
- нарушения сна;
- головные боли;
- раздражительность;
- замкнутость;
- гиподинамия.
- Заболевание 3 степени имеет сложнейшие последствия:
- ДЦП;
- синдром дефицита внимания;
- умственная отсталость;
- симптом Грефе и др.
Если же все действия по устранению ишемии были проведены врачами своевременно, то симптомы проходят в течение реабилитационного периода, длящегося обычно 6-12 месяцев.
Симптомы
Ребенок, у которого есть проблемы с сердцем, может жаловаться на:
- Боли в груди (в области сердца, возможна иррадиация в руку, подреберье, в подмышечную впадину);
- Одышку;
- Учащенное сердцебиение или ощутимые паузы;
- Перебои в работе сердца;
- Головокружение;
- Потемнение в глазах и обмороки;
- Бледность или цианоз (синюшная окраска кожи и слизистых оболочек);
- Ускорение пульса или его различие на руках;
- Плохой аппетит и низкий рост;
- Частые респираторные инфекции;
- Набухание и пульсация сосудов шеи;
- Высокое или низкое артериальное давление;
- Деформация грудной клетки и др.
Симптомы обычно возникают или усиливаются после физических нагрузок. Первое время ребенок обычно не придает этому значение, затем его выносливость начнет страдать, а состояние ухудшается, что и становится причиной обращения к кардиологу.
Самодиагностика
Для самостоятельной диагностики состояния сердечно-сосудистой системы проводят функциональные пробы: Мартине-Кушелевского, Котова-Дешина, Руфье, с 15-секундным бегом в максимально быстром темпе и другие. Ознакомиться с методикой проведения проб можно в соответствующих статьях в Интернете.
Это простые тесты для приблизительной оценки адаптации сердца и сосудов к нагрузкам. В школах и университетах их проводят в специальных медицинских группах по физкультуре для контроля самочувствия и натренированности обучающихся.
Осложнения
При наличии кардиологических проблем наблюдение врача всегда необходимо. У самых маленьких пациентов патология может сама исчезнуть, но это редкая картина. Подростков в пубертатный период часто беспокоит аритмия или тахикардия (увеличение частоты сердечных сокращений) – такова плата за гормональные перестройки, в большинстве случаев всё нормализуется самостоятельно.
Несмотря на наличие счастливых исходов, если у ребенка есть жалобы со стороны сердца, следует срочно обратиться к кардиологу.
В противном случае могут возникнуть осложнения:
- Вторичная артериальная гипертензия (по большому и/или малому кругу кровообращения);
- Разрушение клапанов и адаптационные перестройки сердца (дилатация или гипертрофия;
- Нарушение кровообращения (страдают другие органы, возникает ишемия – недостаточное поступление кислорода в ткани);
- Инфаркт;
- Пневмонии;
- Сердечная недостаточность.
Летальный исход – частый результат патологий сердца, особенно при врожденных пороках.
Онлайн консультация Врача-педиатра
стоимость консультации: 500 рублей
Консультация онлайн
В рамках консультации вы сможете озвучить свою проблему, врач уточнит ситуацию, расшифрует анализы, ответит на ваши вопросы и даст необходимые рекомендации.