Кортикальная атрофия головного мозга – это разрушительные необратимые изменения, которым чаще всего подвержены люди от 50 до 55 лет, хотя есть случаи кортикальной атрофии и у новорожденных младенцев. Патологические нарушения, как правило, проявляются в лобных долях головного мозга, которые отвечают за процесс мышления, поведение человека, контроль. Болезнь протекает медленно с постепенным нарастанием основных симптомов, что в конце концов приводит к возникновению и развитию старческого слабоумия.
Причины возникновения заболевания
Основным фактором, который приводит к появлению атрофии мозга в 95 % случаев, является генетическая предрасположенность. С возрастом происходит уменьшение объема и массы головного мозга. Больше всего эта патология проявляется у женщин старшего возраста. Усугубить ситуацию могут провоцирующие внешние факторы. Мутации в хромосомах, инфекционные процессы во время вынашивания ребенка способны привести к возникновению врожденной атрофии головного мозга у новорожденного. К основным причинам развития заболевания можно отнести:
- Наследственную предрасположенность.
- Болезни матери, которые передаются плоду через плаценту, травмы при родах, гипоксию.
- Плохое кровоснабжение головного мозга кровью в связи с изменениями в сосудах и уменьшением их пропускной способности.
- Недостаточную умственную нагрузку, в результате чего мозг атрофируется.
- Влияние алкоголя, наркотических и лекарственных веществ, что пагубно действует на кору и подкорковые образования мозга. Радиационное облучение.
- Хроническую анемию, которая приводит к недостаточному насыщению клеток мозга кислородом, что в итоге влечет возникновение ишемии и атрофии.
- Травмы, в том числе полученные в результате нейрохирургического вмешательства, приводят к передавливанию сосудов, которые оказывают влияние на ткани мозга, что может вызвать развитие атрофии. Медленное развитие новообразований, которые также пережимают сосуды.
- Острые и хронические инфекционные заболевания головного мозга.
К факторам, которые способствуют развитию патологии, можно отнести: чрезмерное курение, хроническую артериальную гипотензию, применение сосудосуживающих препаратов, хронический алкоголизм.
Важно обратить внимание, что кортикальная атрофия головного мозга – это изменения в нервной ткани головного мозга уже после его нормального формирования. Первичную недоразвитость центральной нервной системы во время внутриутробного развития нельзя считать атрофией.
Развитие патологии в коре головного мозга у людей в преклонном возрасте очень часто зависит от уровня их умственной нагрузки в молодости. Люди, которые много думают, заняты интеллектуальной работой, менее подвержены риску развития старческого слабоумия.
Признаки атрофии головного мозга
Патология может быть первичной и вторичной. Классификация обусловлена причинами развития заболевания. При первичной атрофии выявляют аномалии головного мозга и генетические нарушения. Отклонения могут манифестировать в любом возрасте, часто быстро прогрессируют, сложно поддаются коррекции.
Левосторонняя инволюция ткани головного мозга
Вторичная атрофия связана с воздействием внешних и внутренних неблагоприятных факторов. Инволюция нервной ткани может быть следствием черепно-мозговых травм, патологий сосудов, метаболических нарушений, вредных привычек, воздействия радиации и т.д. В данном случае устранение причины может способствовать замедлению развития заболевания. Правильная медикаментозная терапия способна обеспечить стабильное удовлетворительное состояние и качество жизни пациента на долгие годы.
Клинические проявления атрофии включают расстройства высшей нервной деятельности, нарушения синхронизации функций различных частей организма.
Симптомами заболевания могут быть:
- проблемы со скелетной мускулатурой (от снижения тонуса до полной утраты способности двигаться);
- головокружения;
- судороги;
- снижение слуха и зрения вплоть до полной утраты;
- речевые нарушения (от обеднения словарного запаса до невозможности изъясняться);
- галлюцинации;
- снижение или утрата обоняния;
- изменение чувствительности разных частей тела;
- нарушение координации движений;
- потеря пространственной ориентации;
- изменение поведения (от раздражительности до паранойи);
- эмоциональная нестабильность (от чрезмерного возбуждения до полной аутизации).
Проблема диагностики атрофии головного мозга заключается в отсутствии или слабом проявлении симптомов на ранних этапах развития заболевания. Выделяют следующие стадии патологии:
- Первая. Органические изменения в мозге минимальны, но уже присутствует слабая неврологическая симптоматика. Отмечают снижение способности к концентрации внимания, расстройство памяти, эмоциональную лабильность.
- Вторая. Появляются нарушения слуха, зрения, речи. Существенно меняется поведение человека, возможны нелогичные поступки, которые сам больной не может объяснить или сразу забывает.
- Третья. Личностная деградация достигает апогея. Больной теряет способность обслуживать себя самостоятельно, переходит в полную зависимость от окружающих. В таком состоянии человек может прожить несколько лет. Смерть наступает в результате разрушения центров по контролю жизненно-важных функций.
Клинические проявления и диагностика заболевания
Симптомы кортикальной атрофии головного мозга напрямую зависят от степени, участка поражения и распространенности патологии. Кортикальная церебральная атрофия имеет пять стадий развития разрушительного процесса со своими характерными особенностями. Важно также учитывать, где именно происходят пагубные изменения – в коре или в подкорковых зонах. От этого зависят первые проявления основных признаков заболевания. В зависимости от возраста, внешних факторов патологические изменения могут развиваться быстрее. Заболевание имеет такие стадии развития:
- Кортикальная церебральная атрофия 1 степени, как правило, протекает без каких-либо симптомов. Время от времени болит голова, появляется слабость, головокружения. Эта стадия заболевания очень быстро развивается и переходит в следующую.
- Вторая стадия патологии характеризируется тем, что человек становится раздражительным, не может спокойно воспринимать критику, конфликтует с окружением, при этом легко теряя нить общения. Ухудшается память, может меняться почерк, забываются старые привычки и приобретаются новые. На второй стадии развития атрофии можно заметить нарушение в координации движений, изменения в походке. Больной может начать копировать других людей, так как утрачивается его самостоятельность в мышлении и движениях. Вторая стадия должна насторожить близких и родных и подвигнуть их обратиться за помощью к специалисту.
- Потеря контроля над поведением, резкие вспышки гнева, уныние – характерные особенности третьей стадии разрушительного процесса. Утрачиваются элементарные навыки ухаживания за собой.
- На последних стадиях заболевания человек неадекватно реагирует на окружающий мир, теряет осознание происходящего, не проявляет никаких эмоций.
Человек на последней стадии патологии часто является опасным для общества, в связи с чем таких людей могут изолировать в психиатрическую или неврологическую клинику. Самой известной патологией коры головного мозга является биполушарная кортикальная атрофия (разрушительные изменения происходят сразу в обоих полушариях). Это заболевание более известно как болезнь Альцгеймера. Еще одной разновидностью атрофических заболеваний тканей головного мозга является болезнь Пика, при которой наблюдается истончение коры головного мозга. К ее основным симптомам можно отнести: неумение сосредоточиться, повышенную отвлекаемость, обжорство, гиперсексуальность. Патология развивается медленно, но уверенно прогрессирует. В отличие от болезни Альцгеймера, выявленная в начале своего развития болезнь Пика поддается лечению.
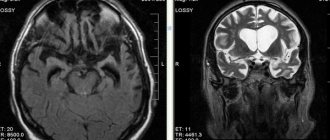
Диагностировать патологические изменения в коре головного мозга, его степень поражения можно с помощью дополнительных исследований, а также компьютерной или магнитно-резонансной терапии, показаниями к которой являются основные симптомы возможной болезни. Также проводится допплерография сосудов шеи и мозга, когнитивные тесты (для определения стадии патологии). Для выявления новообразований, очагов со структурными изменениями пациент проходит рентгенологические обследования. Наиболее точным способом диагностирования на сегодня является магнитно-резонансная терапия, которая позволяет не только выявить патологические изменения мозговой ткани на ранних стадиях заболевания, но и следить за ними в динамике.
До недавнего времени рассеянный склероз (РС) традиционно расценивался как первично демиелинизирующее заболевание. Однако в настоящее время общепринятым является мнение, что в его патогенезе участвуют как иммуно-воспалительные, так и нейродегенеративные компоненты, при этом именно баланс между активностью воспаления, прогрессирующей дегенерацией и репаративными механизмами и определяет клинические проявления РС на каждом конкретном этапе [1].
«Золотым стандартом» диагностики РС является магнитно-резонансная томография (МРТ). Однако если стандартные методики МРТ незаменимы в аспекте подтверждения характера, определения активности патологического процесса и мониторирования течения болезни, то в отношении корреляций между клиническими симптомами и нейровизуализационными параметрами их возможности крайне ограничены (так называемый клинико-радиологический парадокс). Обсуждаются различные причины этого феномена, включая особенности клинической оценки, отсутствие гистопатологической специфичности (особенно для аксональной гибели), недостаточное внимание к вовлечению спинного мозга, недооценка повреждения внешне не измененного вещества мозга — как белого (БВ), так и серого (СВ), а также маскирующие эффекты корковой адаптации [2]. На современном этапе МРТ-исследования осуществляются с использованием новых методик (МР-спектроскопия, функциональная МРТ, МРТ-морфометрия, SWI, DIR, MTC), которые направлены на уточнение патогенеза, патофизиологических механизмов формирования неврологического дефицита, разработку эффективных прогностических критериев и новых маркеров мониторирования течения не только иммуновоспалительного, но и нейродегенеративного, атрофического компонента [3].
Первоначально наличие атрофии головного мозга у пациентов с РС выявлялось качественно: описывалось расширение желудочков мозга и субарахноидальных пространств и уменьшение объема вещества мозга [4]. Следующим этапом явилась полуавтоматическая количественная оценка атрофии головного мозга без дифференцировки на СВ и БВ. В настоящее время в исследованиях используются различные МРТ-измерения для оценки как глобальной (головной мозг в целом), так и региональной атрофии. Одним из наиболее часто применяемых методов является оценка фракции паренхимы мозга (BPF), которая определяется соотношением вещества головного мозга к сумме вещества головного мозга и цереброспинальной жидкости (ЦСЖ). Достоинством этого метода является полностью автоматический подсчет объемов и возможность индивидуальной оценки параметров в каждом конкретном случае, но при этом сложно проводить продолженные исследования. Также широко используется измерение толщины коры головного мозга — применяется автоматизированная методика, которая включает этапы СВ и БВ и регистрации не объема как при морфометрии, а именно толщины коры, но ее недостатком является трудность в получении четких границ СВ из-за неоднородного магнитного поля.
Детальная количественная оценка стала возможной после внедрения воксельной МРТ-морфометрии — метода статистического анализа структурных МРТ-изображений с использованием компьютеризированной сегментации вещества мозга на СВ и БВ. Данные об этой методике впервые были опубликованы в 2000 г. [5]. Воксельная МРТ-морфометрия требует обработки данных, получаемых при проведении МРТ-исследования в режиме Т1-взвешенных изображений (ВИ) с толщиной среза 1 мм. Этот препроцессинг включает нормализацию, сегментацию и сглаживание [6]. Процесс нормализации заключается в межсубъектном сравнении объема мозга и приведении его к одному стереотаксическому пространству. Путем сегментации производится разделение основных мозговых и внемозговых структур (СВ, БВ и ЦСЖ). С помощью сглаживания достигается устранение особенностей СВ каждого отдельного индивидуума, что необходимо для дальнейшего группового анализа. МРТ-морфометрия используется не только для вычисления объемов СВ и БВ в целом, но и отдельных зон интереса при применении так называемых масок для каждой определенной области головного мозга. При морфометрии большое значение отводится выбору специальных приложений для персонального компьютера, с помощью которых производят обработку полученных МРТ-данных. Использование таких программ позволяет точно оценивать структуры головного мозга и избегать ошибок оператора. Существует несколько разновидностей таких программ, например статистическое параметрическое картирование (statistical parametric mapping — SPM) [7].
Обсуждая атрофию центральной нервной системы (ЦНС) и данные МРТ-морфометрии при РС, необходимо упомянуть, что помимо постепенно нарастающей потери вещества мозга при РС могут отмечаться и краткосрочные колебания объема. Так, воспаление и отек в результате формирования новых очагов приводят к временному увеличению объема мозга, и наоборот, прием кортикостероидов ведет к кратковременному его уменьшению — псевдоатрофии [8]. Механизм данного процесса не совсем ясен, но считается, что это происходит в результате уменьшения воспаления в ЦНС и связанного с ним отека.
Атрофия головного мозга начинается на самых ранних стадиях заболевания и развивается как при ремиттирующем, так и прогрессирующем типах течения РС. Причем у всех пациентов с РС (без разделения на типы течения) объем мозга уменьшается в среднем на 0,5-1,3% в год, что втрое превышает нормальное старение мозга (0,1-0,4%) [9]. Показана связь степени атрофии с типом течения, стадией заболевания, генетическими и токсическими факторами. Было выявлено, что у пациентов с различными типами течения РС и клинически изолированным синдромом (КИС) снижение объема головного мозга в целом на 5,7% больше по сравнению с контролем, причем у пациентов с вторично-прогрессирующим типом течения РС (ВПРС) оно значительно выше, чем при ремиттирующем РС (РРС).
У пациентов с аполипопротеином Е-е4 в генотипе ежегодное уменьшение объема мозга в 4 раза выше, чем у пациентов с его отсутствием. Однако согласно другим исследованиям, генотип с наличием аполипопротеина Е-е4 не влияет на степень атрофии [10]. Подверженность токсическому воздействию, например табачному дыму, также повышает степень атрофии.
В настоящее время доказано, что атрофические процессы в ЦНС при РС обусловлены не только потерей миелина, но и нейродегенеративным процессом с потерей аксонов, нейронов, что отражается в уменьшении объема коры и подкорковых структур. В связи с этим при оценке атрофического процесса у больных РС с помощью метода воксельной морфометрии выделяются следующие составляющие: атрофия БВ, коры головного мозга и подкорковых структур.
Атрофия БВ
Изначально при РС именно воспалительной демиелинизации БВ отдавалось ключевое значение и поэтому считалось, что именно оно подвергается атрофическим изменениям. Однако повреждение аксонов в рамках поражения БВ ведет к атрофии, которая, вероятнее всего, развивается двумя путями: потеря вещества в самих очагах демиелинизации и дальнейшая валлеровская дегенерация путей, связанных с очагом поражения. Атрофия БВ затрагивает определенные зоны головного мозга, включая оба полушария большого мозга, ствол мозга и мозжечок. У пациентов с РРС по сравнению с группой контроля наиболее выражена атрофия практически всех отделов БВ: мозолистого тела, поясных извилин с обеих сторон, некоторых отделов лобных долей (включая верхние отделы лучистого венца и верхние продольные пучки), височных и затылочных долей (свод, нижние и верхние продольные пучки, нижние лобно-затылочные тракты). У пациентов с РРС атрофия БВ (в отличие от атрофии СВ) также выражена в стволе мозга и мозжечке и в основном поражает кортико-спинальные тракты, верхние мозжечковые ножки (преимущественно правую), оба полушария мозжечка, дорсальные отделы варолиева моста и ростральные отделы продолговатого мозга [11, 12]. В некоторых исследованиях показано, что атрофия БВ менее заметна по сравнению с атрофией СВ из-за более выраженных воспалительных процессов, которые могут маскировать атрофию [13, 14].
Согласно результатам некоторых исследований, существует связь между степенью очагового повреждения БВ и общим объемом головного мозга, а также с атрофией коры и подкорковых структур [12]. Причем была выявлена связь с очагами, визуализируемыми в режиме Т2-ВИ, более низкая степень корреляции отмечалась с очагами в Т1-ВИ и полное ее отсутствие — с очагами, накапливающими контрастное вещество [15]. При проведении корреляций между количеством и локализацией очагов в Т2-ВИ и атрофией СВ были получены следующие результаты: у пациентов с РРС общий объем очагов в Т2-ВИ коррелировал с атрофией таламуса; у пациентов с доброкачественным типом течения РС (ДТРС) — с атрофией таламуса, тел хвостатых ядер и правой скорлупы; у пациентов с ВПРС объем очагов коррелировал с атрофией таламуса, хвостатых ядер, левой нижней теменной дольки, парагиппокампальных извилин и верхних и нижних холмиков. Также было выявлено, что у пациентов с ВПРС и первично-прогрессирующим типом течения РС (ППРС) атрофия коры соответствовала количеству очагов в соответствующих долях или каудальнее расположенных отделах БВ, а степень атрофии подкорковых структур коррелировала с количеством очагов во всех долях обоих полушарий большого мозга.
Однако согласно другим работам, соотношение между степенью очагового повреждения БВ и атрофией СВ довольно незначительна, так как к уменьшению его объема ведут и другие процессы.
Атрофия коры головного мозга
Проведены исследования как с измерением объема СВ, так и с оценкой истончения коры головного мозга. Согласно проведенным исследованиям in vivo, именно потеря СВ ускоряется по мере прогрессирования заболевания. Например, в исследовании E. Fisher и соавт. [16] у пациентов с переходом КИС в РРС было обнаружено 3,4-кратное увеличение степени атрофии СВ, а у пациентов с трансформацией РРС в ВПРС — 14-кратное увеличение. Однако до сих пор нет однозначного мнения, является ли атрофия СВ более значимой в развитии прогрессирования РС по сравнению с атрофией БВ.
У пациентов с РС (без разделения по типам течения) отмечается диффузная и локальная атрофия коры головного мозга. Средняя толщина коры у пациентов с РС составляет 2,3 мм по сравнению с 2,48 мм у здоровых людей. Выявляется преимущественная атрофия коры лобных (2,37 мм по сравнению с 2,73 мм в группе контроля) и теменных долей (2,65 по сравнению с 2,95 мм) даже на ранних стадиях заболевания. У пациентов с большой длительностью заболевания преимущественно атрофируется моторная кора (2,35 мм по сравнению с 2,74 мм в норме) [12].
В ходе метаанализа у пациентов с различными типами течения РС, без разделения на группы, была выявлена преимущественная атрофия коры пре- и постцентральных извилин (более выраженная в левом полушарии), левой средней лобной извилины, нижней теменной дольки правого полушария большого мозга, поясных извилин, преимущественно правой задней поясной и левой парагиппокампальной извилин [17].
Атрофия подкоркового СВ
Согласно последним данным, атрофия таламуса развивается раньше, чем атрофия коры, что было продемонстрировано в исследовании пациентов с РРС и ППРС при динамическом наблюдении [18, 19]. Атрофия таламуса отмечается при всех типах течения РС, в наибольшей степени при ВПРС, что, вероятно, связано с длительностью заболевания.
В работе A. Cifelli и соавт. [20] было показано, что по сравнению с группой контроля у пациентов с ВПРС объем таламуса уменьшился на 17%, а поперечный размер III желудочка возрос вдвое, причем была выявлена четкая обратно пропорциональная зависимость между их объемами. Вышеописанные МРТ-данные подтверждаются гистологическими исследованиями: выявлено сокращение числа нейронов в медиальном заднем таламическом ядре и уменьшение общего объема таламуса в среднем на 22%. В целом потеря нейронов головного мозга оценивалась в 30-35%. Сходные данные были получены у пациентов с РРС в ходе оценки концентрации N-ацетиласпартата (NAA) в таламусе, и именно его снижение коррелировало с атрофией таламуса и продолжительностью заболевания.
В ходе вышеупомянутого метаанализа у пациентов с РРС и КИС зона наибольшей атрофии была в правом таламусе, а также отмечалось билатеральное вовлечение подкорковых структур, включая левый таламус.
Согласно одним данным [21, 22], у пациентов с КИС не обнаруживалось зон значительного снижения объема СВ, в частности таламуса, по сравнению с контролем. Однако, согласно другим исследованиям с использованием воксельной МРТ-морфометрии [23, 24] и режима Т1-ВИ с применением импульса переноса намагниченности, отмечалась атрофия таламуса [25]. Расхождение данных может быть связано с тем, что режим Т1-ВИ с применением импульса переноса намагниченности обладает большей чувствительностью по отношению к изменениям СВ, которые предшествуют атрофии. Противоречивые результаты вышеописанных исследований могли быть получены также из-за различных методик, которые применялись для измерения атрофии. По данным метаанализа было выявлено, что у пациентов с РРС и КИС правый таламус является наиболее пораженной зоной. Когда из списка всех работ исключили исследования, в которых принимали участие пациенты с КИС, было выявлено незначительное изменение паттернов распределения атрофии СВ. Пик атрофии при этом сместился в левый таламус.
У пациентов с ВПРС по сравнению с РРС наблюдалось значительное снижение объема некоторых подкорковых структур (таламус, хвостатые ядра), верхних и нижних холмиков крыши четверохолмия. По сравнению с пациентами с ППРС, при ВПРС отмечалась более выраженная атрофия таламуса с обеих сторон и верхних, и нижних холмиков. При этом у пациентов с ППРС по отношению к ВПРС не было выявлено зон большей атрофии.
Выраженная атрофия таламуса при РС может иметь несколько механизмов: во-первых, из-за воспалительных изменений в самом таламусе и прямого нейродегенеративного процесса, а во-вторых, в результате непрямого поражения СВ (таламус является так называемым барометром диффузного нейродегенеративного процесса при РС, так как благодаря хорошо развитым реципрокным связям с корой и подкорковым СВ таламус чувствителен к их повреждению) [26]. Также наличие более выраженной атрофии подкорковых структур по сравнению с корой головного мозга, особенно у пациентов с КИС, говорит о вероятной атрофии глубоких отделов СВ в результате повреждения аксонов, нежели прямого воздействия [27]. Это также подтверждается тем, что при поражении зрительной лучистости отмечается атрофия латерального коленчатого тела [28].
Паттерны атрофии головного мозга при различных типах течения РС
При оценке глобальной атрофии головного мозга при прогрессирующих типах течения РС выявлено одновременное расширение желудочков мозга и субарахноидального пространства, тогда как при РРС в большей мере определяется расширение желудочковой системы головного мозга, преимущественно тел, передних и задних рогов боковых желудочков и III желудочка, что говорит об атрофии подкорковых структур [29]. Что касается атрофии коры головного мозга у пациентов с РРС по сравнению с больными с КИС и группой контроля, то была отмечена значительная атрофия правых пре- и постцентральных извилин при отсутствии выраженных изменений БВ. При ВПРС по сравнению с РРС выявлена наибольшая атрофия как БВ, так и СВ: коры всех долей больших полушарий мозга (преимущественно верхних лобных, постцентральных извилин, правых верхней и нижней теменных долек, парагиппокампальных извилин, клина в обоих полушариях, левой средней затылочной извилины), передних долек мозжечка, верхних и нижних холмиков и подкорковых структур [30]. По сравнению с ППРС при ВПРС отмечена атрофия коры постцентральных извилин (в основном — левой), средних затылочных извилин, левого клина, таламуса, передних долек мозжечка и холмиков крыши четверохолмия.
Отдельного внимания заслуживает ДТРС. Этот диагноз ставится ретроспективно при длительности заболевания 10 и более лет от дебюта РС при незначительной степени инвалидизации (не более 3 баллов по шкале EDSS). Согласно исследованию S. Mesaros и соавт. [31], у пациентов с ДТРС по сравнению с группой контроля не было выявлено изменений объема головного мозга в целом, но при этом отмечалось локальное снижение объема СВ: преимущественно подкорковых структур и в меньшей степени — коры лобной и теменной долей левого полушария большого мозга. У части пациентов были выраженные когнитивные нарушения. При сравнении пациентов с ВПРС и пациентов с ДТРС с когнитивным дефицитом не было выявлено различий в изменении объема структур головного мозга, тогда как при сравнении пациентов с ВПРС и пациентов с ДТРС без когнитивных изменений, у первых отмечалась выраженная атрофия коры мозжечка. Данные результаты подтверждают, что необратимое повреждение мозжечка может играть значительную роль в развитии двигательных нарушений [32, 33].
Атрофия спинного мозга
Клиническая картина РС чрезвычайно гетерогенна, а симптоматика, которая возникает в результате повреждения спинного мозга (СпМ), часто доминирует и на определенном этапе отмечается у 90% больных [34]. В СпМ выявляются как локальные, так и диффузные очаги демиелинизации. У пациентов с КИС и ДТРС количество очагов меньше, чем при РРС, ВПРС и ППРС, что, вероятно, обусловливает и более легкое течение заболевания. При этом в исследованиях показано [35, 36] отсутствие корреляции между количеством очагов, выявляющихся в режиме Т2-ВИ, и атрофией, что говорит об их небольшой роли в развитии атрофии СпМ.
Атрофические изменения наиболее часто выявляются в шейном отделе СпМ, причем в большей степени у пациентов с прогрессирующим типом течения РС. Существует связь между степенью атрофии СпМ и тяжестью клинической симптоматики [37, 38]. Учитывая небольшой размер СпМ и строение окружающих тканей, измерять его объем довольно сложно. Однако с применением МРТ-морфометрии это стало возможным. Выраженная атрофия СпМ отмечается у пациентов с ВПРС, ППРС и даже при ДТРС [34]. Это подтверждает то, что атрофия развивается при прогрессирующем и длительно текущем заболевании. При данных типах течения РС отмечается одинаковое уменьшение объема на всем протяжении шейного отдела СпМ, при этом на каждом отдельном уровне оно больше выражено в задних и латеральных отделах его поперечника. Это подтверждается также и с помощью других методов и режима Т1-ВИ с применением импульса переноса намагниченности. У пациентов с ДТРС отмечается меньшая степень атрофии в целом по сравнению с пациентами с ВПРС, что говорит о том, что чем меньше выражены дегенеративные процессы, тем доброкачественнее протекает РС. Это также подтверждается наличием корреляций между выраженностью атрофии СпМ при ППРС и ВПРС и степенью нетрудоспособности по функциональной шкале EDSS.
При ППРС наблюдается выраженная атрофия СпМ, особенно задних его отделов, по сравнению с пациентами с КИС, РРС и группой контроля, несмотря на небольшую длительность заболевания. Тем не менее атрофия СпМ при ППРС менее выражена, чем при ВПРС; хотя оба этих типа течения РС являются прогрессирующими, выявленные отличия подтверждают различные механизмы их развития.
Корреляции атрофических изменений и клинических симптомов
В настоящее время именно атрофия ЦНС (головного и спинного мозга) считается ответственной за неуклонное прогрессирование как очаговой неврологической симптоматики, так и когнитивных нарушений [8]. С помощью применения гистологических и нейровизуализационных методик доказана наибольшая корреляция ряда клинических симптомов с изменениями СВ по сравнению с БВ или головным мозгом в целом [39-41].
Корреляции атрофии головного мозга с развитием инвалидизации
Согласно ряду данных [42], существуют корреляции между баллом по шкале EDSS и общей толщиной коры головного мозга, коры левых пре- и постцентральных, правой парагиппокампальной и левой латеральной затылочной извилин, а также с объемом правого хвостатого ядра и правого прилежащего ядра (группа нейронов в вентральной части полосатого тела). В некоторых работах показано, что у пациентов со стойким прогрессированием нетрудоспособности по шкале EDSS отмечается значительно более высокая скорость атрофических процессов по сравнению с пациентами со стабильной неврологической симптоматикой. Также считается, что объем СВ по сравнению с объемом БВ является более чувствительным предиктором инвалидизации, оцениваемой по шкале EDSS [43]. Противоположные данные были получены в исследовании A. Ceccarelli [44], в котором у пациентов с РС не было выявлено связи между локальным поражением СВ и оценкой по шкале EDSS. У пациентов с ДТРС также не отмечено связи между атрофией СВ, продолжительностью заболевания и оценкой по EDSS [45]. Корреляций между изменением объема БВ и клинической симптоматикой также выявлено не было.
Исследование, которое позволило взглянуть по-новому на низкую степень корреляции между клинической картиной заболевания и МРТ-данными, было выполнено в 2009 г. [46]. В течение 6 лет у пациентов с разными типами течения РС проводилась оценка клинических проявлений по шкале EDSS и функциональной шкале РС — MSFC, включающей 3 теста. В итоге было выявлено, что прогрессирование по шкале MSFC коррелировало с объемом головного мозга в целом, объемами СВ и БВ, а отсутствие связи со шкалой EDSS подтвердилось. Эти результаты, по мнению авторов, связаны с относительно низким уровнем согласованности между способами измерения степени нетрудоспособности по этим двум шкалам (62%). Отсутствие корреляции между атрофией головного мозга и шкалой EDSS может быть связано со следующими факторами: нечувствительность шкалы EDSS в определении прогрессирования заболевания у пациентов с высокой степенью нетрудоспособности, а также ошибки в оценке прогрессирования заболевания у пациентов со стабильными значениями по шкале MSFC и низкими баллами по шкале EDSS. Также расхождения в результатах могут быть связаны с тем, что и другие факторы приводят к развитию нетрудоспособности, например такие как изменения в СпМ. При исследовании пациентов с ВПРС были получены аналогичные результаты, а именно наличие корреляций между атрофией всего головного мозга, СВ и СпМ со шкалой MSFC.
Корреляции атрофии головного мозга с когнитивными нарушениями
Когнитивные нарушения, включающие снижение памяти, внимания и скорости воспроизведения информации, отмечаются у 70% пациентов с РС, причем они возникают уже на ранних стадиях заболевания (в течение первых 3 лет). У пациентов с РРС с когнитивными нарушениями по сравнению с пациентами без таковых выявляется снижение объема головного мозга в целом, а также СВ коры головного мозга. Действительно, корковая атрофия является предиктором когнитивных нарушений, потому что даже легкие когнитивные изменения связаны со значительным истончением коры головного мозга [47]. Также значительная корреляция была обнаружена и с атрофией таламуса.
При разных типах течения РС с наличием когнитивных нарушений отмечены разные паттерны поражения СВ: у пациентов с РРС и когнитивными изменениями выявляется атрофия коры левой верхней височной извилины, левого островка, таламуса и правой средней затылочной извилины; у больных ВПРС отмечается атрофия коры передней поясной извилины, островка гиппокампа и правой верхней лобной извилины; а при ППРС — атрофия коры передней поясной извилины и правой верхней височной извилины.
Существуют данные о том, что атрофия головного мозга в меньшей степени влияет на когнитивные нарушения у пациентов с высоким «когнитивным резервом», который является результатом высокого уровня образования и интеллекта.
Корреляции атрофии головного мозга с утомляемостью
У пациентов с РС частым симптомом (до 80% случаев) является утомляемость. Она не связана с прогрессированием заболевания, степенью нетрудоспособности или локализацией очагов, но, вероятно, имеет связь с лобно-таламо-базальной сетью [48]. Исследования на данную тему немногочисленны. При сравнении пациентов с утомляемостью и без нее у первых была обнаружена атрофия вещества супратенториальных отделов головного мозга, включая кору, прилежащее БВ и головки хвостатых ядер, т.е. областей, которые функционально связаны с контролем внимания [49]. Авторы предполагают, что нарушение центральной моторной активации может быть связано с повреждением корково-подкорковых путей, включающих моторную кору. Так, 222 пациента с РРС с низкими баллами по шкале EDSS (не более 2) были разделены на две группы: пациенты с высокой степенью утомляемости (FSS не менее 5) и пациенты с низкой степенью утомляемости (FSS не более 4). В 1-й группе отмечались меньший объем СВ и БВ и наибольшее количество очагов в режимах Т2-ВИ и Т1-ВИ. Авторы предположили, что атрофия СВ и БВ может быть фактором риска появления утомляемости, которая при этом не связана со степенью нетрудоспособности.
Заключение
Таким образом, современные методики МРТ, в том числе воксельная МРТ-морфометрия, значительно расширяют наши представления о патогенезе РС. Многочисленные исследования показывают, что помимо атрофии БВ атрофия СВ при РС отмечается уже на ранних этапах развития заболевания и прогрессирует быстрее, чем у здоровых людей, являясь значимым МРТ-предиктором развития нетрудоспособности. Исследования, в которых показана атрофия разных зон головного мозга при различных типах течения РС, привносят новый вклад в понимание патофизиологических механизмов дегенеративного процесса. Однако последовательность развития атрофических процессов до конца не установлена. Дополнительная детализация закономерностей атрофии при РС с помощью МРТ-морфометрии будет играть важную роль в исследованиях при РС как в фундаментальном значении — уточнение патофизиологических механизмов, так и в практическом плане — разработка прогностических критериев течения болезни, мониторирование прогрессирования и оценка эффективности проводимой терапии в аспекте предупреждения/замедления нейродегенеративного процесса.
Способы лечения атрофической патологии головного мозга
Кортикальная атрофия головного мозга не поддается полному излечению. Самое главное – приостановить прогрессирование патологии, что в молодом возрасте можно сделать с большим успехом, чем у пожилых людей. Терапия атрофии в зависимости от ситуации может проводиться с помощью таких лекарственных средств:
- ноотропы применяются для улучшения питания клеток головного мозга. Кроме того, эти препараты способствуют нормализации процесса мышления;
- действие антиоксидантов направлено на улучшение обмена веществ, замедление процесса атрофии, противодействие свободным радикалам кислорода;
- препараты для улучшения микроциркуляции крови.
Кроме того, если человек страдает головными болями, ему прописывают принимать анальгетики или противовоспалительные нестероидные препараты. При повышенной возбудимости, раздражении, бессоннице показан прием седативных медикаментов. Очень важной является поддержка родственников больного, их помощь и понимание. Менять обычный уклад жизни нежелательно для пациента, необходимо создать для человека максимально спокойную и привычную обстановку. Очень важны прогулки на свежем воздухе, посильные физические нагрузки. Дневной сон для человека с атрофической патологией головного мозга нежелателен. Если врач разрешает, больному может быть назначен курс проведения лечебного массажа для улучшения кровотока пациента. При необходимости лечащий специалист может назначить успокоительные лекарственные средства, антидепрессанты, транквилизаторы. В случаях, когда родственники не в состоянии справиться с больным самостоятельно, при его агрессивном поведении предусмотрены специализированные дома престарелых, интернаты для больных с нарушениями функций мозга.
Прогноз людей, больных кортикальной атрофией мозга, является далеко не радужным. Болезнь, так или иначе, прогрессирует медленными или быстрыми темпами, ведет к необратимым изменениям в коре головного мозга, деградации личности, что в конечном итоге приводит к летальному исходу. К основным факторам, которые могут приостановить развитие патологии у больного, являются:
- положительный психоэмоциональный настрой, полное отсутствие стрессовых ситуаций;
- ежедневная умственная нагрузка, работа над своей памятью;
- употребление здоровой пищи;
- полный отказ от пагубных для организма привычек, таких как курение, алкоголь, прием наркотических веществ;
- контроль артериального давления;
- ежедневные прогулки, умеренные физические нагрузки.
Роль питания в лечении заболевания
Очень важным для поддержки нормального функционирования головного мозга, насыщения его клеток всеми необходимыми витаминами и минералами является правильное питание. Человек с диагнозом кортикальная атрофия головного мозга должен обязательно ввести в свой рацион омега кислоты, ненасыщенные жиры, жирорастворимые витамины. Необходимо убрать все жирное, жаренное, копченное, мучное. Хорошо влияет на питание мозга употребление грецких орехов, фруктов и овощей. Следует ввести в свой рацион блюда из жирных сортов рыбы. Правильное питание, здоровый образ жизни смогут приостановить отмирание нервных клеток, дадут возможность пациенту вести свою привычную жизнедеятельность.
Лечение патологии с помощью средств народной медицины
Атрофия головного мозга характеризуется необратимыми процессами в организме, которые не поддаются излечению. Однако с помощью народных методов можно приостановить темп развития патологичных процессов, улучшить самочувствие больного. С большим успехом в лечении атрофии головного мозга используются травяные чаи и настойки. Вот лучшие варианты таких сборов:
- Взять в одинаковых пропорциях душицу, хвощ, пустырник и крапиву. Залить кипятком в термосе и настаивать ночь. Принимать 3 раза в сутки;
- Настойку из молодой ржи и звездчатки, запаренных кипятком, можно пить после приема пищи в любом количестве. Очень помогает такой чай после получения травмы.
- Настойку из калины, шиповника и барбариса, запаренную кипятком и настоянную на протяжении 8 часов, принимают вместо чая в неограниченном количестве, можно с медом.
Очень важными для каждого человека являются профилактические осмотры, бережное отношение к своему здоровью, четкое выполнение рекомендаций специалистов и лечащего врача. Это поможет сберечь крепкое здоровье и прожить еще много лет счастливой и полноценной жизни.
Кортикальная атрофия представляет собой процесс разрушительного характера, наблюдающийся в коре головного мозга. Наиболее часто нарушение встречается в достаточно преклонном возрасте, также оно может быть связано с изменениями патологического характера, происходящими в организме.
Отклонения, присущие данному заболеванию в большинстве случаев дислоцируются в лобных долях мозга, которые несут ответственность за процессы мышления, также благодаря ним осуществляется контроль за поведением и планированием.
В некоторых случаях процесс может затронуть и другие области мозга, но встречается это гораздо реже. Что характерно, к откровенному слабоумию может привести исключительно обширный процесс. Проявления очагового характера патологического воздействия на способности мозга не имеют.
Процесс атрофии наиболее опасен для людей старшего возраста (за 50 лет), так как именно в это время происходит его медленное прогрессирование. Процент женщин, подверженных данной проблеме гораздо больше, чем мужчин. В конечном итоге кортикальная атрофия ведёт к старческому слабоумию.
Случаи кортикальной атрофии встречаются и у только что рожденных малышей, но это отклонение связано с тяжёлой наследственностью.
Причины, провоцирующие нарушение
В развитии атрофии головного мозга, и как результат старческого слабоумия есть комплекс причин, которые вызывают атрофические процессы головного мозга. На формирование заболевания влияют следующие факторы:
- происходит ухудшение насыщения крови кислородом;
- ухудшаются способности организма к регенерации;
- в результате атеросклероза идёт нарушение снабжения кровью тканей мозга;
- активируются процессы генетической предрасположенности к патологиям атрофического характера;
- уменьшение умственной нагрузки и мыслительных процессов.
Что характерно, даже если у человека есть предрасположенность к атрофии головного мозга (генетическая), но в процессе жизнедеятельности он изучал иностранные языки, интересовался наукой, искусством, читал разнообразную литературу, всячески интеллектуально развивался и использовал работу интеллекта на практике, то есть максимально использовал потенциал головного мозга, он меньше подвержен развитию слабоумия.
Развитие кортикальной церебральной атрофии врожденной по сути является гипоплазия мозга, так как его нормального формирования не происходит. Несмотря на это процесс также называется атрофическим.
Также в зрелом возрасте разрушительный процесс может развиваться по ряду причин:
- атрофия может происходить в результате токсического отравления (алкоголизма), при частом употреблении алкогольных напитков происходит отмирание нейронов, а в виду продолжающейся интоксикации их восстановления не происходит, что ведёт к данной проблеме;
- постоянное низкое давление;
- применение сосудосуживающих препаратов;
- отсутствие умственной нагрузки;
- травмы, в результате которых происходит пережатие сосудов и развивается отек мозга;
- кисты и опухоли приводят к пережатию сосудов, особенную опасность несут новообразования, которые замерли в росте, именно они влияют на развитие атрофии, растущие новообразования имеют не столь негативное влияние;
- в редких случаях причиной может стать нейрохирургическая операция.
Магнитно-резонансная томография в диагностике атрофии головного мозга
Атрофия — прижизненное уменьшение объема ткани или органа за счет уменьшения размеров каждой клетки, а в дальнейшем — числа клеток, составляющих ткань, сопровождающееся снижением или прекращением их функции. [5]
Под церебральной атрофией понимается уменьшение объёма вещества головного мозга при сниженной его плотности, за счёт генерализованного (наружного, внутреннего, смешанного) или фокального дефекта мозговой ткани. [6]
Физиологическая церебральная атрофия развивается, по данным исследователей, в возрасте от 40 до 60 лет, достигая максимальной выраженности к 70 годам [7]. Стареющий мозг уменьшается в среднем на 1,9 процента каждые 10 лет.
По данным Shah S. A., Doriswmy P. M., Husain M. L. (1991) старение связано со значительным увеличением объемов боковых и третьего желудочков (на 3 % ежегодно).
У пациентов в возрасте 65 до 95 лет Coffey C. E., Wilkinson W. E., Parashos I. A. (1992) определяли объем боковых и третьего желудочков; обнаружено увеличение их объема приблизительно на 0,95 мл\год.
В количественных исследованиях субарахноидального пространства показано увеличение его с возрастом у большинства людей.
По данным Zatz L. M., Jernigan T. L.(1982) объем ликвора увеличивается с 40 лет на 1мл ежегодно, до 40 мл в девятом десятилетии. В период от 40 до 90 лет соотношение объема ликвора к интракраниальному объему повышается от 3 до 10 %.
Обследование 76 здоровых добровольцев показало, что увеличение возраста сопровождается уменьшением объема полушарий мозга на 0,23 % в год.
В отличие от полушарий в целом коэффициент снижения объема лобной доли — 0,55 % в год. Коэффициент объемной потери для височной доли 0,28 % в год, амигдалярно-гиппокампального комплекса 0,30 % в год.
Патологическая атрофия рассматривается применительно к дегенеративным заболеваниям головного мозга генетически детерминированным, т. е. первично-дегенеративным и вторичным ЦА.
Клинические проявления ЦА рассматриваются в основном с позиций нарушения высших корковых функций, причем исключительно у больных пожилого и старческого возраста. [7] В этой связи отмечается, что когнитивный дефицит выявляется практически у всех пациентов, начиная с ранних стадий ЦА, независимо от генеза атрофии. [2]
Клинические проявления синдрома вторичной церебральной атрофии полиморфны. В то же время существуют типичные клинические варианты, выделенные с учётом преобладающих симптомокомплексов. Наиболее распространённым является вариант неврологических нарушений (57 %), реже регистрируется невротический (22 %) и смешанный (15 %) варианты, а самый редкий — вариант когнитивных расстройств (6 %). [6]
Начиная со второй половины XX в. во всем мире наблюдается изменение возрастной структуры населения с постоянным увеличением в популяции доли пожилых и старых людей. Поэтому в современной медицине приобретают все большее значение профилактика и лечение большого числа возраст — зависимых заболеваний. Вследствие увеличения числа пожилых людей (предполагается, что в 2030 г. 20 % населения будут составлять лица старше 65 лет) атрофия ГМ, приводящая к деменции становится одной из основных проблем здоровья населения. [10]
Проблема атрофии головного мозга тесно связана с развитием деменции. По данным европейских эпидемиологических исследований, деменция наблюдается у 6–7 % людей старше 65 лет, и одна лишь болезнь Альцгеймера занимает 2–3-е место по величине расходов на медицинскую и социальную помощь среди неврологических и психических расстройств. [2,8] Рост заболеваемости деменцией увеличивается с возрастом; она в 5 раз чаще наблюдается у людей старше 80 лет, чем у 70-летних.
Несмотря на такое распространение, в настоящее время специфических методов диагностики церебральной атрофии не существует [1,2,3,4]. В диагностике ЦА основное место принадлежит, безусловно, нейровизуализационным методам: компьютерной томографии и магнитно- резонансной томографии [6], а также методом функциональной нейровизуализации — однофотонной эмиссионной компьютерной томографии, позитронно-эмиссионной томографии, МРТ- спектроскопии. В качестве дополнительных диагностических методов используются ультразвуковая допплегрофия брахиоцефальных артерий, а также транскраниальная допплерография, дуплексное сканирование брахиоцефальных артерий, грудная или селективная ангиография, ЭЭГ, метод вызванных потенциалов, патоморфологические методы, ряд лабораторных методик, в том числе исследования спинномозговой жидкости (СМЖ) и плазмы крови.
Как физиологическая, так и патологическая атрофия не имеют стандартных диагностических критериев, позволивших бы верифицировать наличие ЦА, определить её нейровзуализационный тип и степень выраженности атрофического процесса. [6]
Магнитно-резонансная томография является одним из приоритетных и высокоинформативных современных методов неинвазивной диагностики. Из всех лучевых методов МР-томография дает картину в наибольшей степени приближенную к анатомической.
МРТ предпочтительнее при нейродегенеративных деменциях, позволяющая определить топографию атрофии. [9]
Целью данного исследования являлось усовершенствование диагностики заболеваний приводящих к атрофии головного мозга на основании МРТ-исследования.
МРТ исследование было проведено 60 пациентам в возрасте от 45 до 80 лет. Из них здоровых добровольцев 20 человек, 13 пациентов с предполагаемой болезнью Альцгеймера (основанной на клинических проявлениях), 27 пациентов с цереброваскулярной недостаточностью атеросклеротического происхождения.
В группе с предполагаемой болезнью Альцгеймера по данным, полученным при МРТ исследовании головного мозга выявлено уменьшение размеров височных долей головного мозга на 10–56 % и гиппокампа на 10–40 % (уменьшение кореллирует со степенью выраженности деменции (мягкая, умеренная, тяжелая), расширение сильвиевых борозд у 13 (100 %) пациентов, что связано с атрофическими изменениями в большей степени височных и лобных долей головного мозга, инволюционные изменения коры головного мозга с расширением борозд до 1,5–5,0 мм, и субарахноидального пространства конвекститальных поверхностей в лобно-теменных и височных областях у 13 (100 %) пациентов.
У пациентов с цереброваскулярной недостаточностью уменьшение размеров височных долей не превышало 2 % и наблюдалось у 5 (18,5 %) пациентов, что было расценено как естественные возрастные изменения. Также было выявлено стирание границ белого и серого вещества головного мозга у 18 (67 %) пациентов, наличие постишемических кист — микрокист до 3–5мм в диаметре у 23 (85 %), макрокист свыше 5 мм в диаметре у 16 (59 %), расширение сильвиевых борозд у 20 (74 %) пациентов, что связано с общими атрофическими изменениями коры, инволюционные изменения коры головного мозга, в частности расширение борозд до 1,5–2,0 мм с равномерным расширением субарахноидального пространства конвекститальных поверхностей у 18 (67 %) пациентов.
В группе здоровых добровольцев у 8 (40 %) была выявлена генерализованная атрофия с относительно равномерным расширением субарахноидальных пространств.
Проведенные исследования показали, что применение магнитно-резонансной томографии играет важную роль в диагностике и дифференциации различных видов церебральной атрофии. Так было выявлено, что у пациентов с риском развития болезни Альцгеймера, а также уже с установленным диагнозом в лобно-теменных и височных отделах головного мозга развиваются изменения атрофического характера. Эти изменения характеризуются уменьшением височных долей и гиппокампа, расширением сильвиевых борозд и субарахноидального пространства в соответствующих отделах. Степень выраженности этих изменений находится в прямой зависимости от тяжести состояния больного. Сочетание подобных изменений не было выявлено среди других групп, что свидетельствует о том, что при других патологических состояниях головного мозга комплекс данных структурных изменений не встречается.
Литература:
1. Вавилов С. Б. Компьютерная томография головного мозга в психиатрии: методы морфометрии/Компьютерная томография и другие современные методы диагностики (возможности и перспективы). Мат. международн. симпозиума.-1989.-С.60–67.
2. Дамулин И. В. Болезнь Альцгеймера: Клинико-МРТ-исследование/ И. В. Дамулин, О. С. Левин, Н. Н. Яхно/ Неврол. журнал -2005, С.-34–38.
3. Колыхалов И. В. Клинические и компьютерно-томографические сопоставления при деменциях альцгеймеровского типа. Автореф.дисс.-1993, С-25.
4. Максимович И. В. Особенности микроциркуляции головного мозга у лиц с повышенным риском возникновения и ранними стадиями болезни Альцгеймера/И. В. Максимович, С. А. Овсянников, Л. Н. Готман//Ангиология и сосудистая хирургия- 2006, Т.4,№ 3,С-20–24.
5. Струков А. И. Патологическая анатомия.
6. Черкасова В. Г. Вторичные церебральные атрофии. Клиническая характеристика, диагностика и возможности терапии,2005
7. Яхно Н. Н. Актуальные вопросы нейрогериатрии\\ В кн. «Достижения в нейрогериатрии». Под редакцией Н. Н. Яхно, И. В. Дамулина-М.1995.-Ч.1.-С.9–29.
8. Jochemsen HM, Muller M, Visseren FL. Blood pressure and progression of brain atrophy: the SMART — MR Study. JAMA Neurol. 2013 Aug: 70(8):1046–53.
9. Lehericy, Delmaire. Neuroimaging in Dementia, Presse Med 2007 oct 36 (10 Pt 2):1453–63
10. Prestia, Baglieri, Pievani. The in vivo topography of cortical changes in healthy aging and prodromal AD. SupplClinNeurophysiol. 2013: 62:67–80.
Симптомы каждой стадии разрушительного процесса
Кортикальная церебральная атрофия проходит пять степеней развития, на каждой из которых свои симптомы и проявления:
- Начальная стадия характеризуется полным отсутствием проявлений, но ее развитие происходит стремительно и быстро переходит в следующую стадию.
- На второй стадии общение с окружающими очень быстро ухудшается. Человек не может адекватно воспринимать критику, становится раздражителен, конфликты с его участием – нормальное явление, регулярно повторяющееся. Очень часто теряется нить разговора.
- Третья стадия – больной в несколько этапов теряет контроль над своим поведением, которое становится возмутительным. Часты проявления уныния или возникновение беспричинных вспышек гнева.
- Четвертая стадия: полностью теряется осознание сути событий. Пациент не может адекватно реагировать на требования окружающих.
- Пятая стадия – больной совершенно не поснимает происходящих событий, и, соответственно, это не вызывает у него никаких эмоций.
В зависимости от кого, какая именно доля мозга была затронута атрофией, возникают еще на первых этапах некоторые нарушения речи, появляется необоснованная эйфория или равнодушие, вялость, сексуальная гиперактивность, некоторые разновидности маний.
Диагностические критерии и методы исследования
Кортикальная церебральная атрофия имеет рад симптомов, которые должны стать причиной похода к врачу и диагностирования дегенеративного процесса.
- снижение способности анализировать и мыслить;
- нарушение моторики рук;
- нарушение памяти, вплоть до невозможности запомнить минимум информации;
- изменение особенностей речи: тона, темпа и т.п.
При поражении разных участков мозга проявляются и различные симптомы:
- при поражении мозжечка нарушается тонус мышц, координация движений;
- патология промежуточного мозга приводит к проблеме с обменом веществ, проблемы с терморегуляцией, гомеостаз;
- проблемы с передним мозгом приводят к утрате всех рефлексов;
- атрофия продолговатого мозга есть причиной нарушения дыхания, пищеварения, работы сердечно-сосудистой системы, защитных рефлексов; исчезает реакция на раздражители из вне из-за отмирания коры среднего мозга.
При посещении врача необходимо изложить симптомы, на основании которых назначаются дальнейшие исследования:
- рентгенологическое исследование (даёт возможность обнаружить новообразования, очаги со структурными изменениями);
- когнитивные тесты (определяется степень тяжести заболевания);
- допплерография сосудов шеи и мозга (для визуализации просветов сосудов);
- МРТ (даёт самый точный диагноз).
Атрофия головного мозга: причины, симптомы, диагностика
Атрофические изменения коры головного мозга приводят к разрушению нейронных связей, снижению активности функциональных центров. Состояние приводит к нарушению внутримозгового метаболизма, слабоумию, формированию ряда психических заболеваний (Альцгеймера, боковой амиотрофический склероз, деменция).
Клинические симптомы зависят от вида, стадии, степени заболевания. Мультисистемная форма сопровождается диффузной гибелью нейронов, постепенной утратой функций организма.
Атрофия мозга на МРТ
Как помочь пациенту
Кортикальная церебральная атрофия не поддаётся полному излечению. Главная задача – назначение комплексного лечения, направленного на замедление развития симптомов. Атрофии, проявившиеся в молодом возрасте, поддаются эффективной корректировке, если исключить этиологический фактор.
Для лечения кортикальной атрофии, пациентам назначаются препараты таких групп:
- Для улучшения микроциркуляции крови. Самое популярное лекарственное средство – Трентал. Препарат с вазодилатирующим действием, увеличивающий просвет капилляров, улучшающий газообмен сквозь стенки сосудов и микроциркуляцию крови.
- Ноотропы. Препараты данной группы улучшают обращение крови и метаболизм головного мозга. Препараты с высокой эффективностью: Пирацетам, Цераксон, Церепро, Церебролизин. Лекарственные препараты данной группы благотворно влияют на мыслительные способности больного.
- Антиоксиданты. Препараты данной группы стимулируют процессы регенерации, повышают интенсивность обмена веществ, замедляют атрофию, уменьшают воздействие свободных радикалов кислорода.
- Для того чтобы снять сопутствующие симптомы такие, как головная боль, назначается применение нестероидных противовоспалительных препаратов.
Важным фактором в лечении кортикальной атрофии есть наблюдение за нервно-психическим состоянием пациента. Членами семьи этот диагноз должен быть принят адекватно, как и отношение к больному:
- пациенту необходимы прогулки на свежем воздухе ежедневно;
- умеренная физическая активность;
- больному нужно доверить все возможные процедуры самообслуживания;
- при неврастеническом состоянии допустимо применение лёгких седативных препаратов.
Болезнь прогрессирует очень быстро и результатом этого процесса есть деградация личности. Вычурный оттенок приобретает манера общения, речь, поведение. Словарный запас значительно скудеет, что ведёт к использованию в речи односложных фраз.
Прогноз для больных кортикальной атрофией головного мозга всегда неблагоприятный: медленно или быстро идёт процесс, он всегда ведёт к деградации и, конечном итоге, смерти.
Эффективных методов профилактики разрушительного процесса на данный момент не существует. Единственное, что может замедлить процесс – это:
- своевременное лечение всех имеющихся заболеваний;
- активный образ жизни;
- работа над своей памятью;
- развитие интеллекта с молодости;
- позитивный настрой.
Атрофия головного мозга – деструктивные изменения, которые провоцируют истощение тканей органа, ухудшение жизнеспособности, утрату функций. Сопровождается омертвением нервных клеток и разрывом нейронных связей внутри химически или функционально связанных групп. Объем мозговой ткани уменьшается. Деструктивные процессы распространяются на разные отделы – кору и субкортикальные (подкорковые) участки. Часто встречается у пациентов старше 50 лет. Диагностируется у новорожденных младенцев и детей в возрасте до года.
Отмирание клеток, из которых состоит головной мозг, провоцирует серьезные последствия. Наблюдается нарушение когнитивных способностей, к которым относятся речь, пространственная ориентация, понимание, логическое мышление, умение рассуждать, вычислять и обучаться. Болезнь вызывает расстройства неврологического характера и двигательную дисфункцию.
Врачи дают отрицательный ответ на вопрос, влияет ли церебральная атрофия, протекающая в головном мозге, на продолжительность жизни. Нейроны отмирают постепенно. От первичных признаков патологии до состояния, когда атрофируется большой участок мозга с последующим развитием деменции, может пройти больше 20 лет. Смерть пациента обычно обусловлена другими заболеваниями, которые вызывают сбои в работе организма, не совместимые с жизнью.
Рассуждения на тему, сколько живут пациенты с атрофическими поражениями, некорректно отражают особенности и влияние патологии. Церебральная атрофия не уменьшает продолжительность жизни, но значительно ухудшает ее качество. Приводит к слабоумию, инвалидности. Человек не способен к самостоятельному обслуживанию, нуждается в постоянном медицинском наблюдении и уходе. Часто вынужден провести остаток жизни в специализированном диспансере.
Магнитно-резонансная томография (МРТ) в Санкт-Петербурге
МРТ головного мозга. Демонстрация атрофии и нормы при цветовой обработке.
Под термином “нейродегенеративные заболевания” (НДЗ) определяется большая группа заболеваний преимущественно позднего возраста, для которых характерна медленно прогрессирующая гибель определенных групп нервных клеток и одновременно – постепенно нарастающая атрофия соответствующих отделов головного и/или спинного мозга. В основе развития этих заболеваний лежит нарушение метаболизма и изменение конформации клеточных белков с их последующим накоплением и агрегацией в определенных группах нейронов. При НДЗ страдают преимущественно нейроны и глиальные клетки базальных ганглиев и стволовых структур, вырабатывающие ацетилхолин, дофамин, серотонин.
Классификация делит НДЗ на 2 большие группы – спорадические и ирритативные.
- Спорадические НДЗ:
- Прогрессирующий надъядерный паралич (болезнь Стила —Ричардсона — Ольшевского).
- Мультисистемная атрофия.
- Деменция с тельцами Леви.
- Паркинсоническая деменция (синдром Гуам).
- Кортикобазальная дегенерация.
- Болезнь Альцгеймера.
- Ирритативные НДЗ:
- Болезнь Гентингтона.
- Болезнь Галлервордена—Шпатца.
- Болезнь Вильсона—Коновалова.
- Болезнь Фара.
- Болезнь Бессена — Корнцвейга.
Болезнь Альцгеймера – прогрессирующее нейродегенеративное заболевание, характеризующееся постепенным развитием деменции. Происхождение заболевания точно неизвестна. Биохимические изменения состоят в снижении активности холин-ацетил-трансферазы коры головного мозга и гиппокампов. Патологические проявления заключаются в образовании специфических амилоидных бляшек, нейрофибриллярных тяжей и реактивном глиозе. Развивается атрофия, захватывающая преимущественно кору вокруг Сильвиевых щелей и гиппокампы, с вторичным расширением желудочков, особенно височных рогов
Заболевание впервые описано Alois Alzheimer в 1907 году. Процесс напоминает естественное старение, но резко ускоренное. Начинается с нарушений памяти, затем потерянность, невозможность повседневного самообслуживания, повторяющиеся вопросы. Позже присоединяются глубокие нарушения психики, речи, потеря веса, судороги.
Частота составляет 0,51% для лиц в возрасте 70-74 лет с возрастным прогрессирующим увеличением частоты. Клинические проявления состоят в нарушении памяти, депрессии, поведенческих нарушениях и галлюцинациях. На поздних стадиях к психическим расстройствам добавляется экстрапирамидная симптоматика. Заболевание занимает 4 место по смертности. Диагноз ставится на основании клинического и нейрофизиологического обследования, а также нейровизуализации. Типичные проявления на КТ состоят в диффузной атрофии (особенно,височных долей), вторичном расширении борозд и желудочков. Чувствительность (без измерения объемов) в сравнении с нормальной возрастной группой около 80%, специфичность около 70%. Измерение объемов гиппокампов при выполнении МРТ с тонкими срезами повышает точность до 85%.
МРТ головного мозга. Т2-взвешенная сагиттальная МРТ. Болезнь Пика. Цветовая обработка изображения.
МРТ головного мозга служит метода выбора оценки структурных изменений. Атрофические изменения выражены во всём медиобазальном отделе височной доли. Чувствительность и специфичность МРТ при начальной деменции около 80%. Измерение объемов гиппокампов и амигдалы повышает точность до до 85%.
МРТ головного мозга. Т1-взвешенная корональная МРТ. Диффузная атрофия при болезни Альцгеймера.
Дифференциальную диагностику при МРТ головного мозга надо проводить с болезнью Паркинсона, мультиинфарктной деменцией и лобнотеменной деменцией (болезнь Пика).
В этих же зонах отмечается гипоперфузия и снижение активации при фМРТ. Кроме МРТ при исследовании болезни Альцгеймера важное значение имеет ПЭТ с [18F] флюоро-2-деоксиглюказой (FDG). Гипометаболизм хорошо коррелирует с тяжестью заболевания и предсказывает его развитие.
Синдромы Паркинсона включают группу заболеваний, близких по клинике к болезни Паркинсона. К синдромам Паркинсона относится быстро прогрессирующая деменция с тельцами Леви . При МРТ головного мозга низкий сигнал наблюдается не только от компактной части черного вещества, но и от скорлупы, которая становится даже темнее бледного шара. При оливопонтоцеребеллярной атрофии на сагиттальных МРТ головного мозга видно уменьшение объема моста и мозжечка. При прогрессирующем надъядерном параличе обнаруживается атрофия пластины четверохолмия. Описаны характерные симптомы при МРТ – «пингвина», «Микки Мауса» и другие, смысл которых заключается в описании признаков атрофии.
При деменции, связанной с болезнью Паркинсона при МРТ головного мозга отмечается снижение толщины коры в проекции парагиппокампальной части левой средней затылочно-височной извилины и уменьшение объема левого нижнего продольного пучка. Уменьшение толщины коры левой парагиппокампальной зоны связано с высоким риском депрессии. Отмечено, что дневная сонливость коррелирует с уменьшением толщины коры фузиформной зоны, определяемое при МРТ.
Для прослеживания динамики и прогнозирования также прибегают к различным измерениям при МРТ головного мозга:
- коэффициент средний мозг-мост в норме 0,24, а при прогрессирующем надъядерном параличе становится меньше 0,12.
- Индекс паркинсонизма – отношение ширины верхней ножки мозжечка в корональной плоскости к площади среднего мозга в средней сагиттальной плоскости умноженной на отношение ширины средней ножки мозжечка к ширине верхней ножки мозжечка – больше 13,55 свидетельствует в пользу паркинсонических синдромов. При МРТ выявляется атрофия хвостатых ядер с вторичным расширением передних рогов; атрофия скорлупы и коры лобных долей. Отношение ширины передних рогов к расстоянию между хвостатыми ядрами (по их краям), измеряемое в поперечной плоскости уменьшается с 2,2-2,6 до значений близких к 1,0. Другой коэффициент – расстояние между хвостатыми ядрами (между их головками к ширине черепа по внутренним пластинкам) – увеличивается (в норме 0,09-0,12).При МРТ головного мозга выявляется диффузная атрофия мозга, расширение периваскулярных пространств Вирхова- Робена и лейкоараиоз. Последний является следствием стеноза и окклюзии глубоких вен мозга. На Т2-зависимых МРТ изображениях лейкоараиоз выглядит как небольшие очаги гиперинтенсивности. В целом эти признаки неспецифические и отражают старение мозга. При МРТ головного мозга на томограммах обоих типов взвешенности обнаруживается повышенный сигнал от моста и покрышки мозжечка. Типично изменение сигнала от периферии моста. В отличии от опухолей при МРТ нет отека и масс-эффекта. Самые ранние проявления обнаруживаются на диффузионное-взвешенных МРТ головного мозга, примерно через 24 часа от начала тетрапареза.
Прогрессирующий надъядерный паралич проявляется в виде нарушения взора вверх, экстрапирамидной симптоматики и умственных нарушениях. Заболевание развивается у лиц около 60 лет. Этиология неизвестна, почти все случаи спорадические. Частота 1-1,5 случаев на 100 тыс. населения. Заболевание характеризуется патологическим скопление в головном мозге тау-протеина. При МРТ головного мозга наблюдается диффузная атрофия, причем на сагиттальных Т1-взвешенных МРТ отмечается характерный симптом “пингвина”. Атрофические изменения моста и среднего мозга приводят к расширению водопровода и III желудочка, контур которых напоминает очертания пингвина.
МРТ головного мозга. Т12-взвешенная сагиттальная МРТ. Прогрессирующий надъядерный паралич. Симптом “пингвина”.
Центральный понтинный миелиноз (осмотическая деменция) представляет собой приобретенное метаболическое расстройство. Чаще встречается у алкоголиков. Гипонатрийемия приводит к демиелинизации, видимой при МРТ. Центральный понтинный миелиноз часто сопровождается экстрацентральным, когда есть поражение выше ствола. Клинические проявления сводятся к заторможенности (вплоть до летаргии), спастическому тетрапарезу и поражению нижних черепных нервов.
МРТ головного мозга. Т2-взвешенная аксиальная МРТ. Центральный понтинный миелиноз,
Болезнь Бинсвангера (субкортикальная атеросклеротическая энцефалопатия, деменция мелких сосудов). Это состояние, связанное с множественными инфарктами мелких ветвей, что при МРТ головного мозга видно как лакунарные ОНМК. Заболевание постепенно прогрессирует. Вариантом болезни Бинсвангера можно считать наследуюмую семейную артериопатическую лейкоэнцефалопатию.
МРТ головного мозга. Т2-взвешенная МРТ типа FLAIR. Болезнь Бинсвангера.
Болезнь Гентингтона относится к наследуемым заболеваниям, проявляется в среднем возрасте и быстро прогрессирует. В клинической картине преобладают хореоатетоз и деменция.
МРТ головного мозга. Т1-взвешенная корональная МРТ. Болезнь Гентингтона.
Болезнь Фара очень редкое наследственное заболевание, проявляющееся в кальцификации базальных ганглиев и зубчатого ядра. На Т2-зависимых МРТ ядра резко гипоинтенсивны, что соответствует кальцинатам, хорошо видимым на КТ. Нередко в области зрительных бугров обнаруживаются мелкие гиперинтенсивные очажки.
МРТ и КТ головного мозга в аксиальной плоскости. Болезнь Фара.
Об МРТ в СПб при нейродегенераторных заболеваниях можно также читать на странице нашего другого сайта. Исследование мы выполняем в закрытом аппарате, но можно и на открытом МРТ. МРТ СПб позволяет выбирать место МРТ, но в этом случае мы рекомендуем Вам обследоваться у нас.
Оставить отзыв.
МРТ в Санкт-Петербурге USA
Что такое атрофия, протекающая в головном мозге
Атрофические изменения, протекающие в головном мозге, выглядят как компенсаторное увеличение объема спинномозговой жидкости на фоне уменьшения доли нейронов (паренхима мозга). Состояние напоминает гидроцефалию с той разницей, что отражает не очаговую потерю объема тканей, а прогрессирующие патологические изменения в них. Выражается в частичной утрате физических и психических функций, спровоцированной местным поражением определенного участка мозговой ткани. Различают 4 стадии течения болезни.
Для атрофии 1 степени, протекающей в головном мозге, свойственно отсутствие выраженных симптомов. Человек может испытывать головную боль, подвержен депрессиям, эмоционально нестабилен, становится раздражительным и плаксивым. Справляется с привычными задачами профессиональной деятельности, живет полноценной жизнью. Если не начать лечение, легкая начальная форма постепенно перерастает во 2 степень, когда человек теряет коммуникативные способности, эмоциональную связь с окружающими.
Сильнее проявляется неврологическая симптоматика – двигательная дисфункция, расстройство согласованности движений. Патологические процессы приводят к неотвратимому и необратимому слабоумию. Третья степень сопровождается отмиранием – некрозом участков серого и белого вещества, из которых строится головной мозг. Пациент не контролирует поведение, часто нуждается в госпитализации и постоянном медицинском наблюдении. Картину церебральной атрофии, протекающей в мозге у взрослых и пожилых пациентов, иллюстрируют симптомы:
- бессвязная, неосмысленная речь;
- утрата профессиональных навыков;
- потеря ориентации в рамках пространства и временного периода;
- утрата навыков самостоятельного обслуживания.
Число жалоб на неудовлетворительное состояние здоровья уменьшается по ходу нарастания деструктивных процессов корковой атрофии. Это тревожный сигнал, свидетельствующий об ухудшении адекватного восприятия собственного физического и психического состояния.
Атрофия гиппокампа при болезни Паркинсона
Атрофия областей мозга, наблюдаемая при болезни Альцгеймера, также обнаруживается при когнитивном снижении, связанном с болезнью Паркинсона, показали результаты нового исследования.
Атрофия гиппокампа, височных и теменных долей, уменьшение объема префронтальной коры, обнаруживаются у пациентов с болезнью Паркинсона с когнитивным снижением, включая субъектов с мягким когнитивным ухудшением, отмечают ученые.
«Те же самые области, которые подвергаются нейродегенерации при болезни Альцгеймера, связаны со всеми стадиями когнитивного снижения при болезни Паркинсона
», — сказал доктор Дэниел Вейнтрауб (Daniel Weintraub) (Perelman School of Medicine, University of Pennsylvania, Philadelphia).
«Пациенты с болезнью Паркинсона без деменции со специфическими паттернами атрофии, диагносцируемыми с помощью МРТ мозга, могут иметь повышенный риск долгосрочного когнитивного снижения, возможно, с последующим развитием деменции
», — добавил он.
Исследование опубликовано в декабрьском выпуске Archives of Neurology.
Доктор Вейнтрауб и коллеги оценили области и паттерны атрофии мозга у 84 пациентов с болезнью Паркинсона, и 23 здоровых субъектов, составивших контрольную группу. В группе болезни Паркинсона у 61 пациента был нормальный когнитивный статус, 12 — имели мягкое когнитивное снижение, и 11 субъектов — когнитивное снижение, связанное с болезнью Паркинсона.
Всем участникам исследования было проведено МРТ головного мозга, с количественной оценкой изображений, посредством морфометрического анализа определенных областей мозга, чтобы идентифицировать паттерны атрофии при различных стадиях когнитивной дисфункции.
У пациентов с болезнью Паркинсона и нормальным когнитивным статусом не было найдено значимой атрофии мозга, сообщают ученые, объемы определенных областей мозга, были подобные таковым у здоровых пациентов группы контроля.
«Это позволяет предположить, что при болезни Паркинсона в отсутствии сопутствующего когнитивного снижения, не происходит существенной атрофии регионов мозга
», — говорят авторы.
По сравнению с пациентами с болезнью Паркинсона и нормальным когнитивным статусом, у пациентов с болезнью Паркинсона и мягким когнитивным ухудшением была обнаружена атрофия гиппокампа, и у субъектов с деменцией, связанной с болезнью Паркинсона, — атрофия гиппокампа и медиальных отделов височной доли.
У пациентов с болезнью Паркинсона и мягким когнитивным снижением найденный паттерн атрофии мозга отличался от результатов МРТ у пациентов с болезнью Паркинсона и нормальным когнитивным статусом, и был подобен обнаруженному у пациентов с деменцией при болезни Паркинсона. Паттерн характеризовался сокращением серого и белого вещества гиппокампальной, префронтальной коры, и белого вещества теменной доли.
«Полученные результаты позволяют предположить, что гиппокампальная нейродегенерация ассоциируется с начальными стадиями когнитивного снижения при болезни Паркинсона, с более серьезным когнитивным ухудшением, связанным с дополнительной атрофией в медиальных структурах височной доли
», — пишут авторы.
Ученые также обнаружили положительную корреляцию между работой памяти и объемом гиппокампа у пациентов с болезнью Паркинсона без деменции.
Эти наблюдения поддерживают появляющиеся свидетельства раннего вовлечения гиппокампа в процессы снижения памяти при болезни Паркинсона.
Доктор Вейнтрауб и коллеги говорят, что использование морфометрического анализа позволяет идентифицировать диффузные области атрофии серого и белого вещества на ранних сроках когнитивного снижения у пациентов с болезнью Паркинсона. Различные паттерны также позволяют дифференцировать пациентов с болезнью Паркинсона со связанной деменцией, и имеющих нормальный когнитивный статус.
Несмотря на некоторые ограничения исследования, полученные результаты подтверждают «недавно полученные данные, что ухудшение памяти может быть начальным проявлением когнитивного снижения, и часто встречается у пациентов с болезнью Паркинсона», — сказал доктор Вейнтрауб.
Поэтому, «важно разработать согласующиеся диагностические критерии, валидизировать оценочные инструменты для использования в клинической практике и исследованиях, и оценить подходы к лечению симптоматических и модифицирующих болезнь эффектов» у пациентов с болезнью Паркинсона,
— заключают авторы.
«Валидизация биомаркеров нейродегенерации, связанной с мягким когнитивным ухудшением, и различие мягкого когнитивного ухудшения при болезни Паркинсона от ранних стадий деменции с тельцами Леви, позволит лучше понимать нейропатофизиологические особенности начальной стадии когнитивного снижения при болезни Паркинсона
», — пишут ученые.
Виды патологии
Генерализованная форма церебральной атрофии охватывает множественные участки нервных клеток мозговой ткани. Диффузная атрофия головного мозга – равномерное отмирание нейронов на всех участках мозговых структур. Развивается вследствие артериальной гипертензии, для которой свойственно повреждение мелких сосудов, расположенных в каждом отделе мозга.
Начальные признаки при диффузной атрофии напоминают нарушение функций мозжечка. Прогрессирующее течение приводит к быстрому нарастанию симптоматики, что позволяет дифференцировать патологию на более поздних этапах. В отличие от кортикального вида, при диффузной атрофии явно выражены симптомы поражения управляющего, доминирующего полушария. При кортикальной субатрофии, протекающей в головном мозге, деструкция и разрушение тканей только намечаются.
Субатрофия, которая протекает в головном мозге – это состояние, предшествующее стадии отмирания нейронов. Механизм болезни уже запущен, деструктивные процессы начались, но организм самостоятельно компенсирует возникшие нарушения. Субатрофические изменения сопровождаются невыраженной симптоматикой. Биполушарная кортикальная атрофия протекает в тканях обоих полушарий. Проявляется синдромом Альцгеймера.
Алкогольная атрофия, развивающаяся в головном мозге
Органическое поражение структур мозгового вещества, которое развивается на фоне постоянного воздействия этанола, называется токсической энцефалопатией. Затрагивает все отделы мозга. Особенно чувствительны к негативному воздействию алкоголя корковые слои и мозжечок. Часто приводит к параличу черепно-мозговых нервов. Лобные доли отвечают за поведение, уровень интеллекта, эмоции и моральные качества – свойства, которые характеризуют сознательную личность.
Развивающаяся патология вызывает атрофические изменения в тканях и является одной из главных причин деменции. Слабоумие, как последствие алкоголизма, диагностируется у 10-30% пациентов, злоупотребляющих спиртосодержащими напитками. Человек становится инфантильным, теряет способность к абстрактно-логическому мышлению. По мере прогрессирования болезни больной утрачивает элементарные навыки – умение чистить зубы, завязывать шнурки, удерживать в руке столовые приборы.
Проведение МРТ диагностики
МРТ головного мозга может выявить:
- Нарушения лобно-височной коры (признак болезни Альцгеймера). При прогрессировании заболевания отмирают клетки этих зон, сопровождающиеся неадекватным поведением, болезнью Пике.
- Умеренную кортикальную и церебральную атрофию, которой подвержены люди в возрасте старше 55-ти. Изменения тканей могут появиться на всех участках головного мозга, а субатрофия полушарий является признаком слабоумия. Маленькие очаги не оказывают влияния на поведение и умственные данные человека.
- Диффузную атрофию, провоцирующуюся преимущественно травмами головного мозга. На первых этапах болезнь проявляется как нервное расстройство с концентрацией в мозжечке, позднее распространяется на другие области головного мозга.
- Фокальную субатропию, проявляющуюся у страдающих эпилепсией и усугубляющую это заболевание. Причиной могут стать травмы, мешающие нормальному кровотоку. После исключения первопричины приступы прекращаются.
- Атрофию коры с сокращением кортикальных извилин. Заболевание имеет генетическую природу. Нередко сопровождается сосудистой недостаточностью.
- Генерализованную атрофию, которой подвержены новорожденные. Причиной является недостаток кислорода либо инфекция плода. Таких малышей помещают в перинатальные стационары и проводят ряд мероприятий по реабилитации.
- Субатрофию теменных лобных долей, проявляющуюся на фоне перенесенных травм. Лечится терапевтическими методами.
В целом все методики лечения атрофии головного мозга направлены на исключение фактора развития патологических процессов и основаны на медикаментозной терапии.
Симптоматика
Первоначальные признаки атрофии, затронувшей ткани и структуры головного мозга, обычно проявляются у людей старше 45 лет. Патология чаще диагностируется у пациентов женского пола. Характерные симптомы:
- Изменение типа личности. Апатия, равнодушие, сужение круга интересов.
- Расстройство психо-эмоционального фона. Перепады настроения, депрессивные состояния, повышенная раздражительность.
- Нарушение функции памяти.
- Сокращение словарного запаса.
- Двигательная дисфункция, нарушение координации движений и мелкой моторики.
- Ухудшение мыслительной деятельности.
- Снижение работоспособности.
- Эпилептические припадки.
Регенеративные реакции организма ослабевают. Рефлексы угнетены. Симптомы становятся ярче и выразительней. Атрофические изменения проявляются синдромом Паркинсона и Альцгеймера. О конкретной зоне поражения свидетельствуют признаки:
- Продолговатый мозг. Отклонения в работе органов дыхательной, пищеварительной, сердечно-сосудистой систем. Защитные рефлексы подавлены.
- Мозжечок. Слабость скелетных мышц, сбои в работе опорно-двигательного аппарата.
- Средний мозг. Заторможенные или отсутствующие реакции на раздражители извне.
- Промежуточный мозг. Патологические отклонения в работе системы терморегуляции, нарушение деятельности системы гемостаза и обмена веществ.
- Лобные доли. Скрытность, агрессия, демонстративное поведение.
Такие признаки, как импульсивность, несвойственная ранее грубость, повышенная сексуальность, понижение самоконтроля, апатия, указывают на сбои в работе главного органа ЦНС.
Причины возникновения атрофии мозга
После 50 лет увеличивается риск нейродегенеративных состояний. Повышают вероятность появления нозологической формы провоцирующие факторы:
- Снижение функции почек (недостаточность);
- Длительное увеличение внутричерепного давления (гидроцефалия);
- Частое употребление алкоголя, наркотические средства;
- Инфекционное поражение коры мозга (ретровирусы, полиомиелит, энцефалит);
- Черепно-мозговая травма;
- Сосудистые заболевания (тромбоз, атеросклероз, аневризма);
- Метаболические состояния;
- Психические болезни – Альцгеймера, синдрома Иценко-Кушинга, Паркинсона, Уиппла, Геллервордена-Шпатца.
Увеличивает вероятность нозологии – метаболические расстройства, родовые травмы, половые инфекции, недостаток витаминов группы B, фолиевой кислоты.
Основные причины возникновения атрофии коры мозга
Научные исследования показывают высокую вероятность поражения кортикальных и субкортикальных структур у людей 50-55 лет из-за генетической предрасположенности. Кортикальная атрофия развивается у пациентов, страдающих наследственной хореей Хантингтона.
Другие причины:
- Черепно-мозговые травмы, сопровождающиеся гематомой, гибелью нейронов, формированием кист;
- Хронический алкоголизм, наркомания, прием некоторых медикаментов обеспечивает уменьшение толщины полушарий мозга, подкоркового шара. Длительная спиртовая интоксикация нарушает внутриклеточный метаболизм, обеспечивает постепенное отмирание нейронов;
- Хроническую церебральную (мозговая) ишемию формируют сосудистые заболевания (атеросклероз, гипертоническая болезнь). Недостаток поступления кислорода способствует необратимой гибели тканей;
- Врожденная гидроцефалия у новорожденных приводит к повышению внутричерепного давления, атрофии мозгового вещества;
- Более семидесяти процентов случаев заболевания у людей старше 55 лет приходится на долю нейродегенеративных заболеваний – Пика, Леви, Альцгеймера, Паркинсона. Нозологии формируют старческое слабоумие.
Менее частые этиологические факторы нозологии – гипоксия новорожденных, гидроцефалия, множественные врожденные кисты у ребенка.
Причины церебральной атрофии новорожденных
Основным этиологическим фактором уменьшения толщины полушарий новорожденных является внутриутробная гипоксия, проблемы во время родов. Повреждения головы малыша при прохождении по родовым путям провоцируют черепно-мозговую травму, способствуют появлению гидроцефалии (водянки).
Причины атрофических церебральных изменений новорожденных:
- Повреждение костей черепа;
- Увеличение количества спинномозговой жидкости (гидроцефалия);
- Внутриутробные инфекции (цитомегалия, герпес, менингит).
Не существует эффективных методов лечения атрофии новорожденных. Своевременное выявление с помощью МРТ позволяет назначить поддерживающую терапию, уменьшить прогрессирование заболевания. Умеренные изменения коррелируются медикаментозной терапией. Ребенок сможет посещать детский сад, учиться в специальной школе.
Причины заболевания
Разбираясь в теме, что такое атрофия, протекающая в головном мозге, необходимо отметить – это всегда вторичный диагноз, который развивается на фоне длительных поражающих воздействий на центральную нервную систему. Врачи называют несколько причин, почему отмирают клетки головного мозга:
- Генетическая предрасположенность. Самый важный фактор.
- Интоксикация организма, повторяющаяся с высокой частотой, связанная с употреблением спиртосодержащих напитков, наркотических средств.
- Травмы черепа и мягких тканей внутри черепной коробки.
- Недостаточность кровоснабжения тканей, ишемия мозга.
- Хроническая анемия – недостаточное снабжение кислородом. Состояние возникает в результате низкой концентрации в крови белка гемоглобина и клеток крови эритроцитов, которые доставляют в ткани кислород.
- Инфекции, поражающие нервную систему – полиомиелит, менингит, болезнь Куру, лептоспироз, абсцесс мозговой ткани.
- Заболевания сердечно-сосудистой системы – ишемия сердечной мышцы, сердечная недостаточность, атеросклеротические патологии сосудов.
- Декортикация вследствие комы.
- Внутричерепное давление. Часто является причиной церебеллярной атрофии у новорожденных.
- Опухоли большого размера, сдавливающие окружающие ткани и препятствующие нормальному кровоснабжению отделов мозга.
- Цереброваскулярная болезнь – деструктивные изменения в сосудах, расположенных в головном мозге.
Если человек избегает мыслительной деятельности, риск развития атрофических заболеваний, протекающих в головном мозге, повышается. В числе факторов, которые повышают вероятность отмирания нейронов, расположенных в головном мозге – курение, низкие умственные нагрузки, артериальная гипертензия в хронической форме, гидроцефалия, длительный прием препаратов, сужающих кровеносные сосуды.
Почему развивается
Естественно, многих интересует, каковы причины развития таких дегенеративных процессов. Риски уменьшения мозга и ухудшения ситуации с ним увеличиваются в более старшем возрасте. Триггерами для атрофии становятся:
- почечная недостаточность;
- длительно повышенное внутричерепное давление;
- злоупотребление алкоголем и приемом запрещенных препаратов;
- инфекции коры мозга, например полиомиелит, энцефалит и другие;
- черепно-мозговая травма;
- заболевания сосудов, например атеросклероз, аневризмы;
- сбои метаболизма;
- наличие психических заболеваний, в пожилом возрасте это может быть болезнь Альцгеймера, а также такое нейродегенеративное состояние — болезнь Паркинсона.
- родовые травмы, нехватка витаминов группы В и фолиевой кислоты;
- наследственность.
Отпусти и не забудь. Как организм спасает память при плохом кровоснабжении Подробнее
Диагностика
Чтобы определить, после чего бывают случаи появления атрофированных участков мозговой ткани, назначаются диагностические исследования. Сложность диагностики на ранних этапах препятствует проведению корректного, своевременного лечения и полному восстановлению функций. В ходе осмотра врач определяет уровень рефлексов и реактивность – способность реагировать на внешние раздражители. Инструментальные и аппаратные методы:
- МРТ, КТ. Позволяет выявлять кистозные и опухолевые образования, гематомы, локальные очаги поражений.
- УЗИ, нейросонография – у новорожденных детей.
- Допплерография. Выявляет состояние и проходимость элементов сосудистой системы.
- Ангиография – рентгенологическое исследование сосудов.
Нейрофизиологические исследования, в том числе электроэнцефалография (определение степени активности мозга), реоэнцефалография (определение состояния мозгового кровообращения), диагностические пункции, проводятся с целью выявления причин, которые привели к поражению клеток, составляющих мозговую ткань.
Лечение, назначаемое при атрофии мозга
Полностью вылечить невозможно. Комплексная терапия проводится с целью восстановления нормальной работы нервной системы, регуляции обменных процессов, протекающих в клетках мозгового вещества, нормализации кровотока и кровоснабжения тканей. Болезнь лечится консервативными методами. Корректная медикаментозная терапия тормозит развитие заболевания. С учетом симптомов врач-невролог назначает препараты групп:
- Седативные (успокоительные) средства.
- Транквилизаторы.
- Антидепрессанты.
- Ноотропные средства, стимулирующие мыслительные способности.
- Нейропротекторы, которые защищают нейроны от повреждений.
- Гипотензивные препараты и антиагреганты, понижающие артериальное давление и улучшающие показатели крови.
Одновременно с медикаментозной терапией поддерживается режим. Пациенту показаны прогулки на свежем воздухе, дозированные физические нагрузки, здоровое, сбалансированное питание, занятия, связанные с мыслительной деятельностью, для улучшения умственных способностей, тренировка памяти.
Профилактика
Патология часто является следствием артериальной гипертензии и атеросклероза. С целью предотвращения негативных последствий рекомендуется своевременно лечить болезни, которые провоцируют атрофические процессы в тканях мозгового вещества. Врачи советуют отказаться от вредных привычек, вести здоровый образ жизни, нагружать мозг логическими задачами, стимулировать интеллектуальную деятельность.
Атрофия мозга – длительно текущий патологический процесс, который при отсутствии корректной терапии ведет к деменции, инвалидности, полной зависимости от обслуживающего персонала. Нередко больному требуется госпитализация. Чтобы своевременно выявить и остановить развитие болезни, при первых тревожных симптомах лучше обратиться к неврологу.