Патологическое состояние, которое сопровождается уменьшением размера, объема и веса целого органа или его отдельных участков с постепенным прекращением функционирования, называется атрофией.
Это заболевание может поражать различные органы и ткани, в частности, мышцы, головной мозг, конечности, сетчатку глаза, кожу. Атрофия может развиться в результате заболеваний, а также как часть естественного процесса старения человека. В связи с этим выделяют старческую и патологическую атрофию.
Симптомы
В зависимости от характера поражения, локализации, степени выраженности и распространенности, проявляются различные симптомы заболевания. Так, для общей мышечной атрофии характерна худоба, потеря мышечной массы, изможденность. Прогрессирование этой патологии приводит к атрофии клеток мозга и внутренних органов.
При атрофии сетчатки глаза наблюдается потеря четкости зрения, а также возможности различать цвета. По мере ухудшения зрения у больного появляются оптические иллюзии и развивается полная слепота. Атрофия кожи характеризуется потерей эластичности, истончением и сухостью.
Вагинальная атрофия: этиологические аспекты и современные подходы к терапии
Постменопауза характеризуется эстрогендефицитным состоянием у женщин, обусловленным возрастным снижением, а затем и прекращением функции яичников [1]. Как известно, любые эпителиальные ткани реагируют на изменение окружающей их гормональной среды сходным образом, но ни одна из них не может сравниться с эпителием свода влагалища и шейки матки по скорости и отчетливости реакции на гормоны, в первую очередь на половые стероиды [2]. Таким образом, урогенитальный тракт особенно чувствителен к снижению уровня эстрогенов и около половины всех женщин в постменопаузе испытывают симптомы, связанные с урогенитальной атрофией (УГА), затрагивающие половую функцию и качество жизни [3]. В клинической картине урогенитальных расстройств в климактерическом периоде выделяют симптомы, связанные с атрофией влагалища (вагинальная атрофия (ВА)), и расстройства мочеиспускания (цистоуретральная атрофия). В отличие от вазомоторных симптомов, которые обычно проходят со временем, симптомы вагинальной атрофии, как правило, возникают в пременопаузе и прогрессируют в постменопаузальном периоде, приводя к функциональным и анатомическим изменениям [4]. У 15% женщин в пременопаузе и 40–57% женщин в постменопаузе отмечаются симптомы ВА [5], такие как сухость влагалища 27–55%, жжение и зуд 18%, диспареуния 33–41%, а также повышенная восприимчивость к инфекционным заболеваниям органов малого таза 6–8% [4], что значительно ухудшает состояние здоровья, негативно влияет на общее и сексуальное качество жизни [6]. У 41% женщин в возрасте 50–79 лет есть хотя бы один из симптомов ВА [10].
Стенки влагалища состоят из трех слоев: внутреннего слоя, который выстлан многослойным плоским эпителием; среднего мышечного и наружного соединительнотканного слоев (или волокнистого слоя). Атрофические процессы, захватывающие соединительнотканные и мышечные структуры влагалища, а также мышцы тазового дна, уретры, мочевого пузыря, особенно выражены в слизистой влагалища. Известно, что у женщин слизистая оболочка влагалища состоит из четырех основных слоев эпителиальных клеток: базальный слой; парабазальный слой (или митотически-активный); промежуточный гликогенсодержащий слой; поверхностный (слущивающийся) [11]. Эстрогеновые рецепторы располагаются в основном в базальном и парабазальном слоях влагалища и практически отсутствуют в промежуточном и поверхностном [10]. Дефицит эстрогенов блокирует митотическую активность базального и парабазального слоев эпителия влагалищной стенки, а следовательно, и пролиферацию влагалищного эпителия [12]. Следствием прекращения пролиферативных процессов во влагалищном эпителии является исчезновение гликогена — питательной среды для лактобактерий, таким образом из влагалищного биотопа полностью элиминируется его основной компонент — лактобациллы [3, 12].
Известно, что перекись-продуцирующие лактобациллы, преобладающие в микробиоцинозе влагалища у женщин репродуктивного возраста, играют ключевую роль в предотвращении появления заболеваний урогенитального тракта [10, 11]. Вследствие расщепления гликогена, который образуется в эпителии влагалища при условии наличия достаточного количества эстрогенов, образуется молочная кислота, обеспечивающая кислую среду влагалища (в пределах колебаний рН от 3,8 до 4,4). Подобный защитный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка влагалища утрачивает эти защитные свойства, истончается, легко травмируется с последующим инфицированием не только патогенными, но и условно-патогенными микроорганизмами.
Эстрогены являются главными регуляторами физиологических процессов во влагалище. Эстрогеновые рецепторы α присутствует во влагалище в пременопаузе и постменопаузе, в то время как эстрогеновые рецепторы β полностью отсутствуют или имеют низкую экспрессию в вагинальной стенке у женщин в постменопаузе. Наиболее высокая плотность эстрогеновых рецепторов наблюдается во влагалище и уменьшается по направлению от внутренних половых органов к коже. Плотность андрогеновых рецепторов, наоборот, низкая во влагалище и более высокая в области наружных половых органов. Рецепторы прогестерона встречаются только во влагалище и эпителии вульвовагинального перехода [10]. Поскольку в клетках стромы влагалища содержатся рецепторы к эстрогенам, то коллаген, входящий в состав соединительной ткани влагалищной стенки, является эстроген-чувствительной структурой, содержание которого уменьшается по мере прогрессирования эстрогенного дефицита. Так как рецепторы к эстрогенам располагаются не только в эпителии и строме влагалищной стенки, но и в эндотелии сосудов, в постменопаузе отмечается снижение кровообращения во влагалище до уровня различной степени ишемии. К тому же эстрогены являются вазоактивными гормонами, которые увеличивают приток крови, стимулируя высвобождение эндотелиальных медиаторов, таких как оксид азота, простагландины и фактор гиперполяризации эндотелия. Подобное прогрессирующее снижение кровотока в слизистой влагалища приводит к гиалинизации коллагеновых и фрагментации эластических волокон, увеличивая количество соединительной ткани [12].
Эстрогеновые рецепторы были также обнаружены на вегетативных и сенсорных нейронах во влагалище и вульве. В исследовании T. L. Griebling, Z. Liao, P. G. Smith было выявлено уменьшение плотности сенсорных ноцицептивных нейронов во влагалище на фоне лечения эстрогенами. Эта особенность может быть полезна в целях устранения дискомфорта, связанного с ВА, а именно в облегчении симптомов, таких как жжение, зуд и диспареуния, с которыми сталкиваются многие женщины в постменопаузе [5, 10].
Атрофия слизистой вульвы и влагалища характеризуется истончением эпителия, уменьшением вагинальной складчатости, побледнением, наличием петехиальных кровоизлияний, признаков воспаления. Также вследствие инволютивных изменений происходит потеря упругости тканей, подкожно-жировой клетчатки и выпадение лобковых волос, снижение секреторной активности бартолиниевых желез [3, 13, 14]. Как правило, врачи диагностируют атрофию вульвы и влагалища на основании сочетания клинических симптомов и визуального осмотра. Исследователи все чаще настаивают на более объективных и воспроизводимых способах диагностики, не исключая субъективные жалобы пациента [13]. Исторически сложилось, что для диагностики ВА необходимы два основных объективных способа диагностики и оценки эффективности лечения: рН влагалища, а также подсчет вагинального индекса созревания (ВИС, преобладание клеток базального и парабазального слоев) [12, 13]. Интересно, что степень атрофических изменений, измеряемая индексом созревания, не всегда коррелирует с симптомами [15]. В исследовании, проведенном среди 135 менопаузальных женщин-добровольцев, которые прошли оценку симптомов, а затем рейтинг «вагинального здоровья» (оценка цвета влагалища, выделений, целостности и толщины эпителия, рН) и измерение индекса созревания, исследователи обнаружили слабую корреляцию между физическими проявлениями и индексом созревания.
Гормональные изменения, происходящие в течение жизненного цикла, оказывают влияние на вагинальную флору начиная от момента рождения до периода постменопаузы. Снижение эстрогенов в перименопаузе и постменопаузе приводит к уменьшению количества лактобактерий и изменению флоры в целом. Согласно данным S. L. Hillier, R. J. Lau, при детальном анализе микрофлоры влагалища 73 женщин в постменопаузе, не принимавших гормональную терапию, в 49% случаев не было выявлено лактобацилл. А среди тех, у которых они обнаруживались, концентрация последних была в 10–100 раз меньше, чем у женщин в пременопаузе [15]. В постменопаузе наиболее распространенными микроорганизмами являлись анаэробные грамотрицательные палочки и грамположительные кокки.
Несмотря на вышесказанное, у некоторых женщин симптомы атрофии прогрессируют вскоре после наступления менопаузы, а у других они не возникают даже в более поздние годы. Среди факторов, которые могут увеличить риск развития урогенитальной атрофии, курение является одним из наиболее изученных. Курение оказывает прямое воздействие на плоскоклеточный эпителий влагалища, снижает биодоступность эстрогена и уменьшает перфузию крови. Другими гормональными факторами, которые, как правило, имеют значение, являются уровни различных андрогенов, таких как тестостерон и андростендион. Предполагают, что после менопаузы у женщин с более высоким уровнем андрогенов, которые поддерживают сексуальную активность, отмечено меньше изменений, связанных с атрофией [12]. Кроме того, ВА наблюдается чаще у женщин, которые никогда не рожали через естественные половые пути [16].
Принимая во внимание патогенез заболевания, терапия эстрогенами является золотым стандартом лечения. Все клинические рекомендации по лечению УГА сходятся во мнении, что наиболее распространенным и эффективным методом лечения является системная или локальная гормональная терапия эстрогенами в различных формах, так как она достаточно быстро улучшает индекс созревания и толщину слизистой оболочки влагалища, снижает рН влагалища и устраняет симптомы ВА [3, 11–13]. Для лечения УГА, сочетающейся с симптомами климактерия, используют системную гормональную терапию. В остальных случаях отдают предпочтение местному лечению, которое позволяет избежать большинства системных побочных эффектов [12, 13]. Исследования показали, что системная заместительная гормональная терапия устраняет симптомы ВА в 75% случаев, в то время как локальная терапия — в 80–90%.
Эстрогенсодержащие препараты для локального применения, представленные в форме крема, таблеток, пессариев/суппозиториев, вагинального кольца, могут содержать эстриол, конъюгированные эквинэстрогены, эстрадиол или эстрон. Из трех природных эстрогенов человеческого организма эстриол имеет самый короткий период полувыведения и наименьшую биологическую активность. В России имеется многолетний опыт локального применения эстриолсодержащих препаратов, обладающих выраженным кольпотропным эффектом. Учитывая слабое пролиферативное действие на эндометрий при использовании эстриола, дополнительное введение прогестагена не требуется. Многочисленные исследования показали, что ежедневное применение эстриола в дозе 0,5 мг оказывает заметный пролиферативный эффект на эпителий влагалища. Локальное применение эстриолсодержащих препаратов является безопасным и эффективным подходом к предотвращению и лечению ВА, не имеющим ограничений по возрастному аспекту и длительности лечения. В настоящее время в европейских странах отмечается тенденция к локальному использованию низких доз для эстрогенов эстриола и эстрадиола.
В 2006 г. в Кокрановском систематическом обзоре были проанализированы 19 клинических испытаний, в которых приняли участие 4162 женщины в постменопаузе, распределенные по группам, в зависимости от принимаемого вагинально препарата с эстрогенами, а конечной точкой в исследовании была оценка эффективности, безопасности и приемлемости терапии. Четырнадцать исследований сравнивали безопасность различных препаратов, семь акцентировали внимание на побочных эффектах и четыре на безопасности лечения и воздействии на эндометрий. Семь исследований включали плацебо-группы, и во всех показано улучшение состояния пациентов, принимающих гормональную терапию (табл.).
Результаты анализа показывают, что вагинальные таблетки с эстрадиолом более эффективны по сравнению с вагинальным кольцом и что оба варианта лечения превосходят плацебо в устранении диспареунии, сухости и зуда во влагалище. Вагинальный крем с конъюгированными лошадиными эстрогенами (КЛЭ) превосходит увлажняющие кремы в устранении сухости, повышении эластичности и объема кровотока во влагалище. Однако не было обнаружено никаких различий между тремя проанализированными препаратами терапии (крем с КЛЭ, таблетки с эстрадиолом и эстрадиол-рилизинг-кольцо) по отношению к количеству парабазальных клеток, кариопикнотическому индексу, индексу созревания и вагинальному индексу здоровья. К тому же также сообщаются данные об отсутствии значительных различий в толщине эндометрия, гиперплазии и количестве побочных эффектов между вагинальным кольцом, кремом или таблетками. Тем не менее, незначительный риск вагинальных кровотечений был описан во всех исследованиях, в которых применялись различные методы местной терапии эстрогенами, а также возможное увеличение риска развития кандидоза [16].
В результате метаанализа, проведенного Cardozo и соавт., показано, что вагинальный путь введения эстрогенов является эффективным методом лечения ВА. Комбинация местной и системной терапии позволяет достичь результатов в более сжатые сроки. Кроме того, низкие дозы местных эстрогенов: эстрадиола или эстриола так же эффективны, как и при системном введении. Было показано, что трансдермальный пластырь с ежедневной дозой в 14 мкг эстрадиола обладает аналогичным воздействием на рН влагалища и на индекс созревания, как и вагинальное кольцо с 7,5 мкг эстрадиола [17].
Положительный терапевтический эффект местной гормональной терапии был также отмечен в ситуациях, выходящих за рамки лечения ВА, а именно таких, как снижение риска рецидивирующих инфекций мочевыводящих путей и развития гиперактивного мочевого пузыря. С учетом вышеизложенного, эстрадиол-рилизинг-кольцо было одобрено в качестве лечения дизурии и ургентного недержания мочи. В то время как системная гормональная терапия, наоборот, увеличивает процент возникновения стрессового недержания мочи и почечных камней [10].
Таким образом, местная терапия имеет ряд преимуществ по сравнения с системным введением препаратов. Она позволяет избежать первичный метаболизм в печени, минимально воздействует на эндометрий, имеет низкую гормональную нагрузку, минимальные побочные эффекты, не требует добавления прогестагенов, оказывает в основном локальный эффект.
С практической точки зрения и в связи с аналогичной эффективностью и безопасностью всех местных препаратов с эстрогенами, пациентка должна иметь возможность выбрать препарат, который она считает наиболее подходящим для нее. Она должна быть проинформирована о том, что эффект достигается после одного-трех месяцев лечения. Дополнительное назначение прогестагенов не является обязательным при использовании локальных форм эстрогенов [18]. В обзоре за 2009 г., посвященном местной гормональной терапии, говорится, что ни в одном исследовании не наблюдали пролиферацию эндометрия после 6–24 месяцев использования эстрогенов, так что литература, таким образом, дает уверенность относительно безопасности малых доз вагинальных препаратов с эстрогенами и не поддерживает одновременное применение системных прогестагенов для защиты эндометрия [13].
Помимо перечисленных выше методов лечения ВА на сегодняшний момент существуют такие, как терапия с использованием дегидроэпиандростерона, селективных тканевых эстрогеновых комплексов, селективных модуляторов эстрогеновых рецепторов и негормональные методы лечения, а также комбинированные препараты, содержащие ультранизкодозированный эстриол и лактобактерии.
В работе U. Jaisamrarn и соавт. впервые оценивалась эффективность и переносимость ультранизких доз эстриола (0,03 мг) в сочетании с жизнеспособными Lactobacillus acidophilus в краткосрочной и долгосрочной перспективе лечения симптомов ВА. Было выявлено, что комбинация эстриола и лактобактерий в течение 12 недель была достаточна для достижения статистически и клинически значимых результатов, включающих улучшение объективных параметров (ВИС, рН, доля латобактерий в микрофлоре влагалища), а также качество жизни женщин [19].
Большое количество публикаций посвящается использованию интравагинального геля дегидроэпиандростерона (DHEA) для лечения ВА [8]. DHEA является предшественником половых гормонов, который в дополнение к тестостерону и эстрогенам производится надпочечниками и яичниками. В дальнейшем он подвергается биотрансформации в периферических тканях: в головном мозге, костях, молочных железах и яичниках. На сегодняшний день специфические рецепторы DHEA не найдены, в связи с чем существует предположение, что его действие происходит путем конвертации в андрогены и/или эстрогены и взаимодействия с их рецепторами соответственно. На сегодняшний день большая часть данных благотворного влияния DHEA, введенного вагинально, приведенных в пяти публикациях, взяты из одного рандомизированного исследования, проведенного Labrie и его коллегами. DHEA использовали вагинально 218 женщин в постменопаузе в течение 12 недель. Женщины были распределены по группам: плацебо, принимающие 0,25% (3,25 мг), 0,5% (6,5 мг) или 1,0% (13 мг) вагинальный крем ежедневно. У пациенток, получавших терапию DHEA, вагинальная атрофия исчезла, в то время как наблюдались минимальные изменения уровней стероидных гормонов в сыворотке крови, которые оставались в пределах нормального диапазона, характерного для постменопаузы. Также в данном исследовании было отмечено положительное влияние на четыре аспекта сексуальной функции: желание/интерес, возбуждение, оргазм и диспареуния. Крем с 0,5%-м (6,5 мг) DHEA оказался оптимальным для лечения вагинальной атрофии и существенно не повлиял на сывороточный уровень эстрогенов [20].
Среди селективных модуляторов эстрогеновых рецепторов (SERM) оспемифен является наиболее современным лекарственным средством. В 12-недельном трехфазном рандомизированном исследовании с участием 826 женщин в постменопаузе изучали эффективность данного препарата в дозе 30 мг, 60 мг по сравнению с плацебо. К 4-й и 12-й неделям оспемифен в указанных ранее дозах показал статистически значимое увеличение количества поверхностных клеток, снижение парабазальных клеток и рН во влагалище по сравнению с плацебо. Сухость влагалища значительно снизилась как в группах с 30 мг и 60 мг по сравнению с плацебо к 12-й неделе, в то время как диспареуния уменьшилась только в группе, получавшей препарат в дозе 60 мг. В ходе исследования было выявлено, что побочный эффект препарата, проявляющийся в виде приливов, наблюдался у 9,6%, 8,3% и 3,4% участников в группах, получавших оспемифен в дозе 30 мг, 60 мг и плацебо соответственно. Толщина эндометрия от исходного уровня к 12-й неделе в среднем изменилась на 0,42 мм, 0,72 мм и 0,02 мм у участниц выше представленных групп соответственно [21].
Комбинация конъюгированных эстрогенов и базедоксифена — селективного модулятора эстрогеновых рецепторов, известная как тканевой селективный эстрогенный комплекс (TSEC), изучалась в исследовании 3-й фазы, где 601 женщина была распределена по группам в зависимости от ежедневной получаемой терапии: 20 мг базедоксифена плюс конъюгированные эстрогены 0,45 мг (BZA/CE), или базедоксифен 20 мг плюс 0,625 мг конъюгированные эстрогены, или 20 мг базедоксифена и плацебо. В ходе исследования было выявлено увеличение доли поверхностных клеток и уменьшение доли парабазальных от исходного уровня к 12-й неделе в большей степени в группе BZA/CE по сравнению с плацебо и только BZA. РН влагалища существенно не изменился по сравнению с исходным к окончанию исследования в группе BZA или плацебо, но значительно уменьшились в обеих группах BZA/CE. Тем не менее, снижение рН влагалища было значимо ниже в группе BZA/CE 20 мг/0,625 мг, чем в плацебо-группе. Самые «назойливые» симптомы значительно уменьшились к 12-й неделе по сравнению с плацебо в группе BZA/СЕ 20 мг/0,625 мг, но не в группе BZA/СЕ 20 мг/0,45 мг. Не отмечено каких-либо существенных различий в побочных эффектах или случаях прекращения участия в исследовании между группами. Однако была отмечена более высокая заболеваемость вагинитами в группах лечения (BZA/CE) по сравнению с плацебо [22]. Таким образом TSEC, а именно базедоксифен в сочетании с конъюгированными эстрогенами представляет собой альтернативу терапии прогестинами для защиты эндометрия от стимуляции эстрогенами, при сохранении благоприятного воздействия эстрогенов на симптомы, связанные с менопаузой.
Несмотря на перечисленные методы лечения ВА, не стоит забывать о профилактике заболевания. Сохранение регулярной половой жизни рекомендуется, в общем, всем женщинам и, в частности, женщинам в менопаузе. Это связано с тем, что половой акт улучшает циркуляцию крови во влагалище, и семенная жидкость также содержит половые стероиды, простагландины и незаменимые жирные кислоты, которые способствуют сохранению вагинальной ткани [12].
Хотя официальная распространенность атрофии влагалища меняется в зависимости от численности и индивидуальных особенностей изучаемого населения, все большее число женщин страдают от этого состояния по мере старения населения. Одно из исследований, проведенное зарубежными коллегами, показало, что более 60% женщин испытывают симптомы ВА спустя 4 года после наступления постменопаузы. При этом всего лишь 4% женщин в возрасте 55–65 лет связывают вышеуказанные жалобы с атрофией влагалища, 37% знают, что это симптомы обратимы, и 75% женщин считают, что симптомы ВА негативно влияют на их жизнь. Учитывая деликатный характер этих симптомов, пациентки не решаются обратиться за медицинской помощью и, следовательно, страдают от прогрессирующих симптомов [10, 23]. Лишь 25% женщин с симптомами вагинальной атрофии обращаются за медицинской помощью. ВА является хроническим и прогрессирующим состоянием [10]. Значительное число женщин с симптомами ВА даже не представляют, что существует возможность эффективного лечения. Своевременное информирование пациентов о причинах возникновения вышеуказанных симптомов и возможностях их устранения может позволить в короткие сроки улучшить состояние женщин, возвратить им интерес к жизни и ее качество. Таким образом, проблема сохранения здоровья и профилактики заболеваний, обусловленных старением, приобрела в последние годы особое значение. В связи с ее актуальностью в настоящее время проводится разработка и внедрение новых лекарственных препаратов для лечения ВА, что позволит индивидуализировать подход к лечению пациентов.
Литература
- Вихляева Е. М. Руководство по гинекологической эндокринологии. М.: Медицинское информационное агентство, 1997. С. 227–360.
- Урогенитальные расстройства в климактерии (клиника, диагностика, заместительная гормонотерапия). Дис. д-ра мед. наук. М., 1998.
- Santiago Palacios. Managing urogenital atrophy // Maturitas. 2009; 63: 315–318.
- Sinha A., Ewies A. A. A. Non-hormonal topical treatment of vulvovaginal atrophy: an up-to-date overview // Climacteric. 2013; 16: 305–312.
- Griebling T. L., Liao Z., Smith P. G. Systemic and topical hormone therapies reduce vaginal innervation density in postmenopausal women // Menopause. 2012; 19: 630–635.
- Frank S. M., Ziegler C., Kokot-Kierepa M., Maamari R., Nappi R. E. Vaginal Health: Insights, Views & Attitudes (VIVA) survey — Canadian cohort // Menopause Int. 2012.
- Rosano G. M. C., Vitale C., Silvestri A., Fini M. Metabolic and vascular effect of progestins in postmenopause // Maturitas. 2003; 46: 17–29.
- Hextall E. Esrogens in the funtion uretral tract // Maturitas. 2000; 36: 83–92.
- Манухин И. Б., Тумилович Л. Г., Геворкян М. А. Клинические лекции по гинекологической эндокринологии. М., 2003.
- Management of symptomatic vulvovaginal atrophy: 2013 position statement of The North American Menopause Society // The North American Menopause Society. 2013; 20 (9): 888–902.
- James H. Pickar. Emerging therapies for postmenopausal vaginal atrophy // Maturitas. 2013; 75: 3–6.
- Camil Castelo-Branco, Maria Jes´us Cancelo, Jose Villero, Francisco Nohales, Maria Dolores Juli´a. Management of post-menopausal vaginal atrophy and atrophic vaginitis // Maturitas. 2005; 52: 46–52.
- Sturdee D. W., Panay N. Recommendations for the management of postmenopausal vaginal atrophy // Climacteric. 2010; 13: 509–522.
- Basaran M., Kosif R., Bayar U., Civelek B. Characteristics of external genitalia in pre-and postmenopausal women // Climacteric. 2008; 11: 416–421.
- Paul Nyirjesy. Postmenopausal Vaginitis. Current Infectious Disease Reports. 2007; 9: 480–484.
- Suckling J., Lethaby A., Kennedy R. Local oestrogen for vaginal atrophy in postmenopausal women // Cochrane Database Syst Rev. 2006.
- Gupta P., Ozel B., Stanczyk F. Z., Felix J. C., Mishell Jr. D. R. The effect of transdermal and vaginal estrogen therapy on markers of postmenopausal estrogen status // Menopause. 2008; 15 (1)): 94–97.
- Pitkin J., Rees M. British Menopause Society Council. Urogenital atrophy // Menopause Int. 2008; 136–137.
- Jaisamrarn U., Triratanachat S., Chaikittisilpa S., Grob P., Prasauskas V., Taechakraichana N.. Ultra-low-dose estriol and lactobacilli in the local treatment of postmenopausal vaginal atrophy // Climacteric. 2013; 16: 347–355.
- Labrie F., Archer D. F., Bouchard C. et al. Intravaginal dehydroepiandrosterone (prasterone), a highly efficient treatment of dyspareunia // Climacteric. 2011; 14: 282–288.
- Bachmann G. A., Komi J. O. The Ospemifene Study Group. Ospemifene effectively treats vulvovaginal atrophy in postmenopausal women: results from a pivotal phase 3 study // Menopause. 2010; 17 (3): 480–486.
- Kagan R., Williams R. S., Pan K., Mirkin S., Pickar J. H. A randomized, placebo-and active-controlled trial of bazedoxifene/conjugated estrogens for treat-ment of moderate to severe vulvar/vaginal atrophy in postmenopausal women // Menopause. 2010; 17 (2): 281–289.
- Kingsberg S. A., Krychman M. L. Resistance and barriers to local estrogen therapy in women with atrophic vaginitis // J Sex Med. 2013; 1567–1574.
А. В. Глазунова С. В. Юренева1, доктор медицинских наук, профессор
ФГБУ НЦ АГиП им. В. И. Кулакова МЗ РФ, Москва
1 Контактная информация
Abstract. According to forecasts to 2030 there will be 1,2 bln women in postmenopause. The state of oestrogen deficit in climacterical period cause vaginal atrophy with 15–57% of women. The latest data on the problem of pathogenesis, clinical manifestations and therapy of this state are provided in review.
Причины
Атрофия — это приобретенный процесс, при котором происходит усыхание тканей и органов.
Для общей атрофии провоцирующими факторами являются:
- онкологические заболевания;
- недостаток питательных веществ;
- поражения гипоталамуса;
- инфекционные заболевания, которые протекают на протяжении длительного времени;
- эндокринные нарушения.
К причинам местной атрофии относятся:
- радиационное облучение;
- давление на орган или его часть;
- нагрузки на мышцы, ограничение двигательной активности;
- тяжелая интоксикация организма на фоне серьезных инфекций;
- продолжительный прием гормональных препаратов;
- иннервация;
- нарушение кровообращения вследствие ишемических поражений артерий и вен;
- наследственность;
- дисгормональные нарушения.
Показания
К показаниям лечения относятся:
- наличие одного или нескольких симптоматических проявлений;
- травмы головы или механические повреждения глаза;
- регулярно возникающие головные боли;
- головокружения, частичная потеря зрения;
- помутнение в глазах;
- возникающая усталость глаз.
Если у Вас есть показания, стоит обращаться в специализированный центр, в котором окажут помощь. Не теряйте времени, звоните в нашу клинику и записывайтесь на прием к офтальмологу.
Диагностика
В каждом конкретном случае диагностические мероприятия различаются. На начальном этапе при любом типе атрофии лечащий врач назначает физикальное обследование, включающее сбор анамнеза, пальпацию, визуальный осмотр и прочие процедуры. Во всех случаях необходимо проведение лабораторного исследования. Последующая диагностика отличается. Например, для выявления атрофии органа выполняют УЗ-диагностику, МРТ или КТ, рентгенографию, сцинтиграфию, фиброгастродуоденоскопию и прочие процедуры. Основной диагностикой атрофии мышц является биопсия и электромиография. Лабораторная диагностика состоит из оценки определенных показателей в биохимическом и общем анализе крови.
Какие могут быть последствия атрофии?
Потеря зуба чревата не только косметическими, т.е. эстетическими дефектами. Возникают и функциональные нарушения. Ведь здоровым зубам приходится принять на себя излишнюю нагрузку во время пережевывания пищи. А значит они гораздо быстрее разрушаются. Кроме того, все зубы в ряду смещаются, становятся подвижными – ведь у некоторых из них отсутствует боковая опора. В целом нарушается прикус, мимика, появляются морщины. Губы западают внутрь рта, возникают проблемы с произношением различных звуков, ведь у языка исчезает опора в виде зубов, наблюдается уменьшение нижней части лица, развивается дряблость жевательных и мимических мышц2. Кроме того, страдают органы пищеварения, поскольку человек чаще всего переходит на более мягкую пищу, поскольку чрезмерно твердую прожевать слишком сложно.
Варианты решения проблемы убыли кости
Основное решение проблемы убыли кости – это, конечно же, ее недопущение, т.е. профилактика. Это означает, что после удаления зуба нужно озаботиться вариантом его оперативного восстановления или защиты костной ткани от усадки. О первом варианте речь пойдет ниже, а вот второй подразумевает установку защитных барьерных мембран. Они устанавливаются в лунку удаленного зуба, при необходимости внутрь добавляется немного искусственной кости. Так удается восполнить недостающий объем кости, благодаря чему получится провести имплантацию зуба без применения процедуры наращивания (но это при условии, что не было возможности установить имплант сразу, т.е. в момент удаления зубного корня).
Итак, когда пациент сталкивается с такой проблемой, как атрофия, то восстановление костной ткани можно выполнить следующими методами:
- синус-лифтинг: проводится исключительно на верхней челюсти и позволяет выполнить поднятие или смещение гайморовой пазухи для того, чтобы высвободить место под новую кость. Данная операция применима только для изменения высоты челюстной кости,
- костная пластика искусственными материалами: в этом случае костная ткань челюсти расщепляется, а высвобожденное пространство заполняется синтетической костью,
- метод подсадки костных блоков: для данной процедуры используется собственный костный материал пациента, извлекаемый, как правило, из нижней челюсти (из зоны зубов мудрости). Десна разрезается, выпиливается костный блок нужного размера – он пересаживается на новое место и фиксируется при помощи винтов. Вокруг размещаются костные гранулы, крепится мембрана, защищающая ткани от вымывания.
Наращивание кости – процедура хоть и не сложная для опытного хирурга, но весьма специфичная (и для пациента в том числе). При пересадке костного блока делается минимум 2 разреза, а значит пациенту придется следить за состоянием сразу нескольких ранок. Плюс дополнительные материальные траты: особенно дорого стоит наращивание большого участка костной ткани.
«Стоимость проведения костной пластики – от 19-20 тысяч рублей. И это без учета самой имплантации. К тому же операция значительно удлиняет процесс лечения – минимум 3-4 месяца должно пройти, прежде чем можно будет использовать нарощенную кость для установки имплантов. Поэтому в своей практике мы применяем методы имплантации, которые позволяют отказаться от костной пластики. Для пациента это экономия и времени, и средств».
Жиленко Евгений Александрович, Хирург-имплантолог, пародонтолог, ортопед Стаж работы более 17 лет записаться на прием
Лечение
Начинать лечение необходимо с устранения основного заболевания, которое спровоцировало появление атрофического процесса. В случае, если склеротические поражения и атрофия не сильно запущены, возможно полностью или частично восстановить функции и структуры пораженного органа или его части. Однако глубокие атрофические поражения не поддаются лечению и коррекции.
На особенности лечения влияют тяжесть, форма, длительность заболевания, а также возраст пациента и индивидуальная переносимость медицинских препаратов. В каждом случае врач подбирает методы лечения индивидуально. Как правило, назначается длительное медикаментозное, физиотерапевтическое и симптоматическое лечение. Курс лечения не должен прерываться, и его необходимо регулярно повторять с учетом рекомендаций лечащего врача.
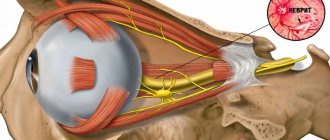
Лечение частичной атрофии зрительного нерва
Принцип этиопатогенетической медицины требует выявления и максимально возможного устранения причин болезни; поскольку оптическая нейропатия гораздо чаще является следствием и проявлением иных заболеваний, нежели автономной и изолированной патологией, терапевтическая стратегия должна начинаться с лечения основного заболевания.
В частности, пациентам с интракраниальной (внутричерепной) онкопатологией, гипертензией, установленными аневризмами сосудов мозга – рекомендуется, прежде всего, нейрохирургическое вмешательство соответствующей направленности.
Консервативное же лечение при атрофии зрительного нерва ориентируется на стабилизацию и сохранение функционального статуса зрительной системы в той степени, в которой это возможно в данном конкретном случае. Так, могут быть показаны различные противоотечные и противовоспалительные мероприятия, в частности, ретро- или парабульбарные инъекции (введение препаратов дексаметазона, соотв., за или рядом с глазным яблоком), капельницы с растворами глюкозы и хлористого кальция, диуретики (мочегонные, напр., лазикс). По показаниям назначаются также инъекции стимуляторов гемодинамики и питания зрительного нерва (трентал, никотинат ксантинола, атропин), никотиновая кислота внутривенно, эуфиллин; витаминные комплексы (особенно важны витамины группы В), экстракты алоэ и стекловидного тела, таблетированный циннаризин, пирацетам и т.п. При глаукоматозной симптоматике применяются средства, снижающие внутриглазное давление.
Рис.7 В лечении заболевания могут использоваться медикаментозные, аппаратные и хирургические методы
Достаточно эффективными при атрофии зрительного нерва являются физиотерапевтические методы, такие как иглорефлексотерапия, лазерная или электростимуляция, различные модификации методики электрофореза, магнитотерапия и т.п.).
Действенным средством является ИНФРАЗВУКОВОЙ ВАКУУМНЫЙ ОФТАЛЬМОМАССАЖЁР АМВО-01, разработанный росссийскими офтальмологами под руководством д.м.н., профессора Сидоренко Е.И. специально для пациентов с поражением сетчатки и зрительного нерва, который может улучшить зрение в два раза[6]. Прибор рекомендован для использования как в условиях медицинского учреждения, так и дома. Он прост в применении, имеет невысокую цену и доставляется производителем по всей России.
ПОДРОБНЕЕ ОБ АМВО-01 НА ОФИЦИАЛЬНОМ САЙТЕ ПРОИЗВОДИТЕЛЯ>>>
Существует и хирургическое лечение атрофических состояний — это процедура реваскуляризации заднего отдела глаза. Её суть сводится к перемещению «на ножке» наружных глазодвигательных мышц или участков склеры с боковой поверхности на задний полюс глаза к центральной зоне сетчатки (макуле) и зрительному нерву. Вместе с ними перемещаются и кровеносные сосуды для дополнительного питания нерва.
Рис.8 Схема хирургического лечения ЧАЗН
При реваскуляризации дополнительно могут использоваться различные дополнения: препараты «Ретиналамин», «Аминион», компоненты собственной крови пациента (плазмы или клеток) и т.д. Операция даёт высокие результаты не только по стабилизации процесса, но и увеличивает остроту и поля зрения, особенно в сочетании с медикаментозной и клеточной терапии.[7]
ПОДРОБНЕЕ О РЕВАСКУЛЯРИЗАЦИИ >>>