Рассеянный склероз — это аутоиммунное заболевание центральной и периферической нервной системы, которое характеризуется диссеминированным формированием демиелинизирующих патологических очагов с возникновением симптоматики в соответствии с их локализацией. До сегодняшнего дня существует множество вопросов касательно данной патологии. Что провоцирует аутоиммунный процесс? Какие патогенетические механизмы лежат в основе заболевания? Как остановить этот процесс? Благодаря многочисленным научным исследованиям удалось изучить многие аспекты данной патологии.
Раньше считалось, что рассеянный склероз поражает в основном людей среднего возраста (30-50 лет). Однако данные мировой статистики указывают на увеличение числа случаев демиелинизирующих заболеваний среди детей. Доля рассеянного склероза в возрастной категории от 0 до 16 лет составляет около 1,2–6% от всех больных.
Основным патогенетическим звеном в развитии рассеянного склероза у детей является нарушение функции иммунной системы. В результате воздействия триггерных факторов запускается каскад аутоиммунных реакции. Синтезированные Т-лимфоциты проникают через гематоэнцефалический барьер и выборочно разрушают миелиновую оболочку нейронов и их аксоны. На месте нормальной нервной ткани образуются фиброзные бляшки. Количество демиелинизирующих очагов и их размеры определяются активностью патологического процесса.
При рассеянном склерозе аутоиммунной агрессии поддаются не только нервные клетки центральной нервной системы, но и периферической. Данное утверждение стало настоящим открытием в неврологии. Если еще несколько лет назад расстройства периферической нервной системы исключали диагноз рассеянного склероза, то сегодня такие варианты течения заболевания научно подтверждены.
Причины возникновения рассеянного склероза
Основным патогенетическим механизмом этого заболевания является сенсибилизация Т-лимфоцитов антигенами миелина и активация аутоиммунных реакций против собственных нервных клеток. Достоверно установить причины данного процесса до сих пор не удалось. Существует несколько предрасполагающих факторов, которые способны инициировать каскад патологического иммунного ответа. К ним относятся:
- Инфекционные агенты. Согласно данной гипотезе, некоторые вирусы (аденовирусы, вирусы герпеса, эпидемического паротита, кори) могут спровоцировать синтез антимиелиновых антител. Генетический материал вирусов представлен цепью нуклеиновых кислот. Некоторые ее участки совпадают с белками миелина. Таким образом антигенпрезентирующие клетки (АПК) воспринимают собственный генетический материал как чужеродный. После обмена информацией АПК и Т-клеток запускается аутоиммунная реакция против миелиновой оболочки нейронов и олигодендроглии, а в патологическом очаге синтезируются воспалительные цитокины (интерлейкин-2, фактор некроза опухолей, гамма-интерфероны), которые и приводят к деструктивным процессам.
- Наследственность. Согласно статистическим данным, риск возникновения рассеянного склероза у ребенка, в семье которого был случай данного заболевания, выше, чем в общей популяции.
- Факторы окружающей среды. Результаты некоторых исследований подтверждают тот факт, что рассеянный склероз чаще встречается у жителей отдаленных от экватора географических поясов. Это объясняется низким количеством витамина Д у представителей европеоидной расы по сравнению с жителями экваториальных областей.
- Вакцинация детей против гепатита В и стрессовые факторы не являются достоверными причинами активизации аутоиммунной агрессии.
Вирусные инфекции
Влияние инфекционных агентов является одним из основополагающих в развитии РС, однако до настоящего момента точно не изучен механизм влияния.
Нет данных, позволяющих считать РС прямым следствием какого-либо определенного перенесенного заболевания. В то же время существуют доказательства, что некоторые возбудители инфекций могут послужить пусковым моментом в развитии рассеянного склероза: ретровирусы, вирусы кори, герпеса, краснухи, эпидемического паротита, вирус Эпштейна-Барр. Есть данные и о возможном влиянии стафилококковой инфекции [6, 7].
Уровень распространенности:
Виды рассеянного склероза
Данное заболевание у детей классифицируют по клиническому течению заболевания:
- Ремиттирующий-рецидивирующий вариант течения. Эпизоды нарастания неврологического дефицита заболевания сменяются периодами частичного или полного восстановления. При обострении неврологический дефицит нарастает постепенно, в течение нескольких дней — нескольких недель, экзацербация достигает фазы плато, а затем нарушенные функции постепенно восстанавливаются в течение нескольких недель или месяцев. В некоторых случаях обострение достигает своего максимума в течение нескольких минут или часов. Следует отметить, что в рамках такого течения заболевания у некоторых больных возникшая симптоматика разрешается не полностью, и с годами неврологический дефицит нарастает.
- Первично-прогрессирующий вариант течения. После дебюта заболевания наблюдается постепенное прогрессирование патологии. В клинической картине возможны «светлые промежутки».
- Вторично-прогрессирующий вариант течения. На фоне чередования периодов ремиссии и рецидива наблюдается вторичное нарастание клинических проявлений заболевания.
- Прогрессирующее течение с периодами обострения. Нарастание клинических признаков болезни начинается с первых ее проявлений. Прогрессирующее течение сопровождается тяжелыми периодами обострения.
У 5—10% пациентов с рассеянным склерозом (РС) первые клинические признаки заболевания появляются в детском и подростковом возрасте [1—5]. У таких пациентов применяются препараты для иммуномодулирующего лечения РС как первой, так и второй линии выбора [6—9]. Тем не менее большинство препаратов для лечения РС в педиатрической популяции используется в режиме «off-label», так как бо́льшая их часть, в том числе средства, изменяющие течение РС (ПИТРС), проходили клинические испытания только при лечении взрослых больных. В ряде стран применение иммуномодулирующих препаратов для лечения РС разрешено только с 12 лет и старше.
В свете регистрации первого таблетированного иммуномодулирующего препарата для лечения РС (финголимод одобрен к применению в США, Европе и России в 2010 г., в Канаде и Австралии в 2011 г.), а также на пороге регистрации ряда других новых инъекционных и таблетированных препаратов, в течение ближайших нескольких лет практикующие неврологи будут неизбежно сталкиваться с противоречиями в возрастных рекомендациях по большинству медикаментов, особенно не прошедших официальных испытаний в педиатрической популяции больных. К счастью, недавно, после того как эти вопросы были поставлены перед Европейским (EMA) и Американским (FDA) фармацевтическими агентствами, были разработаны планы по проведению исследований новых фармацевтических препаратов для лечения РС у детей и подростков с целью уточнения спектра возрастных показаний и противопоказаний.
При проведении терапевтических исследований в педиатрической популяции больных РС необходимо учитывать возможность включения сравнительно малого числа больных, и это неизбежно накладывает огромный отпечаток на дизайн исследования и достоверность статистического обсчета. Более того, исследователи в педиатрии сталкиваются с особенностями принятия решений родителями пациентов, что накладывает дополнительные этические обязательства на исследователей, значительно лимитируя клинический опыт использования новых медикаментов по сравнению со взрослой популяцией. Все перечисленное выше явилось причиной создания методических рекомендаций IPMSSG по применению современных иммуномодулирующих препаратов для лечения детского РС с учетом всех специфических медицинских, этических и социальных особенностей детского и подросткового возраста, а также принимая во внимание необходимость и особенности статистического анализа клинической информации.
IPMSSG представляет группу специалистов, работающих в области РС: детских и взрослых неврологов, клиницистов и исследователей, представителей обществ РС и других сопряженных профессиональных и общественных организаций, которые работают на благо повышения качества помощи больным РС и другими демиелинизирующими заболеваниями у детей и подростков1. Члены группы проанализировали доступные данные о клиническом опыте лечения педиатрического РС, результаты опубликованных клинических исследований, используя региональные и международные информационные ресурсы на английском, итальянском, испанском, французском, немецком и русском языках. Изученные исследования были распределены по степени доказательности (классы I—IV), согласно рекомендациям Американской академии неврологии [10]. Объединенные данные были представлены на обсуждение во время конференции, организованной Международной федерацией РС и Канадским обществом РС 26 сентября 2010 г.
Все существующие рекомендации, отражающие консенсусы по лечению больных РС детей и подростков, посвящены только ремиттирующим формам заболевания [11] и не содержат информации по поводу лечения первично-прогрессирующих форм РС у детей, так как данная форма педиатрического РС встречается крайне редко и исследования в данной области ограничиваются единичными клиническими наблюдениями.
Особенности течения РС у детей и подростков
В целом РС с дебютом в детском и подростковом возрасте клинически идентичен РС, дебютирующему во взрослом возрасте. Однако некоторые особенности педиатрического варианта заболевания необходимо учитывать. Для детей на ранних стадиях заболевания характерны в 2—3 раза более частые обострения, нежели для взрослых больных (среднегодовая частота обострений у детей — 1,12—2,76 по сравнению с 0,3—1,78 у взрослых [12]). Приблизительно у 1/3 детей уже на ранних стадиях заболевания выявляются когнитивные нарушения [13, 14]. При длительных клинических исследованиях было выявлено прогрессирование когнитивных расстройств в течение ближайших 2 лет у 75% пациентов [15]. Формирование стойкой инвалидизации по шкале EDSS (Expanded Disability Status Scale) занимает у пациентов с педиатрическим дебютом РС больше времени, чем у взрослых больных [2—18]. Тем не менее раннее начало заболевания приводит к тому, что к этапу накопления стойких неврологических нарушений больные приходят в более раннем возрасте, чем взрослые. Гипотезу о большей выраженности процесса воспалительной демиелинизации у детей и подростков с РС по сравнению со взрослыми подтверждают сравнительные МРТ-исследования [19, 20].
ПИТРС первой линии выбора у больных РС педиатрического возраста
Применение интерферонов-β и глатирамера ацетата у пациентов с ремиттирующим РС
Интерфероны-β и глатирамера ацетат более 15 лет применяются как препараты первой линии выбора у взрослых больных РС, а также широко используются в педиатрической популяции больных на основании результатов исследований I класса доказательности у взрослых пациентов. Опубликован ряд педиатрических исследований с результатами IV класса доказательности в отношении их безопасности и эффективности у педиатрических больных РС [21—29] (табл. 1, 2, 3, 4). Опрос 42 клиницистов в США показал, что все они имели положительный опыт использования ПИТРС первой линии для лечения детей и подростков с РС [30]. В целом ряде других публикаций [31—33] также нашло отражение использование доступных ПИТРС первой линии выбора в педиатрии в качестве стандарта для клинической практики1,2 [68].
Таблица 1. Лечение педиатрического РС ПИТРС первой линии выбора. Обзор педиатрических исследований по применению внутримышечного интерферона β-1a (30 мкг 1 раз в неделю)
Таблица 2. Лечение педиатрического РС ПИТРС первой линии (интерферон-β-1а — подкожно 22 или 44 мкг)
Таблица 3. Лечение Р.С. детского возраста ПИТРС первой линии (интерферон-β-1b подкожно 250 мкг)
Таблица 4. Лечение педиатрического РС ПИТРС первой линии (глатирамера ацетат)
На основе перечисленных фактов IPMSSG рекомендует всем педиатрическим пациентам с достоверным ремиттирующим РС [11] в качестве стандарта первой линии терапии назначать препараты интерферона-β или глатирамера ацетат3.
Применение интерферонов-β и глатирамера ацетата у пациентов с клинически-изолированным синдромом (КИС)
На сегодняшний день опубликованных данных по применению интерферонов-β и глатирамера ацетата у детей с первым демиелинизирующим эпизодом, или КИС, не существует. В то же время ряд исследовательских групп обнаружили, что наличие на МРТ во время первого демиелинизирующего эпизода четко очерченных очагов перевентрикулярной локализации или в мозолистом теле, а также зон локальной атрофии (так называемых черных дыр) в Т1-режиме свидетельствует о высоком риске прогрессирования демиелинизирующего процесса в дальнейшем [34—37]. Есть основания предполагать, что у детей и подростков с КИС и картиной МРТ, указывающей на высокий риск РС, назначение интерферонов β или глатирамера ацетата может отсрочить дальнейшие обострения заболевания. В России на данный момент применение ПИТРС аннотировано только у больных достоверным РС.
Титрация и режим дозирования
Только в 2 опубликованных исследованиях [26, 27] обсуждаются различные режимы дозирования интерферонов-β у детей и подростков с РС, но ни в одной из доступных публикаций нет информации по титрации доз интерферонов-β. В этом случае следует принимать во внимание результаты терапевтических исследований, проведенных с участием взрослых больных, которые показали отсутствие непосредственной зависимости эффективности интерферонов-β от индекса массы тела. Мы рекомендуем при хорошей переносимости препарата титровать интерфероны- β до полной дозы, рекомендованной во взрослой неврологической практике; у детей моложе 12 лет или с дефицитом массы тела может быть использована дозировка 22 мкг интерферона-β-1а для подкожного введения. Глитирамера ацетат во взрослой практике начинают применять непосредственно с полной дозы; согласно доступным данным литературы, у детей и подростков с РС этот препарат также не титруется.
Безопасность
Ретроспективные исследования [21, 24—28] показали существование сходного краткосрочного профиля безопасности у детей и взрослых при применении интерферонов-β и глатирамера ацетата. Изучение долгосрочного профиля безопасности интерферонов-β и глатирамера ацетата у детей и подростков является важной задачей будущих исследований вне зависимости от результатов, полученных при лечении взрослых больных [10]. Необходимо помнить, что профиль долгосрочной безопасности ПИТРС в педиатрической популяции включает в себя влияние терапии на рост и половое созревание ребенка и подростка, о чем на сегодняшний день пока ничего не известно.
Неадекватный ответ на лечение РС ПИТРС первой линии у детей и подростков
Полного консенсуса в отношении оценки адекватности ответа на терапию ПИТРС ни у детей, ни у взрослых не существует, поэтому препараты для лечения «агрессивных» форм заболевания применяются довольно бессистемно [38—41]. Опубликованные рекомендации по лечению РС у взрослых пациентов гласят, что 1—2 обострения в год или отсутствие роста частоты обострений [42—44], появление 2 или более новых Т2-очагов на МРТ головного мозга или 1 или более очага, активно накапливающего гадолиниевый контраст, в течение первого года лечения могут считаться критериями неэффективности терапии [29]. По данным ретроспективного исследования 258 педиатрических пациентов с РС, 44% из них в течение первых 3 лет терапии перешли на лечение другим препаратом в связи с недостаточной терапевтической эффективностью исходного препарата [32]. Эти факты свидетельствуют о высокой частоте замены препаратов в связи с их кажущейся неэффективностью, а также подчеркивают необходимость определить четкие критерии адекватности ответа на терапию у детей и подростков с Р.С. Но пока такие исследования не проведены, и мы сформулировали рабочие рекомендации по определению эффективности интерферонов-β и глатирамера ацетата у педиатрических больных РС.
Данные рекомендации, безусловно, требуют дальнейшей разработки, и они могут быть изменены при получении новой достоверной информации.
Критериями неадекватного ответа (неэффективности) на ПИТРС первой линии можно считать соответствие хотя бы одному из следующих положений: повышение или отсутствие снижения частоты обострений или наличие новых Т2-гиперинтенсивных очагов или очагов Т1, накапливающих контрастное вещество на МРТ по сравнению с исследованием, проведенным до начала лечения; 2 и более достоверных клинических обострения или дважды, с интервалом не менее 1 мес, выявленные активные очаги на МРТ за период 12 мес или менее плохое восстановление после обострений (прогрессирование инвалидизации на 1 балл или более по шкале EDSS за 3 мес. Данные критерии неэффективности терапии применимы при условиях минимального времени применения препарата в полной дозе перед оценкой эффективности лечения 6 мес и полной приверженности лечению.
Решение об адекватности ответа на терапию должно приниматься с учетом индивидуальных особенностей пациента и течения заболевания (симптоматика и тяжесть обострений, локализация очагов, скорость прогрессирования заболевания, степень когнитивных нарушений).
Данные об особенностях субклинического течения РС у детей и подростков также являются прерогативой дальнейших исследований, поэтому при выборе терапии предпочтительно ориентироваться в основном на клинические проявления заболевания. Принятие решения о смене терапии должно учитывать возможные побочные эффекты нового препарата.
Терапевтическая тактика при неадекватном ответе на лечение ПИТРС первой линии
В случае недостаточной эффективности лечения можно либо произвести замену препарата на другой, относящийся к первой линии (другой интерферон-β или глатирамера ацетат), либо перейти на препарат второй линии выбора из перечисленных ниже. Исследования, проведенные с участием взрослых пациентов с РС, получавших лечение интерферонами-β, показали, что обнаружение в сыворотке нейтрализующих антител к интерферонам-β ассоциируется со снижением терапевтического эффекта самих интерферонов [45]. В педиатрической когорте пациентов с РС таких исследований проведено еще не было, однако, исходя из биологической общности патогенеза заболевания, можно сделать вывод о нецелесообразности продолжения терапии интерферонами-β пациентов с клинической неэффективностью интерферонов и наличием нейтрализующих антител в сыворотке.
У ряда пациентов с неадекватным ответом на ПИТРС первой линии может быть применен 6—12-месячный курс комбинированной терапии в виде присоединения к стандартным дозам интерферонов-β или глатирамера ацетата ежемесячных инфузий высоких доз солей преднизолона. При назначении такой комбинированной терапии должен учитываться спектр возможных осложнений кортикостеродов, таких как остеопороз, артериальная гипертензия, гипергликемия, катаракта и повышенный риск инфекционных процессов.
Как свидетельствуют исследования, проведенные с участием небольших групп больных детей, некоторые из них нуждаются в агрессивной терапии препаратами второй линии, такими как натализумаб [29, 39, 40] и циклофосфамид [46]. Так или иначе, лишь продолжительные, масштабные исследования с фармакокинетическим и фармакодинамическим мониторированием эффективности и безопасности лечения смогут ясно определить место препаратов второй линии в лечении педиатрического РС [47—49].
Окончательное решение о смене иммуномодулирующего препарата в каждом конкретном клиническом случае должно приниматься совместно лечащим врачом, пациентом и его семьей на основании тщательного анализа потенциальных пользы и риска при применении всех возможных вариантов терапии [50, 51].
ПИТРС второй линии выбора у больных детей с РС
На сегодняшний день ряд новых препаратов еще находится в стадии апробации у взрослых больных Р.С. Некоторые из этих лекарственных средств претендуют в будущем на важную роль в лечении педиатрических форм РС, но, естественно, нуждаются в проведении специальных терапевтических исследований у детей и подростков. Однако на данный момент остается неясным, какие препараты в первую очередь нуждаются в изучении. Остановимся на отдельных лечебных средствах.
Натализумаб одобрен для лечения ремиттирующих форм «взрослого» РС на основании исследований класса I в США и Европе для пациентов с неадекватным ответом на иммунотерапию первой линии или с тяжелым, быстро прогрессирующим течением болезни [52, 53]. В России натализумаб лицензирован для применения с 18 лет. Препарат хорошо переносится, но существует риск развития прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ), вызываемой вирусом JCV, и потенциальной гепатотоксичности. Этот риск зависит от длительности терапии натализумабом. Данные о риске ПМЛ у детей отсутствуют.
В литературе имеется несколько сообщений [29, 39] о случаях применения натализумаба у детей, больных РС. В одном из таких исследований из 269 пациентов педиатрического возраста с прогрессирующим РС, наблюдаемых в США, 15 (5,5%) применяли натализумаб в качестве второй или третьей линии терапии. Только 2 из детей, получавших натализумаб, впоследствии изменили терапию: у одного возникла реакция гиперчувствительности, и еще один прекратил терапию вследствие побочных эффектов (желудочно-кишечные расстройства). Несмотря на большое количество литературы, касающейся ПМЛ [49—51], до сих пор не было сообщений о случаях ПМЛ, связанных с больными детского возраста [54, 56]. Поскольку риск ПМЛ возрастает с продолжительностью применения натализумаба, это послужило поводом для ограничения у детей общей продолжительности непрерывного лечения до 2 лет. Для пациентов с хорошим ответом на терапию в течение 24-месячного периода проводится деэскалация к препаратам первой линии терапии, как это предложено для взрослых, с предварительным отмывочным периодом в течение 3 мес (в индивидуальном порядке может быть принято решение об уменьшении этого срока) [57].
Митоксантрон эффективен в отношении снижения числа рецидивов и случаев инвалидности при рецидивирующе-ремиттирующем и вторично-прогрессирующем РС у взрослых. Он был одобрен американской организацией Federal Drug Administration (FDA) для лечения активного РС у взрослых в 2000 г. Однако с приемом митоксантрона связан повышенный риск тяжелых осложнений, таких как лейкемия, кардиомиопатия, инфекции и бесплодие. Кроме того, такие его побочные эффекты, как тошнота, рвота и алопеция, существенно ограничивают использование этого препарата [58, 59]. Все это привело к сокращению его использования у взрослых с РС. IPMSSG не рекомендует применение митоксантрона у детей. Тем не менее специалисты ряда стран, в том числе России и Украины, имеют позитивный опыт использования митоксантрона у больных детского возраста с агрессивным течением РС [57].
Финголимод был одобрен к применению у взрослых больных РС с 2010 г. в Европе и России. При приеме финголимода необходимо с настороженностью относиться к возможным оппортунистическим инфекциям и макулярному отеку; FDA рекомендует проводить кардиоваскулярный мониторинг пациентов, что связано с повышенным риском возникновения брадиаритмии. План исследования финголимода у педиатрических больных РС был одобрен EMA в 2012 г. [56]. В настоящее время в мире и в России в том числе проводится международное мультицентровое исследование применения финголимода у детей и подростков с ремиттирующим РС (PARADIGMS).
Терифлуномид был зарегистрирован в России в 2014 г. для лечения РС с 18 лет. В настоящее время началось двухлетнее многоцентровое рандомизированное двойное слепое плацебо-контролируемое в параллельных группах исследование TERIKIDS, направленное на оценку эффективности, безопасности, переносимости и фармакокинетических свойств терифлуномида при пероральном приеме 1 раз в сутки у детей с рецидивирующими формами РС с периодом открытого последующего наблюдения.
Циклофосфамид, как и ритуксимаб, официально не одобрен к применению при РС ни у детей, ни у взрослых. Однако опыт применения и того, и другого препарата, в том числе у пациентов детского возраста, накоплен достаточно большой [46, 61—67]. Не совсем благоприятный профиль безопасности, допускающий возможность инфекционных осложнений, нарушений менструального цикла, бесплодия и вторичных малигнизаций для циклофосфамида и случаи ПМЛ для ритуксимаба. Эти данные свидетельствуют о необходимости развития дополнительных исследований по систематизации имеющегося опыта и более точного определения места этих препаратов в терапии РС.
Иммуноглобулины G для внутривенного введения (ВВИГ) также стоят несколько особняком от других препаратов, применяемых при РС у больных разного возраста. Но результаты применения ВВИГ в неврологической практике весьма противоречивы: ряд исследователей наблюдали положительный клинический эффект, но без эффекта по данным МРТ, другие отмечали позитивную динамику на МРТ без изменений в клиническом течении заболевания. Это может быть частично обусловлено недостаточной ясностью механизмов действия ВВИГ, а также разными дозами и характеристиками отдельных ВВИГ. В целом при РС ВВИГ сейчас считаются препаратами второго выбора для патогенетического лечения после интерферонов-β и глатирамера ацетата [69—71].
Заключение
В изучении РС у детей и подростков остается много нерешенных вопросов. Более того, существуют возрастные особенности иммунного ответа [48], которые могут обусловливать фармакодинамику и фармакокинетику разных препаратов. Поэтому проблема зависимости эффективности и безопасности препаратов для лечения РС от возраста пациентов остается актуальной [51].
IPMSSG считает, что постмаркетинговое исследование перспективных препаратов для лечения РС должно проводится с целью поиска новых эффективных и относительно безопасных методов лечения не только у взрослых пациентов, но и у детей и подростков. Дизайн педиатрических исследований должен учитывать всю доступную информацию об особенностях механизма действия препарата, данные о его эффективности и безопасности (см. Приложение). Только тщательный анализ систематизированных данных сможет дать ответы на вопросы об эффективности и безопасности применения ПИТРС у детей и подростков с Р.С. Получение таких данных сегодня возможно только в рамках длительных мультицентровых рандомизированных клинических исследований. Поэтому все дети и подростки с достоверным РС [11], должны рассматриваться как потенциальные участники такого рода исследований.
Приложение
Рекомендации IPMSSG по постмаркетинговому исследованию экспериментальных препаратов для лечения педиатрического РС [68]
1. Применение новых терапевтических методик у педиатрических больных РС возможно только в контексте тщательно спланированных клинических исследований. Повсеместное применение таких препаратов в режиме «off-label» препятствует проведению современных грамотных контролируемых терапевтических исследований у педиатрических больных.
2. Новые и экспериментальные препараты с высокой потенциальной эффективностью и токсичностью могут быть представлены для педиатрического исследования только по получении достоверных данных об отсроченной безопасности, на основании применения у взрослых больных. Повторное исследование спектра эффективности и безопасности у детей и подростков для таких агрессивных препаратов является обязательным.
3. Новые и экспериментальные препараты с доказанной эффективностью и безопасностью после проведения исследований III фазы с участием взрослых пациентов повторно должны быть изучены в педиатрической группе пациентов.
4. Педиатрические терапевтические исследования могут проводиться в тандеме с III фазой исследований у взрослых при условии доступных данных о благоприятном соотношении эффективности и безопасности, позитивном опыте применения у детей и подростков препарата с аналогичным механизмом действия или данных о применении этого препарата в педиатрии для лечения других заболеваний.
5. Плацебо-контролируемые исследования педиатрического РС должны быть непродолжительными и иметь четкий и частый мониторинг неврологического статуса пациентов с целью раннего выявления значимого ухудшения состояния больных, получающих плацебо, для выведения их из исследования.
6. В ситуациях, когда необходимость применения специфической терапии ограничена очень малыми группами пациентов (например, у пациентов со злокачественными или резистентными формами РС), проведение клинического исследования может быть нецелесообразным. В таких случаях данные об использовании препарата у каждого пациента объединяются в общую базу, на основании которой делаются выводы об его эффективности и безопасности.
7. Все педиатрические исследования, проведенные у больных РС, должны быть объединены в общий банк данных для сбора и анализа информации об отсроченном влиянии различных методов терапии на рост и развитие пациентов.
Подробную информацию об участниках и политике группы IPMSSG можно узнать на сайте www.ipmssg.org.
В России применение интерферона-β-1а для подкожного введения аннотировано с 12 лет, интерферон-β-1b рекомендован к применению до 18 лет с осторожностью.
На территории РФ на правовой основе могут применяться в педиатрии только препараты, непосредственно прошедшие клиническую апробацию у пациентов моложе 18 лет, а не их аналоги.
Симптомы рассеянного склероза
Клиническая картина этого заболевания у детей очень вариабельна и зависит от локализации очага демиелинизации и варианта течения заболевания. Ранние признаки патологии неспецифические и часто упускаются родителями. К основным симптомам рассеянного склероза у детей относят:
- Постоянное ощущение общей усталости, которая не зависит от физических нагрузок и режима дня. Дети становятся малоактивными, перестают играть с игрушками и другими детьми.
- Нарушение зрения. Дети часто жалуются на появление «сетки перед глазами», двоение в глазах, снижение остроты зрения и боль при движениях глазами. Иногда выпадают поля зрения, нарушается цветовое восприятие. Такие эпизоды длятся более суток с последующим восстановлением зрения. При дистрофических изменениях зрительного нерва наступают необратимые нарушения. При поражении глазодвигательных черепных нервов возникает косоглазие, нистагм.
- Локальные судороги мышц. Появляются внезапно и так же быстро исчезают.
- Нарушение слуха наблюдается при поражении слухового нерва или центрального слухового анализатора в височных долях мозга.
- Двигательные расстройства по типу центрального паралича (повышенный тонус мышц, снижение силы в конечностях, гиперрефлексия, появление патологических рефлексов). Брюшные рефлексы при рассеянном склерозе исчезают. Возможны любые варианты пареза: парапарез, гемипарез, монопарез, тетрапарез. Характерным признаком двигательного дефицита при рассеянном склерозе является изменчивость. Слабость в конечностях нарастает и спадает на протяжении суток.
- Мозжечковые симптомы: нарушение равновесия и координации движений, интенционный тремор, скандированная речь и др.
- Расстройства чувствительной сферы. Наиболее частым проявлением данного синдрома является ощущение «ползания мурашек по коже» или «покалывания». Этот симптом называется парестезией. В первую очередь, страдает глубокая чувствительность (мышечно-суставная, вибрационная, кинестетическая). Характерный признак нарушения чувствительности при рассеянном склерозе — возникновение парестезии в области позвоночника при наклоне головы вперед.
- Нарушение функции мочевого пузыря и нижних отделов кишечника — наиболее частые причины обращения родителей пациента к врачу. Острая задержка мочи или ее недержание, неврогенный запор или недержание кала существенно снижают качество жизни ребенка. Данные симптомы связаны с потерей «центрального» контроля над работой детрузора и сфинктеров.
- Когнитивные и психологические расстройства. У детей ухудшается успеваемость в школе, они становятся невнимательными и раздражительными, а иногда малоэмоциональными и депрессивными.
Для рассеянного склероза невозможно выделить отдельные «классические» симптомы. Каждый признак заболевания коррелирует с местом дистрофического процесса в нервной системе. Поэтому распознать болезнь на ранних этапах очень сложно. Тем более у детей, которые не всегда способны объективно оценить свои ощущения.
Диагностика рассеянного склероза
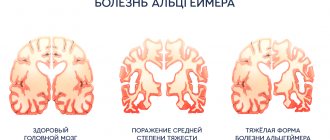
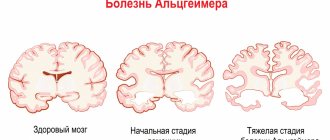
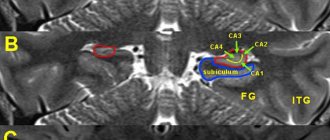
Диагностика заболевания предусматривает визуализацию очагов демиелинизации центральной нервной системы с помощью инструментальных методов исследования (МРТ с введением внутривенного контраста), подтверждение аутоиммунной активности организма после проведения специфических иммунологических анализов и определение функциональных нарушений. МРТ считается «золотым стандартом» в диагностике рассеянного склероза. Данный метод позволяет идентифицировать малейшие очаги демиелинизации. МРТ с контрастом дает четкую картину патологии, на которой «старые» и «новые» очаги демиелинизации отличаются друг от друга. На основании этих данных можно судить об активности заболевания.
Иммунологические тесты проводятся с целью оценки активности патологического процесса. Биологическим материалом для этих анализов в основном является спинномозговая жидкость или кровь. Выявление лимфоцитарного плеоцитоза, повышение уровня миелина – это неспецифические признаки рассеянного склероза.
Расширенная иммунограмма крови позволяет определить те нарушения работы иммунной системы, которые стали критичными в развитии демиелинизирующего заболевания нервной системы.
Метод вызванных потенциалов приобретает все большее значение в диагностике рассеянного склероза. Он позволяет выявить демиелинизацию нейронов еще на начальной стадии заболевания. После анализа характера прохождения электрического импульса от периферического рецептора к центральному анализатору определяют степень поражения компонентов данной цепи.
Для верификации диагноза «рассеянный склероз» во всем мире используют диагностические критерии W. McDonald. Они сопоставляют количество симптоматических эпизодов (атак) и заключение магнитно-резонансной томографии (МРТ).
Все результаты дополнительных методов исследования должны соответствовать клинической картине заболевания. Рассеянный склероз характеризуется возникновением проходящих эпизодов нарушения функции нервной системы, которые длятся не менее 24 часов. Симптоматические атаки должны появляться не чаще, чем раз в месяц.
Наследственный фактор
Нельзя назвать РС наследственным заболеванием, но существует теория, согласно которой, в развитии РС играют роль и гены. На сегодняшний день выявлено около 20-ти генов, которые определяют особенности строения нервной ткани и могут иметь значение в развитии РС. Это подтверждается данными статистики: до 20% больных рассеянным склерозом имеют родственников, больных рассеянным склерозом. Однако, даже в случае имеющейся предрасположенности, рассеянный склероз может не развиться, если этому не будут способствовать и другие предрасполагающие факторы.
Методы лечения рассеянного склероза
Лечение детей с этим заболеванием медикаментозное. Разделяют два направления терапии: патогенетическое и симптоматическое.
Цель патогенетического лечения — коррекция дисфункции иммунной системы и снижение активности аутоантител против собственных клеток нервной системы. С этой целью используются противовоспалительные средства, иммуносупрессоры, иммуномодуляторы.
Для уменьшения выраженности симптомов рассеянного склероза применяют миорелаксанты, противосудорожные препараты, аминокислоты, витамины группы В, антидепрессанты, нейропротекторы, психостимуляторы и ноотропы.
Физиотерапия назначается в стадии ремиссии. Цель немедикаментозного лечения — профилактика осложнений рассеянного склероза. Для этого используются плазмаферез, массаж, физические упражнения.
Психотерапия — важная составляющая лечебного процесса. Данное направление обеспечивает социальную адаптацию ребенка, предупреждает развитие депрессии и когнитивных расстройств.
Последствия рассеянного склероза
Прогрессирование рассеянного склероза может спровоцировать ряд осложнений со стороны других органов и систем. К наиболее распространенным последствиям относятся:
- Инфекционные заболевания. Из-за нарушения функции тазовых органов у детей часто возникают инфекции мочевыводящих путей (цистит, уретрит) и почек (пиелонефрит, хроническая болезнь почек). Рассеянный склероз часто приводит к нарушению дыхания. Ухудшение вентиляции легких может спровоцировать возникновение аспирационной пневмонии.
- Двигательные расстройства вплоть до развития плегии.
- Снижение зрения, слепота.
- Ухудшение слуха, глухота.
- Депрессия и другие нарушения психики.
- Инвалидизация.
Курение
Ни для кого не секрет, что курение является вредной привычкой. Но мало кто знает, что курение — установленный фактор развития рассеянного склероза. Чаще болезнь диагностируется у курильщиков. Кроме того, вред от табачного дыма непосредственно влияет на прогрессирование болезни. Причина в том, что курение снижает иммунный ответ T- и В-лимфоцитов, и, как следствие, играет важную роль в развитии воспалительных реНи для кого не секрет, что курение является вредной привычкой. Но мало кто знает, что курение — установленный фактор развития рассеянного склероза. Чаще болезнь диагностируется у курильщиков. Кроме того, вред от табачного дыма непосредственно влияет на прогрессирование болезни. Причина в том, что курение снижает иммунный ответ T- и В-лимфоцитов и, как следствие, играет важную роль в развитии воспалительных реакций [10, 11].