Диэнцефальный синдром и гипоталамус
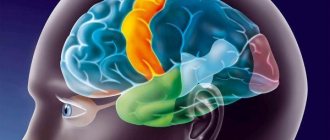
Гипоталамус (лат. hypothalamus) или подбугорье – отдел головного мозга, который страдает при диэнцефальном синдроме. Это высший вегетативный центр, осуществляющий контроль за работой всех желез внутренней секреции: гипофиза, надпочечников, яичников щитовидной и поджелудочной желез.
В ведении гипоталамуса находится управление дыхательной, сердечно-сосудистой, пищеварительной и выделительной систем. Он отвечает за регуляцию температуры тела, ритмов сна и бодрствования, чувства жажды и голода, а также эмоций и поведения человека.
Причины развития диэнцефального синдрома
Сосуды, участвующие в кровоснабжении гипоталамуса, отличаются повышенной проницаемостью. Это делает их незащищенными перед различными повреждающими факторами, воздействие которых и вызывает развитие диэнцефального синдрома. Функция гипоталамуса может пострадать по следующим причинам:
- черепно-мозговой травмы;
- перенесенной нейроинфекции;
- наличия опухолей, которые оказывают давление на гипоталамус;
- тяжелых болезней внутренних органов;
- гормональной перестройки во время беременности;
- родовой травмы или послеродового кровотечения;
- недостаточного белкового питания, голодания, нервной анорексии;
- стресса либо психической травмы;
- наличия очагов хронической инфекции ЛОР-органов, мочеполовой системы, желудочно-кишечного тракта;
- интоксикации (приема алкоголя, курения, употребления наркотиков, профессиональных вредных факторов, загрязнения окружающей среды).
Учитывая многогранную функцию гипоталамуса в деятельности организма, клиническая картина его поражений крайне разнообразна.
Разнообразная клиническая картина диэнцефального синдрома
Из-за множества симптомов с диэнцефальным синдромом достаточно часто сталкиваются врачи разных специальностей: эндокринологи, терапевты, гинекологи, неврологи, хирурги, психиатры, дерматологи и др.
При диэнцефальном синдроме отмечаются следующие виды расстройств:
Вегетативно-сосудистые нарушения проявляются кризами, во время которых возникают: удушье, слабость, сонливость, потливость, тошнота, а также отмечается редкий пульс, падение артериального давления, бледность, сниженная двигательная активность. На смену вегетативно-сосудистым нередко приходят симпато-адреналовые кризы, для которых характерно, наоборот, повышение артериального давления.
Нарушение терморегуляции характеризуется появлением во время криза озноба, усиленного потоотделения, повышения температуры тела до 38-39°C и нередко непроизвольного мочеиспускания.
Нервно-мышечные расстройства выражаются в астении, общей слабости и адинамии, сопровождаются субфебрилитетом, чувством голода и жажды, бессонницей и неприятными ощущениями в области сердца. Течение заболевания чаще приступообразное.
Нейротрофические нарушения проявляются зудом, сухостью, возникновением нейродермита и пролежней, язв желудочно-кишечного тракта, а также размягчением костей (остеомаляцией). На этом фоне отмечаются: сонливость, общая слабость, адинамия, тремор и чувство жажды. Течение заболевания кризовое.
Нервно-психические расстройства характеризуются астенией, нарушением сна, снижением уровня психической активности. При этом возникают галлюцинации, состояние тревоги и страха, частая смена настроения, ипохондрические расстройства, бредовые состояния.
Гипоталамическая эпилепсия – особая форма эпилептических припадков, при которой первичный очаг располагается в гипоталамусе. От него возбуждение передается на корковые и подкорковые двигательные центры. Во время приступов у пациента появляется сердцебиение с подъемом температуры и артериального давления (АД), тремор, расстройство дыхания, страхи. На электроэнцефалограмме (ЭЭГ) регистрируются эпилептические вспышки в виде одиночных волн.
Нейроэндокринные нарушения связаны с расстройством функции не только гипоталамуса, но и других эндокринных желез: щитовидной, надпочечников, гипофиза. Нередко наблюдаются изолированные формы нарушений эндокринных функций, такие как: несахарный диабет, гипотиреоз, болезнь Иценко-Кушинга, синдром Шихана. Последние два часто встречаются в практике гинеколога, поэтому о них мы поговорим подробнее.
NSICU.RU neurosurgical intensive care unit сайт отделения реанимации НИИ им Н.Н. Бурденко
НИИ Нейрохирургии им Н.Н. Бурденко, РАМН, Москва
Введение
Диэнцефальные структуры (ДС) включает в себя таламус, гипоталамус, эпиталамус, субталамус и гипофиз [1]. Таламус, располагаясь ниже боковых желудочков, представляет собою скопление ядер, имеет овальную форму, образует боковую стенку III желудочка и занимает 4/5 пространства диэнцефальной области. Основной функцией таламуса является первичный анализ и передача информации коре мозга от всех органов чувств за исключением обонятельного анализатора. Гипоталамус – это комплекс ядер, которые формируют дно и боковые стенки III желудочка.
Выделяют паравентрикулярное, супраоптическое, преоптическое, супрахиазматическое, вентромедиальное, аркуатное, маммиллярное, заднее и другие ядра. Ядра гипоталамуса имеют обширные интракраниальные связи. В гипоталамусе синтезируются пептиды – либерины и статины. Гипоталамус является высшим центром эндокринной регуляции, обеспечивает постоянство внутренней среды организма, регулирует функционирование органов и систем организма, координирует работу нервной, эндокринной и иммунной систем. Эпиталамус — шишковидное тело, поводок, его ядра и спайки, задняя комиссура — образуют крышу III желудочка, к которой прилежит сосудистое сплетение.
В шишковидном теле синтезируется мелатонин. Эпиталамус регулирует цикл сон-бодрствование, принимает участие в регуляции эмоций и работы автономной нервной системы. Субталамус включает в себя субталамическое ядро, ростральные отделы красного ядра и черной субстанции, располагается между таламусом и покрышкой среднего мозга и участвует в экстрапирамидной регуляции движений. Гипофиз расположен в турецком седле клиновидной кости и имеет две доли – переднюю (аденогипофиз) и заднюю (нейрогипофиз). Нейрогипофиз соединен с гипоталамусом ножкой гипофиза, которая представляет собою аксоны нейронов ядер гипоталамуса и эпиталамуса и по которой транспортируется вазопрессин, окситоцин и мелатонин. В передней доле гипофиза синтезируются тропные гормоны (адренокортикотропный, тиреотропный, гонадотропный, соматотропный гормоны и пролактин), выделение которых регулируется гипоталамическими пептидами. Либерины и статины поступают в аденогипофиз из гипоталамуса по разветвленной системе артериол, капилляров и венул. Эндокринная регуляция является основной функцией гипофиза.
Описаны синдромы, развивающиеся вследствие повреждения ДС: диэнцефальная дистермия (гипертермия, гипотермия, пойкилотермия), гипоталамическое ожирение, диэнцефальный синдром детей, гипоталамическая кахексия взрослых, анорексия, булимия, диэнцефальная глюкозурия, акромегалия, болезнь Кушинга, гипоталамический гипогонадизм, гипофизарный нанизм, гигантизм, синдром Прадера-Вилли и другие [2,3]. У нейрореанимационных пациентов с черепно-мозговой травмой признаки повреждения ДС выявляются в 15-33% наблюдений [4 – 6]. Спектр клинических проявлений, которые эти авторы считают последствием повреждения ДС, у пациентов с черепно-мозговой травмой широк и включает в себя нарушение сознания, расширение зрачков, повышение внутричерепного давления, артериальную гипертензию, тахикардию, брадикардию или другие нарушения сердечного ритма, лихорадку, повышение мышечного тонуса, опистотонус, гипергидроз, тахипноэ. Учитывая механизмы повреждения мозга при черепно-мозговой травме, сложно говорить об изолированном повреждении ДС у этой категории пациентов. Ряд вышеперечисленных симптомов является следствием первичного повреждения стволовых и подкорковых структур или дислокации ствола мозга.
У пациентов с опухолями хиазмально-селлярной области (ХСО) и осложненным течением послеоперационного периода критическое состояние обусловлено изолированным повреждением ДС. При этом формируется характерный синдром — синдром диэнцефальной дисфункции (СДД).
Цель исследования
Описание СДД у реанимационных пациентов. В связи с поставленной целью было необходимо решить следующие задачи: определить структуру СДД; определить варианты СДД; провести корреляцию между вариантом СДД и исходом заболевания.
Материалы и методы исследования
В исследование вошли пациенты, оперировавшиеся в Институте в период с 2006 года по 2009 год, включительно. Критериями включения были: Возраст старше 18 лет; опухоль ХСО; осложненное течение раннего (7 суток) послеоперационного периода; пребывание пациента в отделении реанимации более 48 часов. Критериями исключения были: пребывание пациента в отделении реанимации менее 48 часов; интракраниальные осложнения, не связанные с повреждением диэнцефальных структур (оболочечные гематомы, внутримозговые гематомы на отдалении от ложа удаленной опухоли, ишемическое повреждение мозга в бассейне магистральных сосудов мозга); атоническая кома, развившаяся в течение 7 суток после операции; тромбоэмболия легочной артерии и острый инфаркт миокарда, развившиеся в течение 7 суток после операции; сепсис, развившийся в течение 7 суток после операции. Регистрировались проявления полиорганной дисфункции. Для этого использовались критерии шкалы SOFA [7]. Исключениями стала квалификация измененного сознания (ИС) и дисфункции дыхательной системы. Сознание оценивалось по шкале RASS (Таблица №1).
Шкала RASS была выбрана, поскольку у изучаемой группы пациентов развивается как угнетение сознания, так и психомоторное возбуждение. В этих условиях использование других общепринятых шкал, оценивающих уровень сознания, в том числе и шкалы ком Глазго, не охватывало всех изменений сознания, характерных для пациентов с опухолями ХСО при осложненном течении послеоперационного периода. Отсутствие ИС соответствовало оценке RASS 0, при любой другой оценке RASS сознание считалось измененным.
Критериями дисфункции дыхательной системы являлись снижение индекса pO2/FiO2 ниже 400, как в шкале SOFA, и необходимость проведения продленной ИВЛ (более 24 часов после операции). Это связано с тем, что причиной дыхательной дисфункции у нейрореанимационных пациентов является не только паренхиматозное повреждение легких, которое отражает pO2/FiO2 индекс, но и другие механизмы, например, нарушение центральных механизмов регуляции дыхания или угнетение сознания [8]. Другие соматические органные дисфункции (СОД) квалифицировались строго в соответствии со шкалой SOFA. Дисфункция сердечно-сосудистой системы определялась как развитие артериальной гипотензии (снижение среднего АД ниже 70 мм.рт.ст.) или необходимость использования симпатомиметических препаратов. Почечная дисфункция определялась как повышение уровня креатинина выше 110 мкмоль/л или при снижении диуреза менее 500 мл/сут. Печеночная дисфункция определялась как повышение уровня билирубина выше 20 мкмоль/л. Гематологическая дисфункция определялась как тромбоцитопения (менее 150 тыс/мкл).
Водно-электролитные нарушения (ВЭН) и кишечная дисфункция часто развиваются у пациентов с опухолями ХСО и осложненным течением послеоперационного периода. Шкала SOFA не включает оценку этих нарушения, поэтому были введены следующие квалифицирующие их критерии. ВЭН определялись как диснатриемия (повышение выше 145 ммоль/л или снижение ниже 135 ммоль/л) вследствие несахарного диабета, синдрома неадекватной секреции вазопрессина или сольтеряющего синдрома. Кишечная дисфункция определялась как парез ЖКТ. Лихорадка определялась как повышение температуры тела выше 38,5ºС, гипотермия – снижение температуры тела ниже 36ºС. Для предупреждения развития гормональной недостаточности все пациенты после операции получали заместительную гормональную терапию в дозе, которые используются у пациентов с гормональной недостаточностью, находящихся в состоянии выраженного стресса: гидрокортизон 2,5 – 3 мг/кг/сут, L-тироксин 2-2,5 мкг/кг/сут. Данные представлены в виде медианы с указанием 25 и 75 перцентиля. При анализе данных использовались тест Манна-Уитни и отношение рисков. Различия считались достоверными при p<0,05, а риск считался достоверным, если нижняя граница доверительного интервала превышала единицу. Статистический анализ проводился с помощью программы Statistica 7.0.
Результаты исследования и их обсуждение
Согласно критериям включения в исследование вошло 83 пациента. 7 больных было исключено из анализа в соответствии с вышеуказанными критериями: 2 пациента с эпидуральной гематомой, 3 пациента с формированием атонической комы в течение 48 часов, 1 пациент с острым инфарктом миокарда и 1 – с ТЭЛА. Таким образом, было проанализировано 76 пациентов с осложненным течением раннего послеоперационного периода в возрасте от 19 до 77 лет (медиана 49 лет).
Женщин было 43 (56,6%), мужчин – 33 (43,4%). У 46 пациентов была аденома гипофиза, у 17 – краниофарингиома, в 8 наблюдениях – менингиома ХСО, и по одному наблюдению были представлены пациенты с глиомой и эпендимомой III желудочка, гемангиоперицитомой, эпидермоидной кистой и метастазом рака в ХСО.
У всех 76 пациентов (100%) выявлялись ИС и диснатриемия, развивающиеся, соответственно, на первые и вторые сутки после операции (Таблица №2).
С учетом анатомии и физиологии ДС это является логичным. Поскольку вазопрессин синтезируется в паравентрикулярном и супраоптическом ядре, депонируется в нейрогипофизе, а транспортируется туда по ножке гипофиза, то существует высокая вероятность периоперационного повреждения какой-либо одной или нескольких из этих анатомических структур. Это незамедлительно приводит к дизнатриемии. ИС также легко объяснить. Таламус, занимающий 4/5 ДС, вычленяет важную информацию, поступающую от всех сенсорных анализаторов, и передает только ее коре мозга. При повреждении этого ограничивающего механизма к коре поступает огромное количество ненужной информации, которую она не способна проанализировать, происходит очевидная перегрузка, приводящая к изменению сознания [9]. Эпиталамус синтезирует мелатонин, который затем депонируется в нейрогипофизе. Мелатонин имеет первостепенное значение для адекватного функционирования циркадного ритма сон-бодрствование. При повреждении эпиталамуса, ножки гипофиза или гипофиза развиваются нарушения сна, которые приводят к изменению сознания [10]. Кроме этого, различные ДС связаны со стволовыми структурами, лимбической системой, корой мозга. Морфологическое повреждение этих связей также может стать причиной ИС [11].
Дисфункция дыхательной, сердечно-сосудистой системы и водно-электролитные нарушения развивались на вторые сутки после операции, а парез желудочно-кишечного тракта – на третьи. Наиболее частыми СОД были дисфункция сердечно-сосудистой системы, кишечная дисфункция и дисфункция дыхательной системы. Дисфункция сердечно-сосудистой и дыхательной систем развивались на вторые сутки, соответственно, у 52 (68%) и 50 (66%) пациентов. Кишечная недостаточность развилась на третьи сутки у 51 (67%) пациента. Сердечно-сосудистая, дыхательная система и желудочно-кишечный тракт являются теми структурами, на которые ДС оказывают выраженное и непосредственное влияние. Исходя из этого, частое развитие этих СОД у пациентов с осложненным течением послеоперационного периода является логичным. Гораздо реже и позже развивалась тромбоцитопения – у 21 (28%) пациента с 4 суток после операции. Это объясняется тем, что уровень тромбоцитов регулируют другие механизмы. Почечная и печеночная дисфункция развивалась в ранние сроки после операции, но выявлялись очень редко – в трех (4%) и одном (1%) наблюдении, соответственно. ДС непосредственно не регулируют клубочковую фильтрацию, поэтому они не могут оказывать непосредственное влияние на клиренс креатинина [12]. При несахарном диабете почечная недостаточность формируется только при развитии декомпенсированной гиповолемии, которую легко избежать при проведении адекватной инфузионной и заместительной гормональной терапии препаратами вазопрессина. Кроме этого, почечная недостаточность может развиваться вследствие резистентной артериальной гипотензии, что возникает крайне редко у изучаемой группы пациентов [13]. ДС, вероятно, также лишены непосредственного регулирующего влияния на функцию печени, которая, однако, может страдать вследствие гипоперфузии на фоне резистентной артериальной гипотензии. Другой возможной причиной развития почечной и печеночной недостаточности может быть абдоминальный компартмент-синдром, развивающийся вследствие пареза желудочно-кишечного тракта [14]. Однако резистентная артериальная гипотензия и компартмент-синдром развиваются достаточно редко [13], что и отражается в частоте этих дисфункций у изучаемой категории пациентов.
Лихорадка развивалась у 18 (23,7%) пациентов, гипотермии не было выявлено ни в одном из наблюдений. Таким образом, дистермия, ранее описанная как характерный для повреждения ДС симптом, редко развивалась у наших пациентов.
При повреждении ДС нарушение функций надпочечников и щитовидной железы неизбежно. Клиническими проявлениями надпочечниковой и тиреоидной недостаточности являются артериальная гипотензия, бради- или тахикардия, гипотермия или лихорадка, парез желудочно-кишечного тракта, повышенная проницаемость мембран, приводящая к полисерозиту и интерстициальному отеку [2,15]. В соответствии с принятыми протоколами интенсивной терапии все пациенты, вошедшие в исследование, получали глюкокортикостероидные и тиреоидные гормоны в дозах, полностью замещающих их продукцию надпочечниками и щитовидной железой в условиях выраженного стресса. Из этого следует, что мы могли исключить надпочечниковую и тиреоидную недостаточность из числа причин развития вышеперечисленных органных нарушений.
Очевидно, что при повреждении задней доли гипофиза или его стебля неизбежно появятся ВЭН [2]. При каком варианте повреждений ДС у пациента облигатно разовьется ИС и СОД до сих пор остается неизвестным. Проведенный анализ также не смог ответить на этот вопрос. Это означает, что по-прежнему отсутствуют точные предоперационные и интраоперационные предикторы развития ИС и СОД.
Следует подчеркнуть, что до операции все пациенты, вошедшие в исследование, были в компенсированном состоянии, и у них не отмечалось проявлений соматических органных дисфункций, а ВЭН были менее выраженными или вовсе отсутствовали. Таким образом, при описании структуры послеоперационного СДД следует учитывать развившиеся после операции диснатриемию, ИС и СОД. Для определения вариантов СДД пациенты были разделены на группы в зависимости от комбинации выявленных дисфункций. Получилось 6 групп (Таблица №3).
Примечание. Гр – группа; ИС – измененное сознание; ВЭН – водно-электролитные нарушения; СД – соматическая дисфункция; ОРИТ – отделение реанимации и интенсивной терапии; ШИГ – Шкала Исходов Глазго; ДС – диэнцефальные структуры; СС – стволовые структуры; ТЭЛА – тромбоэмболия легочной артерии.
Группу 1 составили 12 пациентов. У них выявлялась изолированное сочетание ИС и ВЭН без СОД. Медиана возраста этих пациентов составила 42,5 лет, медиана продолжительности пребывания в ОРИТ — 8,5 суток. У 11 (91,7%) пациентов, по шкале исходов Глазго (ШИГ), был зафиксирован благоприятный исход (ШИГ=4), у одного пациента (8,3%) – неблагоприятный (ШИГ=3), летальных исходов не было.
Группу 2 составили 11 пациентов. Они имели одну СОД в дополнение к ИС и диснатриемии. Наиболее часто, у 6 (54,5%) пациентов, развивалась дисфункция сердечно-сосудистой системы. Парез кишечника развился у двух пациентов, и дыхательная недостаточность развилась в двух наблюдениях. В одном наблюдении выявлялась тромбоцитопения. Медиана возраста составила 51 год, а медиана длительности пребывания в ОРИТ – 13 суток. Благоприятный исход (ШИГ=4) был у 5 (45,5%) пациентов, неблагоприятный (ШИГ=3) был у 6 больных (54,5%).
Группу 3 составили 12 пациентов. У них выявлялось две СОД на фоне ИС и диснатриемии. Кишечная недостаточность развилась у 9 (75%) больных, дыхательная недостаточность — у 8 (66,7%) пациентов, сердечно-сосудистая — в 7 (58,3%) наблюдениях. Медиана возраста в этой группе составила 47 лет, а медиана продолжительности пребывания пациентов в ОРИТ – 23,5 суток. У 3 (25%) больных имел место благоприятный исход: ШИГ=4 в двух наблюдениях; ШИГ=5 в одном наблюдении. У 9 пациентов (75%) исход был неблагоприятный. Из них у 5 больных развилась грубая инвалидизация (ШИГ=3), а в 4 наблюдениях (33%) был зафиксирован летальный исход (ШИГ=1). Причиной смерти в 3 наблюдениях был сепсис, в одном – ТЭЛА.
Группу 4 составили 25 пациентов. У них выявлялись сразу три СОД в дополнение к ИС и диснатриемии. Дыхательная недостаточность развилась в 24 (96%) наблюдениях, сердечно-сосудистая недостаточность — у 23 (92%) пациентов, кишечная недостаточность — у 24 (96%). У 4 (16%) больных была отмечена тромбоцитопения. Медиана возраста в этой группе составила 53 года, медиана продолжительности пребывания в ОРИТ – 22 дня. Благоприятный исход отмечался у 6 (24%) пациентов: ШИГ=5 у двух пациентов, ШИГ=4 у четырех пациентов, неблагоприятный исход – у 19 больных (76%), из которых у 8 развивалась глубокая инвалидизация (ШИГ=3). Летальный исход имел место у 11 пациентов (44%). У 4 умерших пациентов причиной смерти был сепсис, у 2 – менингоэнцефалит, еще у 2 – гемотампонада желудочковой системы, дислокация и вклинение, 2 пациента скончались вследствие подтвержденного морфологического повреждения диэнцефальных структур, а 1 – вследствие ТЭЛА.
Группу 5 составили 12 пациентов. У них выявлялись одновременно четыре СОД с ИС и диснатриемией. У всех пациентов развивались дыхательная, сердечно-сосудистая, кишечная недостаточность и тромбоцитопения. Медиана возраста составила в этой группе 57,5 лет, медиана продолжительности пребывания в ОРИТ – 40,5 суток. Благоприятный исход (ШИГ=4) был зафиксирован у 4 (33,3%) пациентов этой группы. Неблагоприятный исход развился в 8 (66,7) наблюдениях. При этом только один из 8 пациентов с неблагоприятным исходом выжил (ШИГ=3). У остальных, 7 (58,3%) пациентов, имел место летальный исход (ШИГ=1). В 5 наблюдениях причиной смерти был сепсис, в 2 наблюдениях – повреждение диэнцефальных структур.
Группу 6 составили 4 пациента. У них развивалось одновременно 5 СОД с ИС и диснатриемией. У всех пациентов развивались дыхательная, сердечно-сосудистая, кишечная недостаточность и тромбоцитопения. У 3 пациентов выявлялась почечная дисфункция, а в одном наблюдении – печеночная. Медиана возраста в этой группе составила 52 года, медиана продолжительности пребывания в ОРИТ – 7,5 суток. В этой группе не было пациентов с благоприятным исходом, во всех наблюдениях наступил летальный исход. Причиной смерти у одного пациента был сепсис, у трех – морфологически подтвержденное повреждение диэнцефальных и структур.
Исходы пациентов первой группы с изолированным сочетанием ИС и диснатриемии были лучше, чем во всех остальных группах. Длительность их пребывания в ОРИТ была наименьшей. Различия между первой и второй группами не были достоверными (р=0,5). Однако, были получены достоверны различия по длительности пребывания пациентов в ОРИТ между первой и третьей, первой и четвертой группами (р=0.04 и р=0.01, соответственно). При анализе не учитывалась длительность пребывания в ОРИТ пациентов группы 5, поскольку это были наиболее тяжелые пациенты, у которых летальный исход наступил ранние сроки после операции. Благоприятные исходы в группе 1 развивались чаще, чем в других группах, а неблагоприятные – реже (Таблица №3). Риски развития неблагоприятного и летального исходов в группах 2 – 6, по сравнению с первой группой, приведены в таблице №4.
Летальных исходов в группах 2 и 3 не было, а в группе 6 все пациенты имели летальный исход, поэтому в этих группах было невозможно высчитать риски.
Известно, что ряд пациентов с изолированной диснатриемией, изолированным ИС или даже сочетанием ИС и диснатриемии не требуют пребывания в ОРИТ в послеоперационном периоде [16]. У некоторых пациентов эти нарушения могут сохраняться в течение длительного времени после выписки их из стационара, а адекватно подобранная терапия позволяет вернуться пациентам к своей повседневной деятельности.
Очевидно, пациенты группы 1 имели более выраженные формы ИС и диснатриемии, чем больные с подобными нарушениями, но не требующие пребывание в ОРИТ. По сравнению с последними у пациентов группы 1 отличительной чертой являлась их нестабильность. Это проявлялось необходимостью изменения в течение суток проводимой интенсивной терапии. Однако тот факт, что одни и те же проявления могут быть, как у реанимационных пациентов, так и у тех, кто уже вернулся к своей повседневной деятельности, не позволяет выделить изолированное сочетание ИС и диснатриемию в одну из форм СДД.
В группе 2 количество неблагоприятных исходов существенно превысило количество благоприятных (Таблица №3). Это дает основание считать больных группы 2 пациентами первой стадии СДД. Следовательно, СДД – это синдром, включающий в себя измененное сознание, диснатриемию и, как минимум, одну соматическую органную дисфункцию. Исходы у пациентов каждой последующей группы были тяжелее, чем исходы пациентов предыдущей группы (Таблица №4). Риск развития неблагоприятного исхода по сравнению с первой группой был выше в каждой последующей группе: 13,2; 33; 34,8, соответственно (Таблица №4). Нижний предел доверительного интервала превышал единицу во всех группах, что свидетельствует о достоверности выявленного риска. Не понятно, почему риск развития неблагоприятного исхода в группе 5 по сравнению с группой 1 составил 22, тогда как в группе 3 и 4 – 33 и 34,8, соответственно. Однако в этой группе риск развития летального исхода по сравнению с первой группой был достоверно выше, причем для группы 4 риск развития летального исхода по сравнению с первой группой не достиг достоверного уровня (Таблица №4). Из этого следует, что СДД имеет 5 степеней тяжести. СДД 1 первой степени имеет ИС, диснатриемию и одну СОД. В каждой последующей степени добавляется по одной СОД.
СДД, по-сути, является вариантом синдрома полиорганной дисфункции (СПОД). Однако в отличие от СПОД, развивающегося на фоне синдрома системной воспалительной реакции, СДД имеет ряд принципиальных отличий. Во-первых, СДД обязательно включает в себя ИС и диснатриемию, которые не всегда развиваются при СПОД [17]. Во-вторых, для СДД нехарактерны почечная и печеночная дисфункция, типичные для СПОД [18]. В-третьих, существенным отличием являются сроки и очередность развития СОД. При СДД происходит раннее и фактически одновременное, в течение 1 – 3, суток развитие дыхательной, сердечно-сосудистой и кишечной дисфункции. Даже не характерная для СДД почечная дисфункция формировалась в течение полутора суток после операции. Для СПОД характерно более медленное и поэтапное появление СОД [19]. В-четвертых, тромбоцитопения имеет различную прогностическую значимость для СДД и СПОД. В нашем исследовании она выявлялась у 21 пациента, что значительно чаще, чем почечная или печеночная недостаточность, но существенно реже, чем сердечно-сосудистая, дыхательная или кишечная дисфункция. Это не дает оснований для суждения о том, является ли тромбоцитопения типичным или нетипичным феноменом для пациентов с СДД. В то время, как для СПОД тромбоцитопения типична [17,18]. Нами не было выявлено различий по частоте её встречаемости в различных группах. Другими словами, если появление любой другой органной дисфункции означает утяжеление состояния пациента и ухудшение его прогноза, то выявление тромбоцитопении мало что означало для исхода. Однако наиболее важным фактом является то, что, ни в одном из наших наблюдений тромбоцитопения не достигала уровня 50 тысяч в мкл, и почти всегда количество тромбоцитов превышало 100 тысяч в мкл. Это означало, что тромбоцитопения при СДД не требует коррекции в отличие от СПОД.
Выводы
- У больных с нейрохирургической патологией ХСО синдром диэнцефальной дисфункции в послеоперационном периоде проявляется сочетанием измененного сознания, водно-электролитных нарушений в виде диснатриемии и, как минимум, одной соматической органной дисфункции.
- Наличие у пациента измененного сознания и диснатриемии не достаточно для диагностики синдрома диэнцефальной дисфункции.
- Тяжесть синдрома диэнцефальной дисфункции и исход определяются количеством развившихся соматических органных дисфункций.
Литература
- Бер М, Фротшер М. Топический диагноз в неврологии по Петеру Дуусу. Анатомия, физиология, клиника. Пер. с анг. под ред. З.А. Суслиной. 4-е изд. М: Практическая медицина, 2009. 478 стр.
- Endocrinology. DeGroot L.J., Jameson J.L. Elsevier Saunders, Philadelphia, 2006. p. 3336.
- Russell A. Diencephalic syndrome of emaciation in infancy and childhood.// Arch Dis Child, 1951. V.26 p274.
- Baguley I.J., Heriseanu R.E., Cameron I.D., et al. A critical review of the pathophysiology of dysautonomia following traumatic brain injury.// Neurocrit Care. 2008. V. 8 p. 293-300.
- Boeve B.F., Wijdicks E.F., Benarroch E.E. Paroxysmal sympathetic storms («diencephalic seizures») after severe diffuse axonal head injury.// Mayo Clin. Proc. 1998. V. 73 p. 148-152.
- Clifton G.L., Robertson C.S., Kyper K. Cardiovascular response to severe head injury.// J Neurosurg. 1983. V. 59 p. 447-54.
- Vincent J.L., Moreno R., Takala J., et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the working group on sepsis-related problems of the European society of intensive care medicine.// Intensive Care Med. 1996. V. 22 p. 707-710.
- Попугаев К.А., Савин И.А., Горячев А.С. и др. Шкала оценки тяжести дыхательной недостаточности у нейрохирургических пациентов.// Анест. и реан., 2010. №4 c. 42-50.
- Stewart J.T., Quijije N., Sheyner I., Stover K.T. Delirium without focal signs related to a thalamic stroke.// J. Am. Geriatr. Soc. 2010. V. 58 p. 2433-2434.
- Figueroa-Ramos M.I., Arroyo-Novoa C.M., Lee K.A., et al. Sleep and delirium in ICU patients: a review of mechanisms and manifestations.// Intensive Care Med. 2009. V. 35 p. 781–795.
- Frontera J.A. Delirium and sedation in the ICU.// Neurocrit Care 2011. V. 14 p. 463-474.
- Legrand M., Payen D. Understanding urine output in critically ill patients.// Ann Intensive Care. 2011. V. 24 p.13.
- Popugaev K.A., Savin I.A., Goriachev A.S., Kadashev B.A. Hypothalamic injury as a cause of refractory hypotension after sellar region tumor surgery.// Neurocrit Care. 2008. V. 8 p. 366-373.
- Cheatham M.L.: Intra-abdominal hypertension and abdominal compartment syndrome.// New Horiz. 1999. V. 7 p. 96–115.
- Попугаев К.А., Савин И.А., Горячев А.С. и др. Вторичный абдоминальный компартмент синдром при осложненном течении послеоперационного периода у больных с опухолями хиазмально-селлярной локализации.// Анест. и реан., 2011. № 4 с. 37-42.
- Аденомы гипофиза: клиника, диагностика, лечение/ Под ред. Б.А. Кадашева. М.-Тверь: ООО «Издательство Триада», 2007. 368 с.
- Knaus W.A. and Wagner D.P. Multiple systems organ failure: epidemiology and prognosis.// Crit. Care Clin. 1989. V. 5 p. 221–232.
- Cerra F.B. Multiple organ failure syndrome./ In: Bihari DS, Cerra FB (eds). New Horizons. Multiple Organ Failure. Fullerton, CA: Society of Critical Care Medicine. 1989. p 1–24.
- Murray M.J., Coursin D.B. Multiple Organ Dysfunction Syndrome.// Yale J. Biol. Med. 1993. V. 66 p.501-510.
Диэнцефальный синдром: болезнь Иценко-Кушинга
Болезнь Иценко-Кушинга – это тяжёлое нейроэндокринное заболевание, при котором из-за повреждения гипоталамуса повышается продукция его специфического фактора, вызывающего избыточный синтез гипофизом адренокортикотропного гормона (АКТГ) и, как следствие, глюкокортикоидов надпочечниками.
Данное заболевание часто развивается во время полового созревания, после родов и абортов, что объясняется ранимостью гипоталамических отделов ЦНС в эти периоды, а также может возникнуть вследствие травмы головного мозга или нейроинфекции.
У пациентов с болезнью Иценко-Кушинга отмечается повышение артериального давления и сахара крови. При данной патологии наблюдается отложение жира в области шеи, лица живота и бедер. Лицо становится лунообразным, щеки – красными. На коже образуются багровые полосы (стрии), на теле появляется сыпь и фурункулы.
У женщин, страдающих болезнью Иценко-Кушинга, нарушается менструальный цикл вплоть до полного исчезновения менструаций (аменореи), возникает бесплодие, снижается половое влечение, отмечается аноргазмия.
Следует отметить, что аналогичная клиническая картина развивается при наличии опухолей гипофиза и надпочечников (синдром Иценко-Кушинга).
Обследование и лечение пациентов с болезнью Иценко-Кушинга проводит гинеколог-эндокринолог. Диагноз устанавливается на основании лабораторных методов исследования, определяющих повышение уровня АКТГ и кортикостероидов в моче и крови, а также при помощи специальных проб с дексаметазоном.
Данные компьютерной (КТ) или магнитно-резонансной (МРТ) томографий позволяют исключить опухоли гипофиза и надпочечников.
Комментарий
Предметом обсуждения в представленной работе стала довольно редкая патология – диэнцефальная кахексия (ДК), патогенез которой остается неизученным к настоящему времени. В статье приводится уникальное клиническое наблюдение ДК у молодой женщины с папиллярной краниофарингиомой. Детальное изложение клинических проявлений, лабораторных и МРТ-данных ярко демонстрирует первостепенную роль диэнцефального поражения в снижении массы тела и развитии кахексии. Особую ценность этому наблюдению придает длительный катамнестический период. Важно подчеркнуть, что регресс кахексии после операции, вероятно, связан лишь с компрессией диэнцефальных структур, а не с их разрушением. На основании проведенного авторами анализа литературы также рассматриваются вопросы этиологии, клиники, диагностики ДК на фоне различных опухолей хиазмально-селлярной области и современные подходы к их лечению. Подчеркивается, что потеря массы тела может быть первым проявлением краниофарингиомы. Стремительное течение болезни с развитием кахексии, отсутствие эффективных терапевтических средств подчеркивают значимость ранней диагностики и своевременного хирургического лечения, а также необходимости мультидисциплинарного подхода к ведению таких сложных пациентов. Все это определяет исключительную актуальность данной проблемы (статьи).
Статья написана хорошим литературным языком, читается с большим интересом.
Л.Я. Рожинская (Москва)
Диэнцефальный синдром после родов (синдром Симмондса-Шиена)
Диэнцефальный синдром может сформироваться после родов. Беременность сопровождается увеличением размеров и массы гипофиза – главного «подчиненного» гипоталамуса. Если у женщины в послеродовом периоде имеет место кровотечение, то в качестве ответной реакции возникает спазм сосудов, в том числе, в головном мозге. Это способствует развитию ишемии, а впоследствии и некроза увеличенного гипофиза, а также ядер гипоталамуса. Данное состояние называется синдромом Симмондса-Шиена (гипоталамо-гипофизарная кахексия, послеродовый гипопитуитаризм).
При этом может нарушаться работа всех эндокринных желез: щитовидной, яичников, надпочечников. Характерными признаками заболевания являются: отсутствие лактации после родов и резкое снижение веса. Также могут отмечаться жалобы на головную боль, быструю утомляемость, понижение артериального давления, симптомы анемии (сухость кожи, ломкость волос, боли в области сердца и пр.).
Вследствие нарушения функции яичников у женщины исчезают менструации, атрофируются половые органы. Гипотиреоз проявляется выпадением волос, отеками, нарушениями работы желудочно-кишечного тракта, ухудшением памяти.
Диагностика синдрома Симмондса-Шиена основана на изучении гормонального профиля, при котором выявляется снижение в крови уровня следующих гормонов: соматотропного (СТТ), тиреотропного (ТТГ), фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ) и адренокортикотропного (АКТГ).
С целью оценки функционального состояния гипоталамо-гипофизарно-надпочечниковой системы проводят специальные пробы с АКТГ и нагрузкой метапироном.
По данным КТ и МРТ при синдроме Симмондса-Шиена можно обнаружить структурные изменения турецкого седла – кости основания черепа, на которой лежит гипофиз.
Обсуждение
Снижение массы тела широко распространено в патогенезе многих заболеваний (хроническая сердечная и почечная недостаточность, сахарный диабет, болезнь Аддисона, ревматоидный артрит, болезнь Альцгеймера, злокачественные новообразования и др.). Независимо от этиологии кахексия представляет собой серьезную медицинскую проблему. Даже незначительное снижение массы тела у пациентов определяет неблагоприятный прогноз течения болезни и является мощным предиктором высокой смертности [24—26]. Наиболее опасным для жизни состоянием является потеря более 40% от идеальной массы тела [26, 27]. С древних времен термин «кахексия» (греч. кachexia, kakos
«плохой» + hexis «состояние) являлся синонимом быстрого летального исхода. «Плоть исчезает… плечи, ключицы, грудь, пальцы словно тают. Это состояние — лицо смерти», — писал Гиппократ [28]. И.С. Тургенев в 1846 г. в своем рассказе «Живые мощи» описывает кахексию у молодой женщины, которая была «первая красавица, высокая, полная, белая, румяная…». «Передо мною лежало живое человеческое существо, но что это было такое? Голова совершенно высохшая, одноцветная, бронзовая — ни дать ни взять икона старинного письма; нос узкий, как лезвие ножа; губ почти не видать — только зубы белеют и глаза, да из-под платка выбиваются на лоб жидкие пряди желтых волос. У подбородка, на складке одеяла, движутся, медленно перебирая пальцами, как палочками, две крошечных руки тоже бронзового цвета… лицо не только не безобразное, даже красивое, — но страшное, необычайное» [29].
Несмотря на то что первое описание кахексии было сделано более 2000 лет назад, до сих пор вопросы ее патогенеза при различных заболеваниях являются предметом дискуссий и научных исследований. Остается неизученным снижение массы тела при опухолях ХСО. Мы описали редкий случай диэнцефальной кахексии у молодой женщины с КФ.
КФ — доброкачественные эпителиальные опухоли (WHO I), которые развиваются из остатков эмбриональных клеток кармана Ратке, расположенного вдоль глоточно-гипофизарного хода. Частота встречаемости КФ у взрослых составляет около 2,1—4,6% всех интракраниальных новообразований [30—32].
Гистологически различают два основных типа КФ — адамантиноподобные и папилломатозные. Папилломатозный вариант встречается, как правило, только у взрослых. КФ характеризуются наличием солидного и кистозного компонента, который выявляется примерно в 80% случаев [33, 34]. Возникновение папилломатозной КФ, в отличие от адамантиноподобных, связывают с метаплазией эпителиальных клеток. Папилломатозные К.Ф. преимущественно локализуются в области III желудочка; одно из названий этих опухолей — папилломы III желудочка.
Эмбриогенез и топография КФ определяют высокую частоту эндокринных и метаболических нарушений. Результатом поражения гипоталамической области может стать дисбаланс энергетического гомеостаза, ведущего к развитию ожирения или кахексии. Известно, что КФ часто ассоциированы с развитием диэнцефального (гипоталамического) ожирения [35, 36]. ДК встречается реже и представлена описанием лишь единичных случаев. Так, в крупном ретроспективном исследовании среди детей с КФ из 485 случаев развитие ДК наблюдалось лишь у 7 пациентов [37]. Предполагается, что развитие ожирения или кахексии при КФ связано с инвазивным ростом опухоли в отличие от компрессии ею гипоталамической области соответственно [6, 37]. До настоящего времени патофизиология ДК остается неизвестной. Современные представления о центральных механизмах контроля метаболизма дают основание предполагать, что потеря массы тела при ДК обусловлена дисфункцией гипоталамических нейронов, участвующих в регуляции энергетического гомеостаза и массы тела. Отсутствие клинико-лабораторных данных о вторичной гипофункции периферических желез, прежде всего гипокортицизма, наглядно демонстрирует разные механизмы потери массы тела при ДК и синдромах Симондса и Шиена.
Снижение массы тела является ключевым симптомом и главной причиной обращения за медицинской помощью. При обследовании таких пациентов на первом этапе диагностики исключают недостаточность питания, нервную анорексию и состояния, связанные с мальабсорбцией (нарушением всасывания питательных веществ в тонкой кишке). Далее диагностический поиск должен быть направлен на исключение органической патологии головного мозга, даже при отсутствии общемозговой или очаговой неврологической симптоматики.
В нашем клиническом наблюдении манифестация заболевания совпала с послеродовым периодом, вторичная аменорея не расценивалась пациенткой как повод обращения за медицинской помощью. Только стремительное снижение массы тела привело ее к обследованию у врачей, а появление нейроофтальмологической симптоматики в виде хиазмального синдрома сыграло решающую роль в проведении МРТ головного мозга.
К моменту выявления опухоли дефицит массы тела составлял около 20%, а ко времени госпитализации — более 40% от исходной массы тела, что является критичным для жизни пациента.
До этапа хирургического лечения или невозможности проведения операции такие пациенты нуждаются в постоянной нутритивной поддержке. В настоящее время не существует общепринятой фармакологической терапии для лечения кахексии любой этиологии.
Из лабораторных данных обращало внимание свойственное ДК повышение базального уровня СТГ на фоне снижения ИРФ-1. Подобные изменения могут наблюдаться при кахексии любой этиологии, например при нервной анорексии [38].
У пациентки также выявлялось значимое повышение уровня пролактина, что не описывалось ранее при Д.К. Это изменение, вероятнее всего, обусловлено блокадой дофаминэргической системы при супраселлярной локализации опухоли. Лабораторно был подтвержден вторичный гипогонадизм. Других клинически значимых биохимических отклонений не выявлялось. Все эти изменения не являются причиной снижения массы тела, а развиваются вторично.
Отметим, что несмотря на выраженный дефицит массы тела, пациентка сохраняла хорошее самочувствие и физическую активность, находилась в «приподнятом» настроении, что создавало контраст с ее внешним видом. Наличие повышенного настроения и даже эйфории часто описывалось у детей с ДК авторами ранее опубликованных случаев.
Данное клиническое наблюдение представляет интерес еще и потому, что развитие ДК типично для детей первых 2—3 лет жизни, у взрослых наблюдается чрезвычайно редко. Развитие Д.К. чаще вызывают астроцитомы диэнцефальной области разной степени злокачественности. Другие типы опухолей, в том числе и КФ, как в нашем случае, скорее, являются исключением. Развитие кахексии — скорее признак раздражения сохранных гипоталамических структур, поскольку после операции отмечался регресс симптомов.
Основным методом лечения КФ остается хирургический. Анатомическая близость опухоли к жизненно важным структурам (дно III желудочка, зрительные нервы и хиазма, магистральные сосуды основания мозга) определяет значительную сложность оперативного лечения и создает трудности для их радикального удаления [39—44]. Как правило, удаление КФ приводит к нарастанию нейроэндокринных расстройств [44, 45]. В представленном нами наблюдении у пациентки после первой операции появились дополнительные нарушения — несахарный диабет, центральные гипокортицизм и гипотиреоз, сохранился вторичный гипогонадизм (см. таблицу). Больная нуждалась в пожизненной заместительной терапии препаратами L-тироксина, гидрокортизона, десмопрессина и половых стероидов. Однако важно подчеркнуть, что при этом больная стала быстро прибавлять в массе тела, несмотря на то что в области дна III желудочка имелись остатки опухоли. Таким образом, можно предположить значительную роль компрессии, а не разрушения диэнцефальных структур для развития кахексии в описанном нами наблюдении.
К настоящему времени нерешенной задачей остается контроль опухолевого роста после нерадикального удаления КФ [46]. Эта опухоль отличается высокой частотой рецидивирования, достигающей 30% в течение 10 лет при тотальной резекции [34, 39, 47].
Неполное удаление КФ является предпосылкой к рецидиву опухоли и определяет показания к сте-реотаксическому облучению [39]. Показательным в этом отношении явилось и наше наблюдение. Продолженный рост опухоли выявлен у пациентки спустя 8 мес после нерадикальной операции. По данным МРТ головного мозга, размер рецидивировавшей опухоли превышал первоначальные, что характеризует КФ как опухоль с агрессивным течением. Учитывая локализацию новообразования, целью лечения таких пациентов становится не только радикальное удаление опухоли, но и предупреждение развития тяжелых осложнений, связанных с повреждением гипоталамуса. Подобные операции должны проводиться в учреждениях, в которых имеется междисциплинарная команда специалистов, включающая нейрохирурга, невролога, радиолога, эндокринолога, психиатра и офтальмолога.
Таким образом, в каждом случае лечебная стратегия определяется индивидуально на основании характера роста и гистологии опухоли, а также возраста и состояния пациента. Нередко возможно только частичное удаление или биопсия опухоли с последующим применением нехирургических методов. В таких случаях лучевая и/или химиотерапия могут стать единственным шансом на спасение больного [8, 9, 48, 49]. Сложно объяснить почему, но даже частичное удаление опухоли может привести к регрессу кахексии, что и произошло в нашем наблюдении. Иногда отмечается восстановление массы тела с последующим развитием ожирения [8, 23]. Детальное изучение механизмов, контролирующих энергообмен, может пролить свет на патогенез этих расстройств и определить целенаправленный подход в лечении пациентов с нарушением метаболизма.
Все фотоматериалы размещены с добровольного письменного согласия пациентки
.
Авторы заявляют об отсутствии конфликта интересов.