А.Ю. Лубнин, А.А. Потапов, И.В. Никитенкова, И.А. Савин, К.А. Попугаев, А.В. Ошоров
ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Для корреспонденции: Лубнин Андрей Юрьевич — д-р мед. наук, профессор, руководитель отдела анестезиологии, реанимации и интенсивной терапии ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва; е-mail
Для цитирования: Лубнин А.Ю., Потапов А.А., Никитенкова И.В., Савин И.А., Попугаев К.А., Ошоров А.В. Внезапный отек мозга после неосложненной двухсторонней краниопластики. Клиническое наблюдение и обзор литературы. Вестник интенсивной терапии им. А.И. Салтанова. 2020;2:137–145. DOI: 10.21320/1818-474X-2020-2-137-145
Реферат
В работе приведено описание клинического наблюдения острого развития отека мозга после неосложненной двухсторонней краниопластики. В обсуждении и обзоре литературы рассматриваются механизмы развития отека мозга, возникающего после закрытия обширных костных дефектов черепа, в особенности больших и двухсторонних, а также возможная роль субгалеальных дренажей.
Ключевые слова: краниопластика, осложнения, острый отек мозга
Поступила: 03.03.2020
Принята к печати: 02.06.2020
Читать статью в PDF
Статистика Plumx русский
Введение
Декомпрессивная краниэктомия (ДК) является достаточно часто выполняемой нейрохирургической операцией, направленной главным образом на устранение выраженной и резистентной к терапевтическим мероприятиям внутричерепной гипертензии в остром периоде у пострадавших с тяжелой черепно-мозговой травмой и церебральными сосудистыми катастрофами (злокачественный ишемический инсульт, тяжелое аневризматическое субарахноидальное кровоизлияние, синус-тромбоз) [1–9]. Последствием ДК, в случае если пациент переживает острый период катастрофы, является наличие обширных костных дефектов свода черепа, иногда двухсторонних, что представляет определенную опасность для этих больных и создает косметические проблемы. Для закрытия костных дефектов после ДК обычно производится пластическая операция закрытия этих дефектов с помощью аутокости (если ее удалось сохранить), различных синтетических пластических материалов или металлических пластин [10–12]. Эта операция обычно производится отсроченно, когда состояние пациента уже стабильно, как правило, она не представляет каких-либо технических сложностей и не сопровождается какими-либо осложнениями. Однако в нашей практике мы столкнулись с редкой ситуацией — внезапным развитием массивного отека мозга в ближайшем послеоперационном периоде после неосложненной двухсторонней краниопластики. Ниже приведено описание этого наблюдения.
Симптоматика при различных степенях тяжести ЧМТ
Степень тяжести ЧМТ определяется по шкале комы Глазго (оценка открывания глаз, движения и речи пациента): легкая – 13–15 баллов, средняя – 9–12 баллов, тяжелая – 3–9 баллов. Иными словами, учитываются три фактора: состояние сознания, жизненно важные функции, неврологическая симптоматика. При этом состояние пациента оценивается как удовлетворительное, средней тяжести, тяжелое, крайне тяжелое, терминальное (между жизнью и смертью). Чем серьезнее травма и глубже ее проникновение, тем тяжелее наступает выздоровление пациента.
Симптоматика ЧМТ при:
- Легкой степени тяжести: головная боль (цефалгия), головокружение, тошнота и рвота, расстройство сна, раздражительность, скорая утомляемость.
- Средней степени: нарушения речи, частичная потеря зрения, пароксизмы конечностей, нарушение психики, потеря памяти, нарушения ритма сердцебиения, цефалгия высокой степени интенсивности, повышение частоты дыхательных движений с сохранением ритма, потеря сознания до нескольких часов.
- Тяжелой степени: судороги, параличи, гипо- или гипертонус мускулатуры, отсутствие сознания до нескольких недель, кома, критическое нарушение жизненно важных функций, глубокие стволовые, общемозговые нарушения.
Клиническое наблюдение
Пациентка Т., 18 лет, поступила в нашу клинику с диагнозом: последствия перенесенной тяжелой сочетанной черепно-мозговой травмы, формирующееся вегетативное состояние, двухсторонние костные дефекты свода черепа. Из анамнеза известно, что за 8 мес. до настоящей госпитализации, в результате ДТП (автоавария) пациентка получила тяжелую черепно-мозговую травму: ушиб головного мозга тяжелой степени с открытым переломом костей лица, ротационным вывихом в правом межпозвонковом суставе С1–С2 и подвывихом атланто-зубовидного сустава. Была доставлена в крайне тяжелом состоянии в ближайшую больницу, где ей была произведена в тот же день двухсторонняя ДК в лобно-височно-теменных областях. В последующем пациентка получила весь комплекс мер интенсивной терапии, используемый у пострадавших с тяжелой черепно-мозговой травмой, включая трахео- и гастростомию, установку вентрикуло-перитонеального шунта в связи с развитием посттравматической гидроцефалии. Результатом проведенного лечения стало формирование вегетативного состояния. Через 3 мес. с момента получения травмы, на фоне стабильного состояния пациентки, она была переведена по настоянию родственников в реабилитационную клинику в Израиль. Проведенное там лечение особых результатов не дало, но, со слов родственников, в начале лечения по непонятной причине у пациентки развился кратковременный эпизод асистолии, который был купирован реанимационными мероприятиями. На момент поступления в нашу клинику состояние пациентки тяжелое, вегетативное состояние, контакта с ней нет, лежит с периодически открытыми глазами. Массивные двухсторонние костные дефекты как следствие произведенной ранее ДК (рис. 1). Дыхание самостоятельное, через трахеостому. Питание через гастростому, мочеиспускание по постоянному мочевому катетеру. Цель госпитализации в наш центр — закрытие костных дефектов черепа.
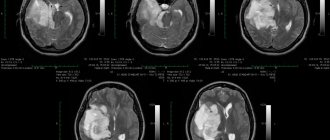
Рис. 1. Дооперационные КТ пациентки Т.
Видны большие двухсторонние дефекты костей свода черепа и шунт.
Fig. 1. Preoperative CT scan of patient T.
После стандартной предоперационной подготовки пациентка была взята в операционную для проведения краниопластики. Анестезиологическое обеспечение: пропофол в/в, в виде постоянной инфузии + небольшие дозы мидазолама в начале операции + фентанил болюсно по ходу операции. Миорелаксация — рокурония бромид. Искусственная вентиляция легких (ИВЛ) через трахеостому кислородно-воздушной смесью (FiO2 = 0,3) в режиме нормовентиляции. Течение анестезии гладкое, кровопотеря за всю операцию — не более 100 мл, инфузионная терапия — кристаллоиды.
Объем хирургического вмешательства, как и планировалось, свелся к пластическому закрытию обширных двухсторонних костных дефектов свода черепа с использованием стереолитографической модели черепа и пресс-форм имплантов. Операция была окончена ушиванием мягких тканей в области операционных ран с установкой под кожу субгалеальных активных дренажей с двух сторон. По окончании операции пациентка на ИВЛ мешком Амбу была переведена в палату пробуждения, где были продолжены ИВЛ в режиме SIMV и мониторинг основных физиологических параметров.
Все было спокойно, но через полтора часа после окончания операции у пациентки была отмечена тенденция к артериальной гипотензии и тахикардии, но самое неприятное — в этот же момент было отмечено появление двухстороннего мидриаза, свидетельствующего о какой-то остро развившейся интракраниальной катастрофе. Снижение артериального давления было устранено в/в инфузией вазопрессоров, и пациентка была переведена в отделение реанимации. Там ей была незамедлительно произведена контрольная компьютерная томография головного мозга, которая показала выраженный диффузный отек всех структур головного мозга, включая заднюю черепную ямку. Причина такого остро развившегося массивного отека мозга после неосложненной краниопластики оставалась не вполне понятной, но, учитывая высокую вероятность выраженной внутричерепной гипертензии на фоне такого отека мозга, было решено незамедлительно удалить установленные костные импланты и субгалеальные дренажи, что и было сделано в условиях операционной.
Далее пациентке проводилась интенсивная терапия в условиях отделения реанимации. На вторые сутки после операции пациентке была произведена магнитно-резонансная томография головного мозга, которая подтвердила наличие выраженного диффузного отека мозгового вещества во всех отделах мозга (рис. 2). Кроме того, были обнаружены множественные мелкие кровоизлияния практически во всех отделах мозга. Признаков тромбоза магистральных артериальных и венозных сосудов мозга отмечено не было.
Рис. 2. Магнитно-резонансная томография больной Т., выполненная на 2-е сутки после операции
Видны выраженный диффузный отек мозгового вещества во всех отделах мозга и мелкоточечные кровоизлияния.
Fig. 2. MRI patient T., performed on the 2nd day after surgery
На фоне проводимой интенсивной терапии состояние пациентки постепенно стабилизировалось. Показатели системной гемодинамики стабильны, необходимость в вазопрессорной поддержке отсутствует. ИВЛ через трахеостому во вспомогательном режиме. Инфузионная терапия через центральный венозный катетер, питание через гастростому, диурез по постоянному мочевому катетеру. Электроэнцефалография, записанная на 4-й день после операции, выявила низкий уровень биоэлектрической активности: альфа-ритм не регистрируется, частые колебания бета-диапазона регистрируются в центрально-лобных областях, больше справа. Медленные волны дельта-диапазона низкой амплитуды, полиморфного характера, отмечаются в правом полушарии, больше в центрально-лобно-передне-височной области. Реакции на афферентные раздражения (ритмический свет, звук, болевое раздражение) не получено. Неврологически — вегетативное состояние, без какой-либо динамики. Такое состояние пациентки сохранялось в течение четырех с половиной лет: она оставалась пациенткой отделения интенсивной терапии в нашей клинике, главным образом по настоянию родственников. По прошествии этого периода времени пациентка погибла от тяжелых респираторных нарушений.
Подготовка к трепанации черепа
Если времени на подготовку достаточно, пациент проходит всестороннее обследование.
Однако, в случае экстренной трепанации проводится минимальный набор анализов и внутренние болезни игнорируются в пользу спасения жизни.
За неделю до операции больной перестает принимать антикоагулянты, а за сутки – есть и пить.
В ходе процедуры пациента укладывают на операционный стол, фиксируют голову и вводят наркоз. В требуемой области сбривают волосы, надрезают кожу и отделяют ее от черепа.
Просверливают отверстия в черепе, закругляют их контуры и удаляют вырезанную часть. Затем убирают в сторону твердую мозговую оболочку. Дальнейшая тактика зависит от цели оперативного вмешательства.
По завершении манипуляций на теле мозга, которые иногда занимают много часов, возвращают на место мозговую оболочку и вырезанный кусок кости, который закрепляют титановыми пластинками. Сверху зашивают кожу.
Обсуждение
Краниопластика является достаточно часто выполняемым нейрохирургическим вмешательством. Чаще всего она производится для устранения последствий ДК у пострадавших с тяжелой черепно-мозговой травмой или больных с церебральными сосудистыми катастрофами [1–9]. Выполнение краниопластики не предусматривает каких-либо воздействий на мозговое вещество, и даже твердая мозговая оболочка при этой операции не вскрывается. Состояние больных, идущих на эту операцию, как правило, стабильно, так как она производится в отсроченном периоде травмы или сосудистой катастрофы. Поэтому краниопластика редко осложняется какими-либо серьезными проблемами. Тем невероятнее кажется ситуация, с которой мы столкнулись в нашей клинической практике. Что же случилось с нашей пациенткой через полтора часа после окончания неосложненной и, по сути, внемозговой операции? Мы неоднократно обсуждали эту клиническую ситуацию, и при этом высказывались самые разные предположения.
- Компрессия ствола за счет ротационного вывиха в правом межпозвонковом суставе на уровне С1–С2 и подвывиха атланто-зубовидного сустава, предположительно произошедшего во время травмы? Но это старый процесс, соотносимый по времени с моментом получения травмы. Пациентке в операционной не проводилась интубация трахеи, а значит, не было момента экстензии шейного отдела позвоночника, что можно было бы рассматривать как провоцирующий фактор острой компрессии шейного отдела спинного мозга (экстензия на фоне миорелаксации — устранения «мышечного каркаса) [13, 14]. Далее, церебральная катастрофа у нашей пациентки развилась не в момент перекладывания, что также могло спровоцировать компрессию. Ну и наконец, даже если допустить ситуацию компрессии шейного отдела спинного мозга, это никак не объясняет быстрое развитие тотального (полушарного + структуры задней черепной ямки) отека мозга.
- Тромбоз магистральных артериальных и венозных сосудов мозга (прежде всего венозных синусов). Принципиально это, конечно, возможно. Но причина этого осложнения у нашей пациентки не очевидна. Наиболее частой причиной синус-тромбоза является тромбофилия, в особенности в сочетании с назначением гормональных контрацептивов, и локальный воспалительный процесс [15–20]. Эти ситуации отсутствовали у нашей пациентки. Тромбоз церебрального синуса, в особенности крупного и непарного (типа сагиттального), манифестирует формированием гематомы или двух симметричных в парасагиттальной области [16, 17], чего также не было у нашей больной. Но главное другое — диагноз синус-тромбоза не был подтвержден нейровизуализацией.
- Острое нарушение мозгового кровообращения в виде церебральной гиперперфузии после краниопластики, в особенности двухсторонней, в сочетании с установкой двух активных субгалеальных дренажей. На первый взгляд это объяснение кажется сложным и малопонятным, но попробуем в нем разобраться.
Первый фактор — краниопластика. Несмотря на свою кажущуюся простоту и относительную неинвазивность, краниопластика, оказывается, обладает выраженным эффектом на церебральную гемодинамику, причем даже односторонняя. Как было показано в серии многочисленных клинических исследований, герметизация полости черепа вызывает существенное увеличение значений линейного и объемного мозгового кровотока (последний эффект может быть результатом устранения эффекта атмосферного давления) [21–28]. Механизм этого эффекта остается до конца непонятным, но, возможно, именно он является причиной прогрессивного клинического улучшения в неврологическом статусе у этих больных после герметизации полости черепа и ликвидации эффекта атмосферного давления [21–23, 29–33].
Второй фактор — активные субгалеальные дренажи. Скопление крови в области операционной раны под кожным лоскутом является несерьезным, но неприятным осложнением любой нейрохирургической операции. Для предупреждения такого скопления и были разработаны эти простые, дешевые и эффективные устройства. Однако анализ данных литературы дал достаточно настораживающую информацию: оказывается, что в некоторых наблюдениях применение активного субгалеального дренирования приводило к таким серьезным осложнениям, как образование интракраниальной гематомы, псевдогипоксический отек мозга, разрыв не полностью клипированной аневризмы и аксиальная дислокация в краниальном направлении, сопровождающаяся рефлекторной асистолией [34–41]. Считается, что отрицательное давление, создаваемое активным субгалеальным дренажем, может определенным образом передаваться в полость черепа, создавая там условия для интракраниальной гипотензии со всеми вытекающими последствиями [34, 37–39]. В нашем наблюдении таких дренажей было использовано два, и к моменту обнаружения мидриаза оба были практически полными, а емкость каждой «груши» составляет не менее 100–150 мл.
Можно предположить, что эффекты двухсторонней краниопластики и активного субгалеального дренирования могли суммироваться и создать реальные условия для острого увеличения объемного мозгового кровотока у нашей пациентки, а дальнейшее развитие тотального отека мозгового вещества и множественных геморрагий было следствием этой церебральной гиперемии.
Анализ данных литературы показал, что наше наблюдение не является уникальным и в мире описан ряд аналогичных клинических ситуаций [40, 42–46]. В них приведено описание единичных клинических наблюдений развития тяжелого отека мозга после неосложненной краниопластики. Авторы этих работ, так же как и мы, не имеют абсолютной доказательной базы, объясняющей развитие данного осложнения, но ход их рассуждений в попытке найти объяснение этому феномену близок к нашему.
Ситуацию с нашим клиническим наблюдением и другими аналогичными существенно изменил и дополнил метаанализ, проведенный мексиканскими авторами и опубликованный в World Neurosurgery в марте 2021 г. [47]. Эта относительно свежая публикация многое, хотя и не все, объясняет, и поэтому, на наш взгляд, она достойна более детального рассмотрения.
Авторы анализа сконцентрировали свое внимание на проблеме MBSC (Massive Brain Swelling after Cranioplasty). К сожалению, здесь даже терминологически не все так просто, и авторы справедливо указывают, что для этого состояния в литературе есть и используются и другие определения: «смерть после краниопластики»; «отек мозга после краниопластики» и др. Тем не менее авторы проделали большую работу. По нескольким медицинским базам данных, начиная с 1960 и по 2017 г., они отобрали подходящие по смыслу (правда, только на английском языке) публикации, в соответствии с рекомендациями PRISMA (Preffered Reporting Items for Systematic Reviews and Meta-Analysis). Сначала отобранных работ было 534 (главным образом это были описания единичных клинических наблюдений или их небольших серий), затем их количество существенно сократилось (до 19), и это позволило обобщить уже достаточно репрезентативный материал из 26 пациентов.
Возраст пациентов составлял от 14 до 77 лет. Причинами декомпрессивной трепанации были черепно-мозговая травма (52 %), острое нарушение мозгового кровообращения (44 %), но у возрастных пациентов острое нарушение мозгового кровообращения было все же ведущей причиной. Тип краниотомии был таким: у 21 пациента (81 %) это была гемикраниэктомия, у остальных — двухсторонняя краниэктомия. Шунт к моменту проведения краниопластики был имплантирован 11 пациентам (44 %). По типу краниопластического материала — в 50 % случаев это была аутокость, в остальных — различные пластические материалы.
Интерес представляют временны́е показатели. Время проведения краниопластики с момента развития церебральной катастрофы варьировало от 1 до 17 мес. (в среднем 3 мес.). Время с момента окончания операции краниопластики и до развития отека мозга варьировало от 15 мин и до 16 ч (в среднем 3,3 ч).
Клинические проявления. Самыми частыми были мидриаз и кома. Судороги развились у 30 % пациентов. Радиологическая картина была одинаковой у всех больных: диффузный отек мозга со сдавлением резервных ликворных пространств. В некоторых наблюдениях были отмечены признаки интрапаренхимальной геморрагии.
Ну и наконец, лечение и исходы. Самым частым вариантом хирургического вмешательства (65 % пациентов) было немедленное удаление костных имплантов. Однако одним пациентам противоотечная терапия проводилась, а другие (n = 4) никакого лечения не получили. При этом летальность составила 88 %, а трое выживших пациентов остались глубокими инвалидами. Таковы данные анализа этой серии наблюдений из 26 пациентов. Что же позволяет предположить данная информация?
- Несмотря на всю свою относительную техническую простоту и малоинвазивность (ведь в ходе краниопластики даже твердая мозговая оболочка обычно не вскрывается), краниопластика после декомпрессивной краниэктомии представляет собой в патофизиологическом отношении серьезное вмешательство, приводящее к резкому увеличению объемного мозгового кровотока и церебрального метаболизма. Причины этого увеличения мозгового кровотока наиболее вероятно связаны именно с герметизацией полости черепа, приводящей к устранению эффекта атмосферного давления на мозговой кровоток. Это скачкообразное увеличение мозгового кровотока, в особенности на фоне нарушенных механизмов его ауторегуляции, по сути, ведет к развитию синдрома церебральной гиперперфузии, хорошо известного и неоднократно описанного при других клинических состояниях — каротидной эндартерэктомии, эндоваскулярных реваскуляризирующих вмешательствах, резекции крупных полушарных артериовенозных мальформаций с большим сбросом крови [48–55]. Интересно, что и клинические проявления синдрома церебральной гиперперфузии при всех этих состояниях довольно однотипны: психомоторное возбуждение или делирий, судороги, отек мозга и геморрагии в его вещество.
- Наличие функционирующего шунта и наружных дренажей. Эти факторы однозначно относятся большинством авторов к высокому риску на том основании, что, хотя и различными путями, но все они ведут к снижению внутричерепного давления и тем самым способствуют увеличению объемного мозгового кровотока.
- Учитывая дооперационное наличие тяжелой неврологической симптоматики и быстрые темпы развития отека мозга при операциях краниопластики после декомпрессивной краниэктомии, анестезиологу следует быть крайне внимательным ко всем системным сдвигам гемодинамики (развитию тахи- или брадикардии, артериальной гипер- или гипотензии), как во время операции, так и в ближайшем послеоперационном периоде. Ну и конечно, необходимо оценивать в динамике неврологическую симптоматику и особенно появление мидриаза.
- Немедленное удаление установленных костей или их заменителей и противоотечная терапия, по-видимому, являются оправданными опциями лечения в такой ситуации. Однако исходы лечения чаще всего остаются плохими. Профилактические мероприятия пока не вполне понятны. Возможно, это отказ от использования активных дренажей; временная или постоянная блокада ликворного шунта; этапное, а не одномоментное закрытие больших и двухсторонних дефектов костей черепа.
NSICU.RU neurosurgical intensive care unit сайт отделения реанимации НИИ им Н.Н. Бурденко
После удаления опухолей головного мозга может развиваться отек-набухание мозга иувеличиваться внутричерепное давление (ВЧД). Одной из вероятных и наименее изученныхпричин этого является нарушение венозного оттока. Тяжесть клинических проявлений иисходы венозной дисциркуляции значительно варьируют от головной боли и тошноты докоматозного состояния и летального исхода [14,17,22,26]. Вариабельность клиническойкартины определяется количеством сегментов венозной системы, в которых происходитнарушение оттока. Это было показано в эксперименте Fries G с соавторами [14], когдасвиньям последовательно производили окклюзию верхнего сагиттального синуса, мостиковыхи корковых вен, оценивая при этом клиническое состояние животных, измеряя ВЧД исодержание воды в ткани мозга. Было установлено, что выраженный отек мозга,внутричерепная гипертензия (ВЧГ), разрушение гематоэнцефалического барьера, а затем иартериальная гипоперфузия, приводящая к инфаркту мозга, развивалась только приодновременной окклюзии синуса, мостиковых и корковых вен, когда прекращался иретроградный, и коллатеральный венозный кровоток [1,14]. В то же время установлено, чтонаиболее выраженный неврологический дефицит возникает при нарушении оттока крови поглубоким и парасагиттальным венам или при заинтересованности большого количества венсильвиевой группы [24].
Общепринятых протоколов коррекции ВЧГ, развившейся вследствие нарушения венозногооттока, на сегодня нет. Мы приводим клиническое наблюдение пациентки с менингиомойкрыла основной кости, у которой в раннем послеоперационном периоде остро развилосьнарушение венозного оттока и устойчивая ВЧГ.
Клиническое наблюдение.
Больная Ч., 47 лет, поступила в Институт с диагнозом «Опухольоснования средней черепной ямки слева». При поступлении выявлялось снижение остротызрения слева — счет пальцев в носовой части поля зрения, левосторонний экзофтальм ипризнаки воздействия на левый глазодвигательный нерв. При МРТ исследовании головногомозга выявлена менингиома основания средней черепной ямки слева (Рисунок 1).
Была выполнена операция – субтотальное удаление менингиомы медиальных отделов основаниясредней черепной ямки слева птериональным доступом. Кавернозный синус былинфильтрирован опухолью. Эта часть опухоли не удалялась. Интраоперационно быликоагулированы две враставшие в капсулу опухоли крупные вены сильвиевой группы.
Кровопотеря не превысила 700 мл и была адекватно восполнена.
Пробуждение из наркозного сна было в обычные сроки. Нарастания общемозговой и очаговойневрологической симптоматики по сравнению с дооперационным уровнем не отмечалось.
Пациентка экстубирована через 2 часа после операции. Гемодинамика была стабильной.
Гомеостатические показатели были в пределах нормы.
Состояние резко ухудшилось через 12 часов после операции. Развилось коматозноесостояние и правосторонний гемипарез (3 – 4 балла). В связи с дыхательнойнедостаточностью больная была интубирована, начата ИВЛ в режиме SIMV+PS. ПриКТ-исследовании головного мозга был выявлен преимущественно левополушарный отек,массивный очаг пониженной плотности, располагавшийся в лобно-теменно-височной областислева, отмечено смещение срединных структур слева направо на 9 мм. Базальные цистерныне визуализировались, желудочковая система была компремирована (Рис. 2). Притранскраниальной допплерографии линейная скорость кровотока была в пределах нормы. Установлен субдуральный/паренхиматозный датчик ВЧД (Codman, USA). Выявлена выраженнаяВЧГ (ВЧД 35 – 45 мм.рт.ст.).
Для коррекции ВЧГ использовались опции протокола лечения пациентов с черепно-мозговойтравмой, поскольку общепринятых протоколов коррекции ВЧГ при нарушении венозного оттоканет. Головной конец кровати был приподнят на 30º. Начата умеренная гипервентиляция,седация пропофолом (45 мкг/кг/мин), аналгезия фентанилом (0,02 мкг/кг/мин) имиорелаксация пипекуронием (0,5 мкг/кг/мин). Эти мероприятия были неэффективны – ВЧД оставалось на уровне 30 – 35 мм.рт.ст. через 20 минут после начала терапии. После этогобыла использована осмотерапия маннитолом (до 1,5 г/кг). ВЧД через 10 минут снизилось до20 – 25 мм.рт.ст., однако, через 30 мин вновь развилась выраженная ВЧГ (до 40мм.рт.ст.). Повторная инфузия маннитола оказалась неэффективной.
Было принято решение о проведении умеренной гипотермии. Индукция гипотермии началасьспустя час после ухудшения состояния. Использовалось наружное охлаждение и внутривенноевведение охлажденного физиологического раствора в дозе 20 мл/кг. Температура 33º С быладостигнута через два часа после индукции. ВЧД эффективно стабилизировалось на уровне 10– 12 мм.рт.ст. При гипотермии развились гипокалиемия (3,1 – 3,3 ммоль/л) игипомагниемия (0,39 – 0,41 ммоль/л), которые были эффективно корригированы применениемпрепаратов калия и магния. В качестве профилактики развития гипокоагуляции, учитываяранний послеоперационный период и эффекты гипотермии, проводилась плазмотрансфузия вдозе 15 мл/кг. При этом протромбиновый индекс был в пределах 75 – 85%, активированноечастично тромбопластиновое время – 28 – 33 секунды, фибриноген – 3,4 – 3,9 г/л.
Температура тела 33ºС поддерживалась в течение 24 часов. Перед началом согревания быловыполнено контрольное КТ-исследование головного мозга, выявившее положительную динамикув виде появления базальных цистерн и уменьшения смещения срединных структур вправо до 5мм. Однако сохранялся отек мозга и очаг пониженной плотности в левом полушарии (Рис 3).
При достижении 35ºС (через 10 часов после начала согревания) появилась отчетливаятенденция к ВЧГ, поэтому темп согревания был снижен до ≈ 0,05 градуса в час. Внеседации больная выполняла простые инструкции, правосторонний гемипарез регрессировал.
Таким образом, уже на этом этапе были выявлены положительные эффекты гипотермии в видерегресса общемозговой и очаговой неврологической симптоматики.
Температура 36ºС была достигнута через 20 часов. При этой температуре развилась ВЧГ до30 мм.рт.ст., резистентная к седации и осмотерапии маннитолом. Это явилось показаниемдля выполнения наружной декомпрессивной трепанации с пластикой твердой мозговойоболочки. Из протокола операции следует, что, несмотря на напряжение твердой мозговойоболочки, выявленное после удаления костного лоскута, мозг пульсировал, а при егокасании не был раним. Вероятно, это было связано с предшествующим лечением, вчастности, — с церебропротективными эффектами гипотермии. После рассечения твердоймозговой оболочки и расширения костного дефекта напряжение мозгового веществазначительно уменьшилось, что позволило выполнить пластику твердой мозговой оболочки безтехнических затруднений. Декомпрессия и пластика твердой мозговой оболочки позволилиэффективно стабилизировать ВЧД на уровне 10 – 15 мм.рт.ст.
Седация продолжалась еще в течение 2 суток после выполнения наружной декомпрессии, амониторинг ВЧД – в течение 5 суток. В течение этого периода эпизодов внутричерепнойгипертензии не было. При КТ-исследовании была выявлена положительная динамика (Рисунок4). Больная была в сознании, но дезориентирована в месте, времени, личной ситуации.
Движения выявлялись во всех конечностях, без отчетливой ассиметрии. ИВЛ прекращеначерез 6 суток после декомпрессивной трепанации, а еще через 5 суток больная переведенаиз реанимации в нейрохирургическое отделение.
Спустя 1,5 месяца состояние пациентки было стабильным. Выявлялся корсаковский синдром.
Речевых и двигательных нарушений не было. Было выполнено МРТ-исследование головногомозга с венографией, и в режиме диффузии (Рис 5), при котором выявлено отсутствиекровотока по поперечному и сигмовидному синуса слева. Кроме этого, диагностированобширный очаг церебромаляции лобно-височной области базальной локализации слева,который визуализировался и при КТ-исследовании в остром периоде, как очаг пониженнойплотности.
Анализ клинической симптоматики, данных КТ и МРТ-исследований головного мозга позволяетпредположить, что причиной формирования этого очага является остро возникшее нарушениевенозного оттока. Кроме этого, был визуализирован ишемический очаг в затылочной областислева, который имеет конусовидную форму и располагается в проекции бассейна заднеймозговой артерии. Наиболее вероятная причина формирования этого очага — компрессиязадней мозговой артерии о намет мозжечка при отеке и дислокации мозга в остром периодезаболевания.
Через 2,5 месяца у больной развилась гидроцефалия, которая явилась показанием длявыполнения люмбоперитонеального шунтирования. Через 4 месяца больная выписана изИнститута в стабильном состоянии. Больная могла обслуживать себя самостоятельно.
Выраженность корсаковского синдрома уменьшилась. Через 6 месяцев после выпискипланируется повторная госпитализация пациентки для выполнения пластики костногодефекта. Дифференциальный диагноз при ухудшении состояния пациентки проводился междуартериальной ишемией и нарушением венозного оттока. Для нарушения венозного характерно:- отсутствие пробуждения из наркозного сна или ухудшение состояния через несколькочасов после операции [17];- при КТ-исследовании возможна визуализация очага пониженной плотности в первые суткипосле операции вследствие гидростатического отека [2];- интраоперационные данные о повреждении вен или синусов;- скорость кровотока при транскраниальной допплерографии остается нормальной илиснижается [4,29,30,33].- при МРТ-венографии выявляются измененные параметры [2]. Однако выполнение МРТ-исследования в остром периоде при наличии выраженной ВЧГ чревато развитием жизненноугрожающих осложнений.
Итак, дифференциальная диагностика позволила заподозрить у пациентки наличие нарушениявенозного оттока. Патогенез развившегося состояния можно представить следующим образом.
Интраоперационная окклюзия вен сильвиевой группы, включенных в опухоль, привела клокальной венозной дисциркуляции. Отсутствие кровотока по поперечному, сигмовидномусинусу (возможно, врожденное) и кавернозному синусу (инфильтрация опухолью)ограничивало компенсаторные возможности коллатерального перераспределения венозногооттока. Это привело к постепенному, в течение 10 – 12 часов после операции, наростаниюотека мозга, что, в свою очередь, вызвало дисциркуляцию в системе глубоких вен мозга.
Это явилось причиной острого ухудшения через 12 часов после операции с развитиемкоматозного состояния, вследствие выраженного отека мозга и его дислокации.
В настоящий момент отсутствует протокол коррекции ВЧГ при нарушении венозного оттока.
Применение рекомендаций интенсивной терапии для коррекции ВЧГ у больных с опухолямимозга, ЧМТ и ОНМК, в нашем наблюдении было неэффективным. Глюкокортикостероидныегормоны для интенсивной терапии отека мозга, вызванной нарушением венозного оттока неиспользуются [17,26]. Приподнимание головного конца кровати, седация, аналгезия,миорелаксация, умеренная гипервентиляция и осмотерапия были неэффективны — сохраняласьВЧГ.
При неэффективности перечисленных опций для снижения ВЧД показано применениеагрессивных методов: барбитуровая кома, наружная декомпрессия или умеренная гипотермия.
Барбитураты не использовались, поскольку, из отчетов организации «Кохрановскоесотрудничество», специализирующейся на систематизации и анализе результатовисследований с использованием принципов доказательной медицины, следует, что: «нетдоказательств того, что терапия барбитуратами у пациентов с тяжелой черепно-мозговойтравмой улучшает исходы. Барбитураты вызывают артериальную гипотензию у каждогочетвертого пациента. Гипотензивный эффект барбитуратов будет нивелировать положительноевлияние снижения ВЧД на церебральное перфузионное давление…» [28].
Наружная декомпрессивная трепанация не была использована на этом этапе, поскольку, поданным Greenberg M.S, при нарушении венозного оттока вследствие венозных тромбозов онаприводит к снижению ВЧД, но не улучшает исходов заболевания [17]. При наружнойдекомпрессии изменяются интракраниальные соотношения, меняется ликвородинамика,повышается риск кровоизлияния в остатки опухоли или очаг ишемии при его наличии.
Известно, что при выраженном отеке мозга после декомпрессии может развиваться ущемлениеткани мозга в костном дефекте с развитием ишемии и вторичным нарушением венозногооттока на этом участке [11,27].
Умеренная гипотермия (32 — 34ºС) является эффективным методом контроля над ВЧД[5,7,18], и обладает церебропротективным эффектом. Механизм церебропротекциизаключается в снижении уровня метаболизма [6,9], уменьшении проницаемостигематоэнцефалического барьера [13], уменьшении концентрации возбуждающих аминокислот ипровоспалительных интерлейкинов в поврежденных тканях мозга [3,15], уменьшенииперекисного окисления липидов [19]. Известно, что в экспериментальных и клиническихусловиях умеренная гипотермия достоверно снижает ВЧД, уменьшает зону ишемическогоповреждения мозга и может улучшить исходы при большом спектре патологии центральнойнервной системы: ЧМТ, ОНМК, отек мозга после остановки сердечной деятельности[10,16,20,23,25,31,32].
В приведенном наблюдении гипотермия во время ее проведения, во-первых, эффективностабилизировала ВЧД, во-вторых, позволила защитить мозг от ишемии. В отличие отартериальной ишемии, развивающейся, например, вследствие клипирования артерии, принарушении венозного оттока ишемия развивается позднее. Вначале появляется выраженныйгидростатический отек мозга. Именно этим манифестировало ухудшение состояния вприведенном наблюдении. Если коллатеральный или ретроградный венозный кровотокневозможен, то остро развивается несовместимый с жизнью отек мозга. При сохранностиколлатерального или ретроградного венозного кровотока, когда возможно егокомпенсаторное перераспределение, выраженность отека будет значительно варьировать[14]. При сохраняющемся нарушении оттока будут формироваться участки мозга, к которымне будет поступать адекватный объем артериальной крови. Вследствие этого разовьетсяишемия. Итак, при венозном инфаркте вначале развивается гидростатический отек, а затем– ишемия и ишемический отек. При артериальном инфаркте вначале развивается ишемия, азатем – отек. Поскольку в приведенном наблюдении при достижении нормотермии был регрессправостороннего гемипареза и восстановление сознания, а в дальнейшем не былодвигательных нарушений, то гипотермия, вероятно, имела церебропротективный эффект. Кроме этого, проведенная гипотермия обеспечила адекватные условия для выполнения впоследующем наружной декомпрессии.
Гипотермия является агрессивным методом коррекции ВЧГ. Наиболее часто описываемыми влитературе осложнениями являются гипокоагуляция [8,35], водно-электролитные нарушения[21], гемодинамические расстройства [12,34] и инфекционно-воспалительные осложнения[8,34]. Наиболее грозными проявлениями гипокоагуляции являются интракраниальныекровоизлияния. Это обусловило профилактическое использование свежезамороженной плазмы вприведенном наблюдении. Водно-электролитные нарушения при гипотермии проявляютсягипокалиемией и гипомагниемией [21]. Гемодинамические расстройства проявляются обычносинусовой брадикардией. Описаны более опасные нарушения ритма – асистолия и фибрилляцияжелудочков, однако, они развиваются или при температуре менее 28ºС или при длительностигипотермии более 48 часов [8,12,34]. Развившиеся в приведенном наблюдении гипокалиемия,гипомагниемия и гемодинамически незначимая брадикардия не угрожали витальным функциям ибыли корригированы незамедлительно при их развитии. Таким образом, умеренная гипотермияпоказала себя относительно безопасным методом контроля над ВЧД.
Период согревания является важным этапом в проведении гипотермии. В нашем наблюдениипри согревании появилась тенденция к повышению ВЧД. Это согласуется с данными рядаавторов. Так, Schwab S с соавторами показали, что согревание – это период высокогориска развития повторной и устойчивой ВЧГ, которая может приводить к летальному исходу[31,32]. Авторы доказали, что продолжительность согревания, превышающая 16 часов,достоверно уменьшает летальность. Поэтому скорость согревания в нашем наблюдениисоставила ≈ 0,05º в час. Не смотря на это, постепенно развилась устойчивая ВЧГ, чтостало показанием к выполнению наружной декомпрессивной трепанации с пластикой твердоймозговой оболочки. Выбранная тактика позволила не допустить усиления дислокации мозга исохранить структурность паренхимы мозга к моменту декомпрессии.
Данные литературы и наше наблюдение свидетельствуют о том, что гипотермия за счетсвоего церебропротективного эффекта, позволяет уменьшить зону уже сформировавшегосяишемического очага и не допустить дальнейшего ишемического повреждения. Однако в периодсогревания сохраняется риск развития повторной резистентной ВЧГ. В этих условияхнеобходимо выполнять наружную декомпрессию с пластикой твердой мозговой оболочки.
Гипотермия в этом случае будет создавать более благоприятные условия для выполненияоперации.
В заключение необходимо сказать, что у пациентов с опухолями базальной локализации враннем послеоперационном периоде возможно развитие отека мозга вследствие нарушениявенозного оттока. При этом стремительно развивается устойчивая ВЧГ. Дифференцироватьнарушение венозного оттока от других возможных причин развития отека мозга в остромпериоде достаточно сложно. Однако это состояние всегда необходимо рассматривать вкачестве возможной причины развития устойчивой ВЧГ. Умеренная гипотермия являетсяэффективным и безопасным методом коррекции отека мозга и ВЧГ при нарушении венозногооттока. Внутричерепная гипертензия, развившаяся на этапе согревания, являетсяпоказанием к выполнению наружной декомпрессии. И, конечно, необходимы дальнейшиеисследования в этом интересном и перспективном направлении.
Литература
- Беков Д.Б., Михайлов С.С. «Атлас артерий и вен головного мозга человека», М. Медицина, 1979, стр. 95-96.
- Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиалогия. М. Издательство Андреева Т.М., 1368 стр. 2007.
- Aibiki M, Maekawa S, Ogura S, et al: Effects of moderate hypothermia on systemic and internal jugular plasma IL-6 levels after traumatic brain injury in humans. J Neurotrauma 1999; 16:225-232.
- Alexandrov A, Joseph M: Transcranial Doppler: An Overview of its Clinical Applications. The Internet Journal of Emergency and Intensive Care Medicine 2000; Vol. 4, №1 (ISSN: 1092–4051).
- Bayir H, Clark RSB, Kochanek PM Promising strategies to minimize secondary brain injury after head trauma. Crit Care Med 2003; 31:S112-S117.
- Berntman L, Welsh FA, Harp JR: Cerebral protective effect of low-grate hypothermia. Anesthesiology 1981; 55:495-498.
- Bernard SA, Buist M Induced hypothermia in critical care medicine: A review. Crit Care Med 2003; 31:2041-2051.
- Bernard SA. Therapeutic hypothermia after cardiac arrest: Now a standard of care. Crit Care Med 2006; Vol. 34 P 923-924.
- Chopp M, Knight R, Tidwell CD, et al: The metabolic effects of mild hypothermia on global cerebral ischemia and recalculation in the cat: Comparison to normothermia and hyperthermia. J Cereb Blood Flow Metab 1989; 9:141-148.
- Colbourne F, Sutherland G, Gorbett D: Postischemic hypothermia: A critical appraisal with implications for clinical treatment. Mol Neurobiol 1997; 14:171-201.
- Csokay A, Pataki G, Nagy L, Belan K. Vascular tunnel construction in the treatment of severe brain swelling caused by trauma and SAH. (Evidence based on intra-operative blood flow measure). Neurological research 2002; 24:157-160.
- Danzl DF, Pozos RS: Accidental hypothermia. N Engl J Med 1994; 331:1756-1760.
- Dietrich WD, Busto R, Halley M, et al: The importance of brain temperature in alterations of the blood-brain barrier following cerebral ischemia. J Neuropathol Exp Neurol 1990; 49:486-497.
- Fries G, Wallenfang T, Hennen J, et al Occlusion of pig superior sagittal sinus, bridging and cortical veins: multistep evolution of sinus-vein thrombosis. J. Neurosurg. 1992; 77:127-133.
- Globus MY, Alonso O, Dietrich WD, et al: Glutamate release and free radical production following brain injury: Effects of posttraumatic hypothermia. J Neurochem 1995; 65:1704-1711.
- Goto Y, Kassell NF, Hiramatsu K, et al: Effects of intraischemic hypothermia on cerebral damage in a model of reversible focal ischemia. Neurosurgery 1993; 32:980-984.
- Greenberg MS. Handbook of neurosurgery. pp 609,611,891. Thieme, 2001.
- Hofmeijer J, van der Worp H, Kappelle LJ Treatment of space-occuring cerebral infarction. Crit Care Med 2003; 31:617-625.
- Karibe H, Chen SF, Zarow GJ, et al: Mild intraischemic hypothermia suppress consumption of endogenous antioxidants after temporary focal ischemia in rats. Brain Res 1994; 649:12-18.
- Kawai N, Okauchi M, Morisaki K, et al: Effects of delayed intraischemic and postischemic on a focal model of transient cerebral ischemia in rats. Strake 2000; 31:232-239.
- Koht A, Cane R, Cerullo LJ: Serum potassium levels during prolonged hypothermia. Int Care Med 1983; 9:275 – 277.
- Kurita H, Shin M, Ueki K, Kawamoto S, Kirino T. Congestive brain oedema associated with a pial arteriovenous malformation with impaired venous drainage. Acta Neurochir. 2001; 143:339-342.
- Maier CM, Sun GH, Kunis D, et al: Delayed induction and long-term effects of mild hypothermia in a focal model of transient cerebral ischemia: Neurological outcome and infarct size. J Neurosurg. 2001; 94:90-96.
- McElveen WA, Gonzales RF, Keegan A.P: Cerebral venous thrombosis. E-medicine (https://www.emedicine.com/neuro/topic642.htm), 2006.
- Nolan JP, Morley PT, Hoek TL, et al: Therapeutic hypothermia after cardiac arrest. An advisory statement by the Advancement Life support Task Force of the International Liaison Committee on Resuscitation. Resuscitation 2003; 57:231-235.
- Park JH, Yoon SH New concept of cerebrospinal fluid dynamics in cerebral venous sinus thombosis. Medical Hypotheses 2007, article in press.
- Polin RS, Shaffrey ME, Bogaev CA. Decompressive bifrontal craniectomy in the treatment of severe post-traumatic cerebral edema. Neurosurgery 1997; 41:84-92.
- Roberts I. Barbiturates for acute traumatic brain injury. Cochrane Database of Systematic Reviews 2005(2):CD000033.
- Saqqur M, Zygun D, Demchuk A: Role of transcranial Doppler in neurocritical care. Crit Care Med 2007; 35(5) Suppl May: S216-S223.
- Schreiber SJ, Stolz E, Valdueza JM: Transcranial ultrasonography of cerebral veins and sinuses. Eur J Ultrasound 2002 Nov; 16(1-2): 59-72.
- Schwab S, Georgiadis D, Berrouschot J, et al: Feasibility and safety of moderate hypothermia after massive hemispheric infarction. Stroke 2001; 32:2033-2035.
- Schwab S, Schwarz S, Spranger M, et al: Moderate hypothermia in the treatment of patients with severe middle cerebral artery infarction. Stroke 1998; 29:2461-2466.
- Stolz E, Kaps M, Kern A, et al.: Transcranial color-coded duplex sonography ofintracranial veins and sinuses in adults. Reference data from 130 volunteers. Stroke 1999 May;30(5): 1070 – 1075.
- The hypothermia after cardiac arrest study group: mild therapeutic hypothermia to improve the neurological outcome after cardiac arrest. New Engl J Med 2002; 346:549-556.
- Valeri CR, MacGregor H, Cassidy G, et al: Effects of temperature on bleeding time and clotting time in normal male and female volunteers. Crit Care Med 1995; 23:698-704.
Литература
- Arac A., Blanchard V., Steinberg G.K. Assessment of outcome following decompressive craniectomy for malignant middle cerebral artery infarction in patients older than 60 years of age. Neurosurg. Focus. 2009; 26: E3. DOI: 10.3171/2009.3.FOCUS0958
- Bohman L.E., Schuster J.M. Decompressive craniectomy for management of traumatic brain injury: an update. Curr. Neurol. Neurosci. Rep. 2013; 13: 392. DOI: 10.1007/s11910-013-0392-x
- Bor-Seng-Shu E., Figueiredo E.G., Amorium R.L., et al. Decompressive craniectomy: a meta-analysis of influences on intracranial pressure and cerebral perfusion pressure in the treatment of traumatic brain surgery. J. Neurosurg. 2012; 117: 589–596. DOI: 10.3171/2012.6.JNS101400
- Coutinho J.M. Cerebral venous thrombosis. J. Thromb. Haemost. 2015: 13(Suppl. 1): S238–S244. DOI: 10.1111/jth.12945
- Merenda A., DeGeorgia M. Craniectomy for acute ischemic stroke: how to apply the data to the bedside. Curr. Opin. Neurol. 2010; 23: 53–58. DOI: 10.1097/WCO.0b013e328334bdf4
- Rahme R., Zuccarello M., Kleindorfer D., et al. Decompressive hemicraniectomy for malignat middle cerebral artery territory infarction: is life worth living? J. Neurosurg. 2012; 117: 749–754. DOI: 10.3171/2012.6.JNS111140
- Raza E., Shamim M.S., Wadiwala M.F., et al. Decompressive surgery for malignant cerebral venous sinus thrombosis: a retrospective case series from Pakistan and comparative literature review. J. Stroke Cerebrovasc. Dis. 2014; 23: e13–e23. DOI: 10.1016/ j.jstrokecerebrovasdis.2013.07.045
- Sahuquillo J., Martinez-Ricarte F., Poca M.A. Decompressive craniectomy in traumatic brain injury after DECRA trial. Where do we stand? Curr. Opin. Crit. Care. 2013; 19: 101–106. DOI: 10.1097/MCC.0b013e3285eba1a
- Wijdicks E.F., Sheth K.N., Carter B.S., et al. AHA Stroke Council. Recommendations for management of cerebral and cerebellar infarction with swelling: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2014; 45: 1222–1238. DOI: 10.1161/01.str.0000441965.15164.d6
- Hill C.S., Luoma A.M., Wilson S.R., Kitchen N. Titanium cranioplasty and prediction of complications. Br. J. Neurosurg. 2012; 26: 832–837. DOI: 10.3109/02688697.2012.692839
- Klinger D.R., Madden C., Beshay J., et al. Autologous and acrylic cranioplasty: a review of 10 eyars and 258 cases. World Neurosurg. 2014; 82: e525–e530. DOI: 10.1016/j.wneu.2013.08.005
- Schwarz F., Dunisch P., Walter J., et al. Cranioplasty after decompressive craniectomy: is there a rationale for an initial artificial bone-substitute implant? A single-center experience after 631 procedures. J. Neurosurg. 2015; 124: 1–6. DOI: 10.3171/2015.4.JNS159
- Durga P., Sahu B.P. Neurological deterioration during intubation in cervical spine disorders.Indian J.Anaesth. 2014; 58: 684–692. DOI: 10.4103/0019–5049.147132
- Harris E.A. Airway management for the patient with an unstable cervical spine. In: Ruskin K.J., Rosenbaum S.H., Rampil I.J. (Eds.). Fundamentals of Neuroanesthesia. 2014. Oxford Univ. Press. P. 288–303.
- Amoozegar F., Ronskley P.E., Sauve R., Menon B.K. Hormonal contraceptives and cerebral venous thrombosis risk: a systematic review and meta-analysis. Front. Neurol. 2015; 6, A7: 1–11. DOI: 10.3389/fneur.2015.00007
- Coutinho J.M., Majoie C.B., Coert B.A., Stam J. Decompressive hemicraniectomy in cerebral sinus thrombosis: consecutive case series and review of the literature. Stroke. 2009; 40: 2233–2235. DOI: 10.1161/STROKEAHA.108.543421
- Ferro J.M., Canhao P. Cerebral venous sinus thrombosis: update on diagnosis and management. Curr. Radiol Rep. 2014; 16: 523. DOI: 10.1007/s11886-014-0523-2
- Fischer C., Goldstein J., Edlow J. Cerebral venous sinus thrombosis in the emergency department: retrospective analysis of 17 cases and review of the literature. J. Emerg. Med. 2010; 38: 140–147. DOI: 10.1016./jemermed.2009.08.061
- Kenmur C.L., Jovin T., Jadhav A. Cerebral venous sinus thrombosis in users of a hormonal vaginal ring. Obstet. Gynecol. 2015; 126: 830–833. DOI: 10/1097/AOG.0000000000000931
- Siudut J., Swiat M., Undas A. Altered fibrin clot properties in patients with cerebral venous sinus thrombosis: Association with the risk of recurrence. Stroke. 2015; 46: 2666–2668. DOI: 10.1161/STROKEAHA.115.009528
- Agner C., Dujovny M., Gaviria M. Neurocognitive assessment before and after cranioplasty. Acta Neurochir. 2002; 144: 1033–1040.
- Decaminada N., Pernter P., Imondi A., Tomassini A. CT perfusion evaluation of cerebral hemodynamics before and after cranioplasty. Neuroradiol. J. 2008; 21: 459–471. DOI: 10.1177/19714009080210042
- Erdogan E., Duz B., Kokaoglu M., Izci Y., Nimurkaynak E. The effect of cranioplasty on cerebral hemo-dynamics: evaluation with transcranial Doppler sonography. Neurol. India. 2003; 51: 479–481.
- Kemmling A., Duning T., Lemcke L., et al. Case report of MR perfusion imaging in sinking skin flap syndrome: growing evidence for hemodynamic impairment. BMC Neurol. 2010; 10: 80. DOI: 10.1186/1471-2377-10-80
- Jelcic N., Della Puppa A., Mottaran R., et al. Case series evidence for improvement of executive functions after late cranioplasty. Brain Inj. 2013; 27: 1723–1726. DOI: 10.3109/02699052.2013.844857.
- Jeyaraj P. Importance of early cranioplasty in reversing the “Syndrome of the trephine/motor trephine syndrome/sinking skin flap syndrome”. J. Maxillofac. Oral. Surg. 2015; 14: 666–673. DOI: 10.1007/s12663-014-0673-1
- Kuo J.R., Wang C.C., Chio C.C., Cheng T.J. Neurological improvement after cranio-plasty — analysis by transcranial Doppler ultrasonography. J. Clin. Neurosci. 2004; 11: 486–489. DOI: 10.1016/j.jocn.2003.06.005
- Song J., Liu M., Mo X., et al. Beneficial impact of early cranioplasty in patients with decompressive craniectomy: evidence from trenscranial Doppler ultrasonography. Acta Neurochir. 2014; 156: 193–198. DOI: 10.1007/s00701-013-1908-5
- Winkler P.A., Stummer W., Linke R., et al. The influence of cranioplasty on postural blood flow regulation, carabrovascular reserve capacity, and cerebral glucose metabolism. Neurosurg. Focus. 2000; 8: e9. DOI: 10.3171/foc.2000.8.1.1920
- Sakamoto S., Eguchi K., Kiura Y., et al. CT perfusion imaging in the syndrome of the sinking flap before and after cranioplasty. Clin. Neurol. Neurosurg. 2006; 108: 583–585. DOI: 10.1016/j.clineuro.2005.03.012
- Annan M., De Toffol B., Hommet C., Mondon K. Sinking skin flap syndrome (or syndrome of the trephined): A review. Br. J. Neurosurg. 2015; 29: 314–318. DOI: 10.3109/02688697.2015.1012047
- Honeybul S. Neurological susceptibility to a skull defect. Surg. Neurol. Int. 2014; 5: 83. DOI: 10.4103/2152–7806.133886
- Honeybul S., Janzen C., Kruger K., Ho K.M. The incidence of neurological instability to a skull defect. World Neurosurg. 2015; pii: S1878–8750(15)01249–8. DOI: 10.1016/j.2neu.2015.09.081.
- Chan K.W., Datta N.N. Iatrogenic acute subdural hematoma due to drainage catheter. Surg. Neurol. 2000; 54: 444–446.
- Karamchandani K., Chouhan R.S., Bithal P.K., Dash H.H. Severe bradicardia and hypotension after connecting negative pressure to the subgaleal drain during craniotomy closure. Br. J. Anaesth. 2006; 96: 608–610. DOI: 10.1093/bja/ael063
- Mohindra S., Mukherjee K.K., Chhabra K.K., Khosla V.K. Subgaleal suction drain leading to fatal sagittal sinus hemorrhage. Br. J. Neurosurg. 2005; 19: 352–354. DOI: 10.1080/02688690500305308
- Prabhakar H., Bithal P.K., Chouhan R.S., Dash H.H. Rupture of intracranial aneurysm after partial clipping due to aspiration drainage system — a case report. Middle East J. Anaesthesiol. 2008; 19: 1185–1190.
- Roth J., Galeano E., Milla S., et al. Multiple epidural hematomas and hemodynamic collapse caused by a subgaleal drain and suction-induced intracranial hypotension: case report. Neurosurgery. 2011; 68: E271–E276. DOI: 10.1227/NEU.0b013e3181fe6165
- Toshniwal G.R., Bhagat H., Rath G.P. Bradycardia following negative pressure suction of subgaleal drain during craniotomy closure. Acta Neurochir. 2007; 149: 1077–1079. DOI: 10.1007/s00701-007-1246-6
- Van Roost D., Thees C., Brenke C., et al. Pseudohypoxic brain swelling: a newly defined complication after uneventful brain surgery, probably related to suction drainage. Neurosurgery. 2003; 53: 1315–1326. DOI: 10.1227/01.neu.0000093498.08913.9e
- Yadav M., Nikhar S.A., Kulkarni D.K., Gopinath R. Cardiac arrest after connecting negative pressure to the subgaleal drain during craniotomy closure. Case Rep Anesthesiol. 2014; 2014: Article ID 146870. DOI: 10.1155/2014/146870
- Chitale R., Tjoumakaris S., Gonzalez F., et al. Infratentorial and supratentorial strokes after cranioplasty. Neurologist. 2013; 19: 17–21. DOI: 10.1097/NRL.0b013e31827c6bb6
- Honeybul S. Sudden death following cranioplasty: a complication of decompressive craniectomy for head injury. Br. J. Neurosurg. 2011; 25: 343–345. DOI: 10.3109/02688697.2011.568643
- Lee G.S., Park S.Q., Kim R., Cho S.J. Unexpected severe cerebral edema after cranioplasty: Case report and literature review. J. Korean Neurosurg. Soc. 2015; 58: 76–78. DOI: 10.3340/jkns.2015.58.1.76
- Santana-Cabrera L., Perez-Ortiz C., Rodriguez-Escort C., Sanchez-Palacios M. Massive postoperative swelling following cranioplasty. Int. J. Crit. Illn. Inj. 2012; 2: 107–108. DOI: 10.4103/2229–5151.97277
- Zebian B., Critchley G. Sudden death following cranioplasty: a complication of decompressive craniectomy for head injury. Br. J. Neurosurg. 2011; 25: 785–786. DOI: 10.3109/02688697.2011.623801
- Robles A., Cuevas-Solorzano A. Massive brain swelling and death after cranioplasty: A systematic review. World Neurosurg. 2018; 111: 98–108. DOI: 10.1016/wneu2017.12.061
- Spetzler R.F., Wilson C.D., Weinstein P., et al. Normal perfusion pressure breakthrough theory. Clin. Neurosurg. 1978; 25: 651–672.
- Petrozza P.H. Hyperemic complications following resection of arterio-venous malformation: New througts. J. NS Anesth. 1995; 7: 202.
- Dodson B.A. Normal perfusion pressure breakthrough syndrome: Entity or excuse? J. NS Anesth. 1995; 7: 203–207.
- Al-Rodhan N.R.F. Occlusive hyperemia remains the most logical explanation for the hemodynamic complications of resected intracerebral arteriovenous malformations. J. NS Anesth. 1995; 7: 208–210.
- Moulakakis K.G., Mylonas S.N., Styroeras G.S., Andrikopoulos V. Hyperperfusion syndrome after carotid revascularization. J. Vasc. Surg. 2009; 49: 1060–1068. DOI: 10.1016/j.jvs.2008.11.026
- Medel R., Crowley R.W., Dumont A.S. Hyperperfusion syndrome following endovascular cerebral revascularization. A review. Neurosurg. Forum. 2009; 26: E4. DOI: 10.3171.2009.1.FOCUS08276
- Lieb M., Shah U., Hines G.L. Cerebral hyperperfusion syndrome after carotid intervention: A review. Cardiol. Rev. 2012; 20: 84–89. DOI: 10.1097/CRD.0b013e318237eef8
- Farooq M.U., Goushganian C., Min J., Gorelik P.B. Pathophysiology and management of reperfusion injury and hyperperfusion syndrome after carotid endarterectomy and carotid artery stenting. Exp. Transl. Stroke Med. 2016; 8: 7. DOI: 10.1186/s13231-016-0021-2
Восстановление после трепанации черепа
Первые послеоперационные сутки являются решающими для пациента. Его переводят в палату интенсивной терапии, где процессы жизнедеятельности поддерживаются специальными медицинскими аппаратами.
За пробуждением больного после наркоза неусыпно наблюдает медперсонал.
При необходимости операционную рану дренирует, обеспечивая отход лишней жидкости. За чистотой дренажа требуется тщательный уход, поскольку инфицирование грозит менингитом.
Трепанация черепа серьезная операция и швы снимают через 7-10 дней.
Срок пребывания в реанимации составляет не меньше недели и зависит исключительно от скорости восстановительных способностей пациента.
Медикаментозное лечение в реабилитационном периоде направлено на предупреждение развития осложнений или при появлении новых патологий.
- Обязательны обезболивающие. Пациентов беспокоят как настоящие, так и фантомные боли, в том числе психосоматические боли.
- Антибиотики помогают избежать появления воспаления.
- Противорвотные и противосудорожные предупреждают самые частые синдромы повреждения мозга.
- Мочегонные препараты служат для предотвращения отека мозга.
Повязку меняют ежедневно, а спустя два дня больной пробует вставать. При хорошем восстановительном темпе через несколько дней – пациент может вполне уверенно передвигаться самостоятельно.
Восстановление не ограничивается стационаром. После возвращения домой пациент также должен тщательно соблюдать все врачебные предписания. Категорически запрещены:
- поднятие тяжестей более 3 кг;
- наклоны;
- курение и алкоголь;
- стрессы.
Даже если явных ошибок в произношении нет, для устранения речевых нарушений рекомендованы регулярные занятия с логопедом.
Полезны ежедневные короткие прогулки с сопровождением и сбалансированная, низкосолевая диета.
Если эмоциональный фон пациента, подверженного депрессии не удается откорректировать, нужно обратиться к психологу.