Общие сведения о фокальной эпилепсии
Определение «фокальная эпилепсия» соединяет все формы эпилептических пароксизмов, которые возникают из-за наличия локального очага повышенной эпи-активности в церебральных структурах. Эпилептическая активность начинается фокально, но может распространяться от очага возбуждения на окружающие ткани головного мозга, что обуславливает вторичную генерализацию эпиприступа. Важно дифференцировать пароксизмы ФЭ и приступы генерализованной эпилепсии с первично-диффузным характером возбуждения. Помимо этого, существует мультифокальная форма эпилепсии. При этой форме эпилепсии имеются несколько локальных эпилептогенных зон в головном мозге.
Примерно 82% от всех эпилептических синдромов составляет фокальная эпилепсия, причём в 75% случаев она начинается в детском периоде. Чаще всего она возникает на фоне травматического, ишемического или инфекционного поражения, нарушений развития головного мозга. Вторичная фокальная эпилепсия подобного характера диагностируется у 71% всех пациентов, страдающих эпилепсией.
Что может спровоцировать возникновение приступа у больного эпилепсией?
Обычно приступы возникают без предшествующих факторов (случайно) и полностью непредсказуемы. Однако, некоторые пациенты замечают определенные состояния, которые могут провоцировать возникновение приступов. После выявления провоцирующих факторов можно принять меры по их избеганию, что будет способствовать снижению частоты эпилептических приступов в дальнейшем. Примерами факторов, провоцирующих приступы у некоторых пациентов, являются мелькающий свет, ограничение сна, стрессовые ситуации, прием алкоголя или некоторых лекарств.
Женщины, страдающие эпилепсией, часто жалуются на повышение частоты приступов во время менструации, что, вероятно связанно с гормональными изменениями и задержкой жидкости.
Патогенез фокальной эпилепсии
Причинами развития фокальной эпилепсии являются: пороки развития, которые затрагивают ограниченный участок головного мозга (артериовенозные мальформации головного мозга, фокальная корковая дисплазия, врождённые церебральные кисты и т. п.), черепно-мозговые травмы, инфекции (абсцесс головного мозга, энцефалит, нейросифилис, цистицеркоз), нарушения сосудистой системы (перенесенный геморрагический инсульт), метаболическая энцефалопатия, опухоли головного мозга. При ФЭ одними из этиологических факторов при сохранной морфологии нейронов и мозгового вещества в целом могут быть приобретенные и генетически обусловленные метаболические дефекты нейронов некоторой зоны коры больших полушарий.
Перинатальные поражения ЦНС являются ведущей причиной среди факторов возникновения фокальной эпилепсии. Такими поражениями являются: гипоксия плода, асфиксия новорожденного, внутричерепная родовая травма, внутриутробные инфекции. Появление фокального паталогического очага в детском возрасте может быть связано с нарушением созревания коры.
Патофизиологической основой ФЭ выступает эпилептогенный фокус, в котором выделяют несколько зон. Зона патологического повреждения соответствует участку морфологических изменений церебральной ткани, которую можно зафиксировать при помощи МРТ.
Первичная зона — это та часть мозговой коры, в которой генерируются эпи-разряды.
Симптоматогенная зона – это область коры, при возбуждении которой возникает эпилептический приступ. Ирритативная зона— это область, которая регистрируется на ЭЭГ в межприступный промежуток, и является источником эпилептического приступа.
Зона функционального дефицита — это участок, отвечающий за неврологические расстройства, которые сопутствуют эпиприступам.
Опасны ли эпилептические приступы для жизни больного?
Часто считается, что эпилепсия — это доброкачественное заболевание с низкой летальностью. Однако на самом деле эпилепсия сочетается с повышенным уровнем летальности, особенно, это касается молодых пациентов (моложе 40 лет) и пациентов с тяжёлым течением эпилепсии. В целом, уровень летальности у больных с эпилепсией в 1,5–3 раз выше, чем в общей популяции (по данным популяционных исследований). Уровень смертности у мужчин выше, чем у женщин, и выше в первые 10 лет после диагностики эпилепсии.
Наиболее частые причины летального исхода у людей с эпилепсией — инфекционные заболевания органов грудной полости (бронхопневмония, особенно, у пожилых), новообразования и летальный исход, непосредственно связанный с приступами. Летальный исход крайне редко возникает в результате побочных эффектов лечения (острых и тяжелых реакций непереносимости препарата).
Отчасти, повышение риска для больных эпилепсией связано с тем, что в основе эпилепсии может лежать тяжелое или прогрессирующее заболевание мозга (опухоли, травмы, цереброваскулярные заболевания, и т. д.). И именно эти заболевания, а не приступы как таковые, могут стать причиной неблагоприятного прогноза.
С другой стороны, повторные эпилептические приступы могут создавать множество ситуаций, угрожающих жизни пациента. Смертельные случаи, непосредственно связанные с приступами, подразделяются на несколько категорий: эпилептический статус, смерть, связанная с эпилептическим приступом, синдром внезапной смерти и несчастные случаи.
Наиболее опасен эпилептический статус генерализованных судорожных приступов. Летальный исход наступает в 10% всех случаев статуса генерализованных тонико-клонических приступов.
Классификация фокальной эпилепсии
Выделяют симптоматические, идиопатические и криптогенные формы фокальной эпилепсии. При симптоматической форме можно установить источник и причину появления патологии , а так же выявить морфологические изменения, которые фиксируются при томографических исследованиях.
Особенностью криптогенной ФЭ является то, что, не смотря на ее вторичный характер, ни один из существующих методов визуализации не способен выявить морфологические нарушения в структуре головного мозга.
Для идиопатической ФЭ не характерны типичные для данной группы патологий дефекты головного мозга. Субстратом для ее развития, как правило, выступает наследственная предрасположенность: генетически детерминированные каналопатии, дефекты мембран клеток ЦНС, дисгенезии коры больших полушарий. Прогноз при данном заболевании благоприятный, течение доброкачественное. Идиопатическая ФЭ включает: доброкачественную роландическую эпилепсию, детскую затылочную эпилепсию Гасто, синдром Панайотопулоса, доброкачественные затылочные эпилептические синдромы.
Наследственная эпилепсия и гены
В 70–80 % случаев это заболевание обусловлено генетически. На сегодняшний день известно более 400 генов, мутации в которых могут вызвать болезнь. Родители могут быть носителями такой мутации и способны передавать ее по наследству своим детям.
Фебрильные судороги — самая распространенная форма судорожного синдрома. Это заболевание картируется на хромосомах 8ql3-21, 2q23-24, 19р13.3. Гены, предрасполагающие к ювенильной миоклонической наследственной эпилепсии, — на хромосомах 6р 11—12 и 15ql4, к взрослой — на хромосоме 8q24, к младенческой — в хромосомном локусе 16р13.
Исследование генетических маркеров позволяет определить форму этого заболевания и вероятность его наследования. Пройти такой тест можно в медико-генетическом . Панель «Наследственные эпилепсии» предоставляет информацию, которая помогает планировать тактику терапии заболевания, прогнозировать его течение, исключить необходимость операции и принять решение относительно деторождения.
Симптомы фокальной эпилепсии
Фокальная эпилепсия характеризуется парциальными фокальными эпилептическими пароксизмами. Пароксизмы бывают простые, не сопровождающиеся потерей сознания, и сложные, без утраты сознания. Простые парциальные эпилептические припадки бывают вегетативными, соматосенсорными, моторными, сенсорными, с галлюцинаторным компонентом и с психическими расстройствами.
Сложные парциальные эпилептические приступы могут начинаться как простые, но затем происходит повреждение сознания. После припадка может быть спутанность сознания.
Вторично генерализованные парциальные припадки начинаются как простой или сложный фокальный приступ, но затем возбуждение переходит и на другие отделы коры головного мозга. Таким образом пароксизм приобретает клонико-тонический вид. У больного могут фиксироваться различные виды парциальных пароксизмов.
Симптоматическая фокальная эпилепсия сопровождается той симптоматикой, которая соответствует основному поражению мозга. Данный вид эпилепсии характеризуется снижением интеллекта, задержкой психического развития и нарушением когнитивной сферы ребенка.
Идиопатическая фокальная эпилепсия доброкачественна, и не характеризуется нарушениями психических и интеллектуальных сфер.
Эпилепсия у детей и подростков является важнейшей социально-медицинской проблемой современности. Несмотря на широкий выбор существующих противоэпилептических препаратов (ПЭП), приступы у более чем 25% детей с эпилепсией продолжаются [30]. Традиционные ПЭП не всегда достаточно эффективны [56]. Поэтому в настоящее время в литературе появилось большое число работ, посвященных терапевтической эффективности новых ПЭП [36].
В лечении фокальных форм эпилепсии применяются ПЭП разных генераций. В 1912 г. был синтезирован первый противосудорожный препарат фенобарбитал, более 30 лет остававшийся единственным ПЭП на фармацевтическом рынке. С 60-х годов он являлся препаратом первой и второй очереди выбора при различных типах эпилептических приступов. Однако в настоящее время его применение у детей ограничено вследствие выраженного седативного эффекта [50]. Тем не менее до сих пор фенобарбитал занимает определенное место в лечении детей с эпилепсией, особенно в раннем возрасте [24]. Фенобарбитал применяется при всех формах эпилепсии, сопровождающихся генерализованными судорожными приступами [35]. Он более эффективен при простых парциальных приступах и менее эффективен при сложных парциальных. Его не следует назначать при абсансах, миоклонически-астатических приступах и синдроме Веста. Фенобарбитал нередко назначается при неонатальных судорогах [19, 21, 29], за исключением применения у детей, родившихся с весом менее 1800 грамм [65], а также при типичных фебрильных судорогах [46, 51]. Он является препаратом второй линии в купировании эпилептического статуса [43, 60]. В лечении эпилепсии у детей достаточно широко используются также вальпроаты и карбамазепин.
В терапии фокальных форм эпилепсии в детском возрасте часто применяются ПЭП и новой генерации — топирамат (топамакс, «Janssen-silag») и ламотриджин (ламиктал, «GlaxoSmithKlain»). Следует отметить, данные препараты появились на отечественном фармацевтическом рынке с 90-х годов и применяются в детской практике при неэффективности традиционных ПЭП и, как правило, в комбинации с ними [48].
Топирамат (топамакс) — новый высокоэффективный препарат с широким терапевтическим спектром [17, 41]. Он относится к классу сульфамат-замещенных моносахаридов и обладает комплексным механизмом действия [18, 37]. Топирамат показан при парциальных и генерализованных приступах как в монотерапии, так и в комбинации с другими ПЭП [39]. Он применяется при лечении приступов, связанных с синдромом Леннокса-Гасто [38, 40] и синдромом Веста [14, 57], может назначаться взрослым и детям с впервые диагностированной эпилепсией.
Ламотриджин (ламиктал) — препарат широкого спектра действия для лечения всех типов приступов [10, 12, 26], за исключением миоклонических [22]. Он рекомендуется при фокальных и генерализованных, идиопатических и симптоматических эпилептических синдромах у взрослых и детей [59]. Ламотриджин предотвращает эффект вторичной генерализации приступа, угнетая диффузное распространение эпилептиформной активности [10]. Также является препаратом выбора в лечении синдрома Леннокса-Гасто [42], синдрома Веста [13], синдрома Ангельмана [25].
Цель настоящего исследования состояла в анализе эффективности ПЭП разных фармакологических групп в лечении фокальных форм эпилепсии у детей в условиях городского эпилептологического центра.
Материал и методы
В исследование были включены 96 пациентов, 55 (57%) мальчиков и 41 (43%) девочка, с верифицированным диагнозом: симптоматическая фокальная эпилепсия или предположительно симптоматическая (криптогенная) фокальная эпилепсия. Возраст больных варьировал от 1 мес до 17 лет. Больных наблюдали от возраста 6 мес до 4 лет 6 мес.
Диагноз эпилепсии и определение характера приступов проводились в соответствии с Международной классификацией эпилепсии, эпилептических синдромов и схожих заболеваний (Нью-Дели, 1989).
В каждом случае проводился подробный сбор анамнестических данных и оценивался неврологический статус.
В динамике записывалась ЭЭГ (в некоторых случаях осуществлялось видео-ЭЭГ-мониторирование с включением периода сна). Исследование проводилось по стандартной методике 10-20 на 19-канальном аппарате Нейрон-спектр (Иваново) или аппарате Энцефалан-131-03, модификация 11, (Таганрог). Нейровизуализация включала проведение компьютерной томографии головного мозга, либо МРТ на томографах 0,5-1,5 Тл. Также проводился контроль общего и биохимического анализов крови с целью исключения побочных эффектов терапии.
Основными причинами включения больных в исследование были отсутствие или утрата эффекта от предшествующей терапии и сохранение приступов, а также возникновение нежелательных побочных явлений при применении традиционных ПЭП; в единичных случаях новые ПЭП применялись в стартовой монотерапии.
Согласно рекомендациям Международной противоэпилептической лиги (1998), в последние годы вводятся ограничения на применение фенобарбитала в детском возрасте в связи с возникновением возможных побочных эффектов на развитие когнитивных функций у детей. Поэтому источником информации о пациентах, получающих фенобарбитал, служили истории болезней стационарных больных, лечившихся по поводу эпилепсии в неврологической клинике в 2000-2005 гг. Они составили 1-ю группу пациентов. В эту группу были включены 34 пациента в возрасте от 1 мес до 11 лет 9 мес. В 94% случаев фенобарбитал применялся в стартовой монотерапии. Впоследствии 18% пациентов получали комбинированную терапию фенобарбиталом с другими ПЭП. Дозы препарата в исследовании варьировали от 12 до 300 мг в сутки, в среднем они составляли около 170 мг в сутки. Из расчета на килограмм массы тела дозы фенобарбитала назначались в широких терапевтических диапазонах от 1,5 до 12 мг/кг в сутки, в среднем составляя 6,4 мг/кг в сутки. 2-я группа пациентов состояла из 31 пациента в возрасте от 24 мес до 16 лет и получала терапию топираматом. У 12 (39%) пациентов препарат применялся как стартовая или альтернативная монотерапия. В комбинации с одним ПЭП топирамат был назначен 13 (42%) пациентам. Комбинированная терапия топирамата с 2 ПЭП проводилась 6 (19%) пациентам. Дозы препарата в исследовании варьировали от 56 до 500 мг в сутки, в среднем составляя около 165 мг в сутки. Из расчета на килограмм массы тела дозы топирамата назначались в широких терапевтических диапазонах от 2,8 до 17 мг/кг в сутки, в среднем составляя 6,6 мг/кг в сутки.
3-я группа больных лечилась ламотриджином. Он применялся у 31 пациента в возрасте от 1 года 10 мес до 17 лет. Во всех случаях препарат был назначен в качестве дополнительной терапии к одному или двум другим ПЭП. В процессе лечения 3 (10%) пациента были переведены на альтернативную монотерапию данным препаратом. Ламотриджин назначался в дозах от 25 до 250 мг в сутки, в среднем — 116 мг в сутки. Из расчета количества препарата на массу тела ребенка дозы варьировали в диапазоне от 0,5 до 6 мг/кг в сутки, в среднем составляя 3,6 мг/кг в сутки. Во всех трех группах титрование препаратов проводилось согласно общепринятым рекомендациям по приему препаратов.
Общая характеристика пациентов каждой из групп приведена в табл. 1.
Клиническим критерием эффективности терапии является прекращение приступов или изменение их частоты на фоне проводимой противоэпилептической терапии. Поэтому результат оценивался по влиянию на частоту приступов по стандартным критериям: полная клиническая ремиссия (купирование приступов на 100% в течение 12 мес и более); урежение частоты приступов на 50% и более; урежение частоты приступов менее чем на 50% или отсутствие эффекта; аггравация приступов. Проводилась оценка влияния исследуемых ПЭП после их введения на качество приступов: их характер, длительность и интенсивность.
Результаты
В каждой группе бо`льшую часть составили дети с симптоматическими фокальными формами эпилепсии — 77, 85 и 86% случаев. Соответственно, доля пациентов с криптогенными фокальными формами эпилепсии была значительно меньше — 23, 15 и 14% соответственно. Во всех трех группах чаще выявлялись симптоматические фокальные лобные эпилепсии — 20, 26, 39%; мультифокальные эпилепсии — 12, 19, 22,5%. Поскольку до 2005 г. технической возможности для проведения ЭЭГ-мониторинга не имелось, в группе пациентов, получавших лечение фенобарбиталом, в 35% случаев была диагностирована нелокализованная форма эпилепсии.
Анализируя и сравнивая анамнез развития заболевания, выявлено, что эпилепсия чаще дебютировала в возрасте до 7 лет и в среднем по группам дебют был в возрасте: 3 года 11 мес в 1-й группе пациентов, получавших фенобарбитал; 3 года 1 мес во 2-й группе получавших топамакс; 4 года 6 мес в 3-й группе получавших ламиктал. Достоверно доказано, что более ранний дебют заболевания выявлен у детей (р<0,01), чьи матери имели отягощающие факторы во время беременности (угроза прерывания беременности, внутриутробные инфекции) и патологию во время родов. Более ранним дебют эпилепсии был в группе пациентов с выраженными очаговыми нарушениями в неврологическом статусе (р<0,05) и с выраженным отставанием в развитии на первом году жизни (р<0,05).
Пациенты, получавшие фенобарбитал, имели наименьшую длительность заболевания от момента дебюта приступов до начала приема препарата — в среднем 1 мес 24 дня, и у 94% пациентов фенобарбитал был первым препаратом в терапии эпилепсии; 6% пациентов перешли на прием фенобарбитала после неуспешного лечения другими ПЭП.
Иначе выглядел анамнез заболевания в двух других группах. В группе пациентов, принимавших топирамат, средний срок заболевания до включения препарата в протокол лечения составил 4 года 8 мес, и практически все пациенты (94%) уже получали предшествующую терапию другими ПЭП. В 61% случаев применялась комбинированная противоэпилептическая терапия. В группе пациентов, принимавших ламотриджин, средний срок заболевания составил 5 лет 2 мес и все пациенты до начала приема препарата также имели предшествующую противоэпилептическую терапию. В 90% случаев ламотриджин в исследовании применялся в комбинации с другими ПЭП. Статистически доказано, что чем длительнее был срок заболевания, тем больше разных ПЭП применялось в лечении пациентов (р<0,05).
Во всех трех группах бо`льшая часть всех пациентов имела выраженную неврологическую патологию в виде спастических парезов, патологии функций черепно-мозговых нервов, мозжечковой симптоматики, задержки психического развития — от 71 до 87% пациентов. Следовательно, и задержка в развитии детей на первом году жизни наблюдалась у 65-76% пациентов (см. табл. 1). Проводя анализ наблюдаемых приступов, было выявлено, что во всех группах преобладали вторично-генерализованные судорожные приступы, которые составили 40-50% от всех видов. Чаще они регистрировались у детей с более ранним дебютом заболевания (р<0,01).
При оценке эффективности исследуемых препаратов были получены результаты, которые обобщены в табл. 2.
Полное прекращение приступов при применении препаратов старой генерации (фенобарбитала) и новой генерации (ламиктала и топамакса) имело место у одинакового количества пациентов в каждой из исследуемых групп — в 26% случаев. Однако отмечены различия в показателях уменьшения частоты приступов на 50% и более. Самый высокий результат получен у пациентов, принимавших топирамат, — 19 (61%). У пациентов, принимавших ламотриджин, этот показатель оказался несколько ниже — 14 (45%) пациентов. И всего у 4 (12%) больных, лечившихся фенобарбиталом, приступы сократились на 50% и более. Соответственно в этой группе был самый высокий процент случаев, в которых эффект отсутствовал или был минимален — 21 (62%) пациент.
Из приведенных данных видно, что наиболее выраженный положительный эффект в виде полного купирования приступов либо их прекращения на 50% и более достигнут в группе пациентов, получавших топирамат, — 87% (27 пациентов). В группе пациентов, принимавших ламотриджин, этот показатель составил 71% (22 пациента). И самым минимальным был эффект у пациентов, получавших лечение фенобарбиталом, — 38% (13 пациентов). Мы не выявили существенного различия в регистрации положительной динамики на ЭЭГ во всех трех группах. Уменьшение индекса эпилептиформной активности отмечено у 8 (24%) пациентов, принимавших фенобарбитал, у 8 (26%) пациентов, принимавших топамакс, у 11 (35%) пациентов, принимавших ламиктал. Статистически подтверждено наличие различий в эффективности лечения в трех исследуемых группах.
Обсуждение
Полученные нами результаты исследования мы сравнили с имеющимися в литературе данными. В связи с этим напомним, что при лечении фенобарбиталом, мы отметили стойкую клиническую ремиссию или полное прекращение приступов в 26% случаев и урежение частоты приступов на 50% и более у 12% пациентов. Таким образом, положительного эффекта удалось достичь в общей группе у 38% пациентов. Низкая эффективность в лечении наблюдалась у 62% пациентов. Полученные нами результаты коррелируют с исследованиями многих авторов. В своем наблюдении С.Р. Болдырева [2] отмечает полный контроль приступов у 33% пациентов. В обзоре О.А. Пылаевой и соавт. [11] проведено сравнение эффективности и переносимости барбитуратов и вальпроатов у детей в возрасте от 6 мес до 15 лет. Вальпроаты применялись в дозах 30-50 мг/кг в сутки, барбитураты — в среднетерапевтической дозе 2-5 мг/кг в сутки. Терапевтический эффект в монотерапии зарегистрирован в 65% случаев на фоне приема вальпроатов и только в 30% случаев при терапии барбитуратами. В 75% случаев улучшение состояния пациентов на фоне приема барбитуратов было временным, в дальнейшем частота приступов вновь увеличилась. В работе А.А. Даутова и соавт. [5] проведен сравнительный анализ монотерапии эпилепсии фенобарбиталом и дифенином у пациентов с разными формами эпилепсии. Фенобарбитал применялся в среднесуточной дозе 2,0-2,5 мг/кг в сутки, а дифенин — в дозе 4-5 мг/кг в сутки. В результате приступы прекратились у 7 (16%) из 44 человек, получавших фенобарбитал, и у 35 (из 60), получавших дифенин. В исследование W. Wang и соавт. [58] были включены 2455 пациентов. Через 24 мес от начала лечения фенобарбиталом 26,2% пациентов не имели приступов и 31,3% пациентов имели уменьшение приступов на 75% и более.
Между тем некоторые авторы отмечают более высокую эффективность при лечении фенобарбиталом. Так, в исследовании D. Pal и соавт. [45] фенобарбитал применялся при лечении детей с разными типами приступов в средней терапевтической дозе 3 мг/кг в сутки, и в течение 6 мес полная клиническая ремиссия была достигнута в 68% случаев. В наблюдении C. Valvi и соавт. [54] хороший контроль над приступами был достигнут у 84,8% детей, лечившихся фенобарбиталом. В исследовании K. Nimaga и соавт. [44] фенобарбитал применялся в лечении детей в дозах 50 мг/сут и у взрослых в дозе 200 мг/сут. Через 1 год от начала лечения 80,2% пациентов не имели приступов в течение 5 мес. И 15,7% пациентов имели значительное уменьшение частоты приступов. В работе S. Ismael [31] фенобарбитал применялся при лечении детей в возрасте от 5 мес до 12 лет. Хороший результат лечения отмечен у 62,4% детей, уменьшение приступов на 50% зарегистрировано у 7,69% детей. В исследовании N. Thilothammal и соавт. [52] проводилось сравнение эффективности и переносимости фенобарбитала, дифенина и препаратов вальпроевой кислоты. Было показано, что эффективность лечения была сравнительно одинаковой во всех трех группах.
Нами не выявлено предпочтительности влияния фенобарбитала в отношении разных форм эпилепсии и разных типов эпилептических приступов (р>0,05). Не было достоверных различий его эффективности между симптоматическими фокальными формами и криптогенными (предположительно симптоматическими) фокальными формами эпилепсии (р>0,05). Установлено, что длительность заболевания до начала приема фенобарбитала также не влияет на эффективность терапии. У пациентов с большой длительностью заболевания эффективность лечения была сравнима с пациентами, болеющими относительно недавно (р>0,05). Но S. Ismael [31] установил большую эффективность фенобарбитала при генерализованных судорожных приступах (положительный эффект отмечен у 72,6% пациентов); менее эффективен он был при фокальных приступах — 43,75% и при фокальных приступах со вторичной генерализацией — у 47,05% пациентов.
В группе пациентов, получавших терапию топираматом, полное прекращение приступов отмечено у 26% пациентов и уменьшение частоты приступов на 50% и более зарегистрировано у 61% пациентов. Мы сравнили наши результаты с данными других авторов. В исследовании К.Ю. Мухина и соавт. [8] полное купирование приступов отмечено в 19,5 и 16,5% (36% вместе соответственно) у пациентов с симптоматическими фокальными формами эпилепсии. По данным H. Bootsma и соавт. [20], этот показатель составляет до 20% пациентов. И в работе Y. Cho и соавт. [23] клиническая ремиссия отмечена в 30,4% случаев. Сравнительно низкая эффективность отмечена в исследовании K. Krakow и соавт. [34] — только 10% пациентов старше 12 лет освободились от приступов полностью. S. Grosso и соавт. [27] также отмечают прекращение приступов у 13% пациентов из 59 пролеченных детей в возрасте до 2 лет. В работе S. Grosso и соавт. [28] изучали эффективность топирамата у детей с рефрактерными формами эпилепсии. Приступы купировались только у 4% детей. Напротив, высокий терапевтический эффект отмечен в работе отечественных авторов. В наблюдении К.Ю. Мухина и соавт. [7] высокая клиническая эффективность достигнута у 46,5% пациентов. А.Б. Гехт и соавт. [4] отметили медикаментозную ремиссию продолжительностью более 1 года у 47,8% пациентов. К.В. Воронкова и соавт. [3] зарегистрировали полную клиническую ремиссию у 48% пациентов. В исследовании С.Р. Болдыревой [2] полный контроль над приступами получен у 53% пациентов.
Положительный эффект в целом в нашем исследовании получен у 87% пациентов. В работе К.В. Воронковой и соавт. [3] этот показатель составил 92%. В работе K. Krakow и соавт. [34] хороший результат наблюдался у 82%. В наблюдениях других авторов положительный эффект в лечении был примерно одинаковым — 58,5-73,2%. Учащение приступов зарегистрировано у 3% пациентов [2] и в 6% случаев [8], что сопоставимо с результатами нашего исследования — 3%.
Более высокий результат топирамат показал в лечении пациентов с криптогенными фокальными формами эпилепсии. Однако в работе S. Al Ajlouni и соавт. [15] не выявлено различия в эффективности терапии симптоматических и криптогенных форм эпилепсии. Мы отметили положительный результат в лечении мультифокальных форм эпилепсии — 86% пациентов имели полное прекращение приступов или уменьшение их частоты на 50% и более. В группе пациентов с фокальной лобной формой эпилепсии у 6 (75%) выявлено урежение приступов на 50% и более. Только в 1 (12,5%) случае приступы прекратились полностью. В исследовании К.Ю. Мухина и соавт.[8] положительный эффект при приеме топирамата у пациентов с симптоматической лобной эпилепсией наблюдался в 63% случаев. А. Verrotti и соавт. [57] на основании наблюдения представительной группы пациентов также отмечают эффективность топирамата в лечении лобной эпилепсии в режиме монотерапии.
Большую эффективность топирамат показал у пациентов с частыми серийными тоническими аксиальными спазмами, возникающими во время ночного сна, с фокальными гипермоторными приступами, а также при вторично-генерализованных судорожных приступах (р>0,05). Идентичную эффективность отметили в своем наблюдении К.Ю. Мухин и соавт. [8]: препарат был высокоэффективен в отношении фокальных моторных, тонических и вторично-генерализованных судорожных приступов. В ряде случаев топамакс отчетливо снижал частоту атипичных абсансов. Однако в монотерапии отмечалась его недостаточная эффективность при миоклонических и аутомоторных приступах. Доказано, эффективность терапии была выше у пациентов, имевших небольшой стаж заболевания до включения в терапию топамаксом (р=0,006).
В нашем исследовании лечились топираматом в комбинации с другими ПЭП 61% пациентов. Наиболее рациональной и эффективной в нашем наблюдении оказалась комбинированная терапия топираматом и препаратами вальпроевой кислоты. В литературе также приводятся данные об эффективности топирамата в комбинированной терапии с разными ПЭП. В работе A. Schreiner и соавт. [47] применялась комбинация топирамата с препаратами вальпроевой кислоты. В конце исследования 70% пациентов были переведены на монотерапию топамаксом в дозе 150 мг/сут. У 51% пациентов приступы прекратились полностью, в целом положительный эффект отмечен у 75% пациентов. В сравнении в работе A. Kowalik и соавт. [33] топирамат успешно применялся в комбинированной терапии с карбамазепином и окскарбазепином. По окончании исследования 73% пациентов были переведены на альтернативную монотерапию топираматом в средней дозе 100 мг/сут. Положительный эффект отмечен у 91% пациентов, из них 62% полностью освободились от приступов.
В группе наших пациентов, получавших ламотриджин, стойкая клиническая ремиссия была достигнута в 26% случаев и урежение частоты приступов на 50% и более констатировано у 45% детей. В 6% случаев наблюдалось учащение приступов. В целом положительный эффект достигнут у 71% пациентов. Более высокая эффективность была в группе пациентов, имевших более поздний дебют заболевания (р=0,037). С другой стороны, дети, имевшие высокую частоту приступов (р=0,031) и получавшие предшествующую терапию несколькими противоэпилептическими препаратами (р=0,008), имели меньший эффект в лечении.
Сходные результаты были получены в работе R. Jain и соавт. [32]: у 20 детей (средний возраст 90 мес) ламотриджин применялся в комбинированной терапии с препаратами вальпроевой кислоты в средних терапевтических дозах 3,86 мг/кг. Значительный положительный результат отмечен у 72% пациентов, из них 27,7% пациентов имели полное прекращение приступов и 44,4% пациентов имели значительное уменьшение частоты приступов на 50% и более. В исследование S. Zubcevic и соавт. [61] были включены 61 ребенок, которые начали получать комбинированную терапию ламотриджином в среднем через 16 мес от начала заболевания. В 67,2% случаев приступы были фокальными и вторично-генерализованными судорожными. В результате уменьшение частоты приступов на 75-100% отмечено у 37,7% пациентов, на 50-75% — у 21,3% пациентов. В целом, суммируя эти данные, можно указать на положительный эффект в лечении у 59% детей. В исследовании Ch. Song и соавт. [49] при применении ламотриджина в дополнительной терапии у 114 пациентов купирование приступов на 50% и более отмечено у 57% пациентов, впоследствии 22,8% пациентов были переведены на монотерапию этим препаратом. В публикации М.Б. Миронова и соавт. [6] особое внимание уделялось применению ламотриджина в дополнительной терапии к препаратам вальпроевой кислоты у 38 пациенток с разными формами эпилепсии в возрасте от 3 до 25 лет (средний возраст 14,3 года). Положительный эффект при добавлении ламотриджина отмечен в 73,8% случаев: полная терапевтическая ремиссия в 36,9% случаев, снижение частоты приступов на 50% и более в 26,9% случаев. Высокую эффективность на фоне приема ламотриджина (100% купирование приступов у 54% пациентов) зарегистрировали H. Arif и соавт. [16]. Особое внимание гендерным особенностям применения ламотриджина было уделено Г.Н. Авакяном и соавт. [1], подчеркивая положительное влияние препарата на уменьшение частоты приступов.
В нашей работе ламотриджин показал хороший результат в лечении лобной эпилепсии: у 58% пациентов отмечено значительное уменьшение частоты приступов и в 17% случаев приступы были купированы полностью. Бо`льшую эффективность ламотриджин показал у больных с фокальными моторными гемиклоническими приступами, а также при вторично-генерализованных судорожных приступах (р>0,05). Н.Ю. Перунова и соавт. [9] отметили эффективность терапии у пациентов с парциальными приступами в 8% случаев и с вторично-генерализованными в 12% случаев. В своем наблюдении E. Trevathan и соавт. [53] констатируют эффективность ламотриджина у детей с парциальными приступами, при абсансах, при разных типах приступов при синдроме Леннокса-Гасто. В исследовании S. Zubcevic и соавт. [61] ламотриджин был менее эффективен при парциальных приступах. По мнению R. Jain и соавт. [32], ламотриджин показал хороший эффект при всех типах приступов, кроме миоклонических.
В нашем исследовании в 90% случаев ламотриджин применялся в комбинированной терапии с другими ПЭП с высокой эффективностью (р=0,01). В 52% случаев назначалась комбинация ламотриджина с препаратами вальпроевой кислоты (депакином). Аналогичное наблюдение отмечено и в работе Н.Ю. Перуновой и соавт. [9]: на фоне комбинированной терапии ламотриджином и вальпроатами снижение частоты приступов на 50% и более отмечено у 48,5% пациентов.
Таким образом, ПЭП новой генерации, обладая комплексным механизмом воздействия на процессы эпилептогенеза, показали более высокую эффективность в лечении фокальных форм эпилепсии у детей. Если принимать во внимание, что основной целью фармакотерапии эпилепсии является полное прекращение приступов без появления неврологических, когнитивных и соматических побочных явлений и обеспечение педагогической, профессиональной и социальной адаптации пациентов, то создание новых ПЭП широкого спектра действия позволяет расширить терапевтические возможности в лечении эпилепсии, в особенности фокальных и фармакорезистентных форм.
Особенности клинических проявлений эпилепсии в зависимости от локализации патологического очага
Височная форма фокальной эпилепсия является самой часто встречаемой. Эпилептогенный очаг расположен в височной доле головного мозга. Височная фокальная эпилепсия характеризуется припадками с потерей сознания, наличием автоматизмов и ауры. Приступ длится в среднем 30-60 секунд. Оральные автоматизмы присущи детям, а автоматизмы по типу жестов – взрослым. Пароксизмы височной фокальной эпилепсии имеют вторничную генерализацию. Постприступная афазия фиксируется при поражении доминантного полушария височной доли головного мозга.
Эпилептический очаг лобной фокальной эпилепсии расположен в лобной доле головного мозга. Данный очаг провоцирует кратковременные пароксизмы, которые могут проходить сериями. Для лобной ФЭ не характерна аура. Симптомы лобной ФЭ: поворот глаз и головы в одну сторону, сложные автоматические жесты, эмоциональное возбуждение, крики, вздрагивания, агрессия. Если очаг патологии находится в предцентральной извилине, то появляются двигательные пароксизмы джексоновской эпилепсии. Эпилептические приступы лобной фокальной эпилепсии возникают во время сна.
При расположении очага в затылочной доле головного мозга происходят эпилептические приступы, сопровождающиеся нарушением зрения. Например, сужение зрительных полей, зрительные галлюцинации, иктальное моргание, транзиторный амавроз и др. Длительность зрительных галлюцинаций – 13 минут.
Расположение очага эпилептической активности в теменной доле является редкостью. Теменная доля поражается в случае наличия опухоля или корковой дисплазии. Теменная фокальная эпилепсия характеризуется простыми соматосенсорными пароксизмами: кратковременная афазия или паралич Тодда. Если зона эпилептической активности локализуется в постцентральной извилине, то могут происходить джексоновские припадки.
Бессудорожные проявления
Это наиболее трудно диагностируемые припадки. Могут встречаться у детей и взрослых. Симптомы могут проявляться в виде психической патологии – помрачение рассудка. Эта форма очень плохо поддается терапии лекарственными препаратами.
Симптомы:
- кратковременные приступы с «отключением» сознания;
- изменение мимики;
- яркие проявления патологической радости или негативных эмоций: ярость, вплоть до самоубийства;
- бред, визуальные галлюцинации, спутанность и бессмысленность речи.
Эта форма заболевания самая опасная, т.к. часто она не диагностирована и не проводится терапия.
Диагностика фокальной эпилепсии
Если парциальный пароксизм возник впервые, то пациенту необходимо детальное обследование, так как данный симптом может быть проявлением серьезной церебральной патологии. Во время консультации врач-невролог просит полностью описать длительность, характер, последовательность развития эпилептического приступа. Выявленные отклонения помогают установить расположение очага патологии.
Эпилептическая активность диагностируется с помощью ЭЭГ. Эпи-активность фокальной эпилепсии можно зафиксировать на ЭЭГ даже в межприступный период. Если ЭЭГ без приступа малоинформативна, то следует провести электроэнцефалоскопию с провокационными пробами и/или во время приступа. Субдуральная кортикография – это электроэнцефалоскопия с установлением электродов под твердой мозговой оболочкой. Помогает точно определить локализацию патологического очага.
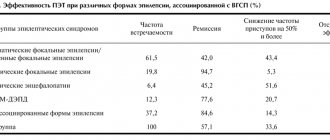
Из инструментальных методов исследований наиболее эффективным для выяснения морфологических основ ФЭ является МРТ. Толщина срезов должна составлять около 1-2 мм, чтобы как можно точнее обнаружить мельчайшие дефекты вещества головного мозга. В случае симптоматической эпилепсии МРТ даёт возможность выявить первопричину: очаговые поражения, атрофии, дисплазии. В ряде случаев обнаружить подобные изменения не удается и тогда диагноз — идиопатическая или криптогенная ФЭ. В качестве дополнительного, но необязательного исследования может быть назначена ПЭТ головного мозга. ПЭТ зафиксирует эпилептогенный участок как зону повышенной метаболической активности. ОФЭКТ также применяется в качестве дополнительного метода диагностики, в ходе которого специалист способен отслеживать динамику перфузии церебрального вещества: в течение припадка будет наблюдаться картина гиперперфузии эпилептогенного очага, а в отрезок времени между пароксизмами — гипоперфузия.
Что такое псевдоэпилептические приступы?
Псевдоэпилептические приступы (конверсионные, психогенные, неэпилептические или истерические приступы) иногда трудно отличить от эпилепсии по внешним признакам; однако, у некоторых больных возможно сочетание эпилептических и неэпилептических приступов. Частота встречаемости этих расстройств достаточно высока, они составляют примерно 20% всех случаев, считавшихся резистентными формами эпилепсии. Приступы этого типа чаще встречаются у женщин. В семейном анамнезе больных нередко есть указания на психические нарушения. Эти приступы правильнее рассматривать, как проявление психических заболеваний; они не сопровождаются эпилептической активностью на ЭЭГ и не купируются антиконвульсантами (в отличие от эпилептических приступов). Псевдоэпилептические приступы могут иметь разные внешние проявления. Псевдоэпилептические приступы могут принимать статусное течение, в таком случае есть риск введения в организм больших доз противосудорожных препаратов и даже применения ИВЛ.
Как правило, эти приступы не возникают, когда больной находится наедине с собой, для их возникновения нужны свидетели; приступы обычно провоцируются конфликтной ситуацией. Как правило, во время таких приступов больной не получает травм (даже в случае падения), не прикусывает язык, недержание мочи отсутствует. Начало псевдоэпилептических приступов чаще постепенное, цианоза (синюшного оттенка кожи) не наблюдается. Судороги в конечностях менее ритмичные, чем при эпилептических приступах, могут иметь характер несинхронных, хаотичных движений. Пациент активно сопротивляется попыткам открыть глаза во время приступа. Послеприступная сонливость или спутанность не характерны.
Основной метод дифференциальной диагностики — видео-ЭЭГ мониторинг.
В отличие от симуляции, больные не могут специально вызывать приступы и их контролировать. Псевдоэпилептические приступы — это тоже болезнь, требующая лечения, однако, лечение проводится не антиконвультсантами, а психотропными препаратами.
Терапия фокальной эпилепсии
Лечение фокальной эпилепсии назначается врачом-неврологом и эпилептологом, и включает в себя прием антиконвульсантов. К антиконвульсантам относится: карбамазепин, топирамат, фенобарбитал, леветирацетам и др. Для лечения теменной и затылочной эпилепсии фармакотерапии будет достаточно. При височной фокальной эпилепсиии спустя 1-2 года терапии может возникнуть резистентность к проводимому противосудорожному лечению. Если эффект от терапии отсутствует, то врач назначает операцию.
Операция проводится нейрохирургами, и направлена на полное удаление очагового образования (мальформации, опухоли, кисты) или частичное удаление эпи-участка. Фокальная резекция применяется в том случае, если очаг эпилептической активности хорошо локализуем. Если к эпилептогенной зоне прилегают клетки, которые тоже являются источником эпилептической активности, то назначается расширенная резекция.
Прогноз фокальной эпилепсии
Прогноз фокальной эпилепсии зависит от ее типа.
Так как идиопатическая эпилепсия доброкачественна, протекает без когнитивных нарушений, то прекращение пароксизмов происходит самопроизвольно в подростковом возрасте.
Церебральная патология обуславливает прогноз симптоматической эпилепсии. К сожалению, он неблагоприятен при тяжелых пороках развития мозга и опухолях. Данная эпилепсия проявляется задержкой психического развития, которая отмечается при раннем начале эпилепсии.
У 60-70% пациентов после хирургического лечения отмечается снижение или отсутствие эпи-пароксизмов. Полное исчезновение эпилепсии через продолжительное время фиксируется у 30%.