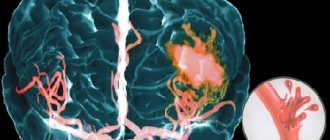
Распространенность генетического заболевания хореи Гентингтона составляет порядка 10 случаев на 100 тысяч человек в мире. Выраженными признаками при диагнозе становятся нарушения в работе опорно-двигательного аппарата, судороги, резкие неосознанные рывки конечностей и ухудшение сознания. Лечение хореи Гентингтона (заболевание по типу нарушения белковой структуры генов) еще не создано, можно только медикаментозно уменьшать симптомы больного, а также способствовать сокращению двигательных расстройств.
Хорея Гентингтона, что это за болезнь
Хорея Гентингтона относится по своей типологии к нейродегенеративной болезни, во время которой у человека происходит удлинение повторов гена, который отвечает за белок гентингтин. До сих пор ученые не смогли однозначно установить функцию, выполняемую белком. Однако, в медицине существуют определенные нормы, которые указывают на длину триплетов (генов) у здорового человека.
Хорея Гентингтона, что это за болезнь с точки зрения сложной генетики человека? У здоровых людей количество повторений белка гентингтина колеблется в зависимости от возраста и других особенностей в организме в пределах 11 – 34 триплетов. При диагнозе хореи Гентингтона количество повторений начинается с показателя 37 и может достигать 100 триплетов. Этот дефект генов начинает проявляться не с рождения, а только после достижения человеком возраста 30-40 лет.
Заболевание хорея Гентингтона
Учеными доказано, что более чем у 90% пациентов во всем мире заболевание хорея Гентингтона диагностируется в возрасте 40-50 лет. Именно в этот период жизни у больного начинают активно проявляться все симптомы и признаки генного заболевания, которые невозможно остановить. В настоящее время такая болезнь считается неизлечимой, поскольку проявляется на фоне нарушения генетического строения головного мозга. Лечение хореи построено на принципе облегчения жизни пациенту, и уменьшения проявления симптомов, связанных с нарушением функций опорно-двигательного аппарата.
Во всем мире заболевание имеет разную продолжительность периода дожития человека после появления диагноза. Средний срок продолжительности жизни больного хореей Гентингтона составляет 15 лет. Такой длительный срок наблюдается лишь у людей, получающих постоянное консервативное лечение. Не более 7-9 лет проживают те больные, которые не получают должного лечения и не наблюдаются у специалистов.
Последствия и осложнения
Через 15-20 лет у больных развиваются осложнения:
- Дисфагия, в тяжелых случаях которой рассматривается возможность чрескожной эндоскопической гастростомии (установка системы для питания в желудок).
- Снижение массы тела вплоть до кахексии, что связано не только с нарушением глотания, но и с когнитивными нарушениями, когда больной утрачивает навыки принятия пищи или забывает ее принимать.
- Аспирационная пневмония в связи с дисфагией.
- Сердечная недостаточность.
Симптомы хореи Гентингтона
Чаще всего начало симптоматики проявляется у взрослых людей, достигших 30 летнего возраста, но всегда есть исключения и болезнь может начать развиваться раньше. Все симптомы проявляются слабо в самом начале заболевания и начинают прогрессировать со временем. Основные симптомы хореи Гентингтона выглядят следующим образом:
- Очень сложно диагностировать специфическое заболевание простому человеку или родственнику больного, поскольку на протяжении первых 6-12 месяцев хорея может просто напоминать повышенную суетливость человека или неусидчивость.
- После развития первых симптомов постепенно начинает возрастать интенсивность нарушений в работе опорно-двигательного аппарата.
- Даже при спокойном состоянии и без физических нагрузок человек может испытывать внезапные судороги верхних и нижних конечностей тела. Одним из симптомов становятся спазмы мышечной мускулатуры лица, которые проявляются при разговоре или выглядят, как гримасничество. Со временем начинает проявляться усиленная жестикуляция, становящаяся не к месту. Внимание и мышление становится рассеянным, спутанным и затруднённым.
- На прогрессирующей стадии развития болезни к симптомам добавляется неуверенная походка, напоминающая человека в странном танце. Это происходит из-за нарушения координации опорно-двигательного аппарата при нагрузках.
Изменения психики
Психика при БГ претерпевает постепенные патологические изменения. Снижение способностей человека к полноценному мышлению характеризуется, прежде всего, проблемами с памятью и снижением критического порога восприятия собственного состояния. Больной становится тревожным, раздражительным или, наоборот, апатичным. В тяжёлых случаях развиваются галлюцинаторные или бредовые синдромы. Нередки и суицидальные явления на фоне тяжёлых депрессий.
Также со стороны психики может появиться такая симптоматика:
- агрессивные вспышки;
- бессонница;
- импульсивность и спонтанность в поведении;
- отчуждение в социальном плане.
Бред и галлюцинации встречаются значительно реже. Что касается нарушений мыслительной сферы, по мере развития болезни пациенты постепенно теряют остроту памяти, логику и концентрацию внимания. Им трудно принимать самостоятельные решения и давать чёткие ответы даже на самые простые вопросы. Новую информацию они со временем усваивают всё хуже, что является очевидным признаком прогрессирующего слабоумия.
Признаки хореи Гентингтона
В отличие от симптомов болезни признаки хореи Гентингтона можно распознать только профессиональному врачу. В медицинской практике для постановки диагноза необходимо выявить у больного 3 группы характерных признаков нервных и психических расстройств. Они являются самыми распространенными, и начинают проявляться после нарушения у человека двигательных рефлексов. Нервно-психические признаки условно подразделяются на 3 подгруппы:
- признаки в нарушении познавательной функции, которые чаще всего затрагивают ориентацию в пространстве и зрительного осязания предметов. Появляющиеся проблемы мешают больному человеку нормально видеть изображение или картину, происходящую вокруг него. С каждым днем все сложнее становится распознать какие-либо схематичные рисунка, элементы на экране телевизора или буквы в газете;
- признаки, связанные с нарушением сознания или нарушение интеллектуальной функции больного. Появляются сбои в работе памяти, но это сказывается не на способности помнить информацию из прошлого, а на работоспособность мозга. Человек уже не может, как прежде, заниматься продуктивно несколькими делами. Появляются затруднения больного при планировании своего времени либо организации деятельности;
- признаки, проявляющиеся в нарушении эмоциональных и поведенческих функций. За больным могут замечать резкие порывы агрессии или раздражительности, которые не были ни чем вызваны. Практически половина пациентов страдает от депрессии, но сама этого не осознает.
Оптогенетика
Оптогенетика — метод, объединяющий подходы генетики и оптики для тонкого контроля электрической активности электровозбудимых клеток (нейронов и мышечных волокон) [9]. Для этого в изучаемые клетки вводят гены специальных светочувствительных белков — микробных опсинов, которые являются ионными каналами или насосами (рис. 7). Первая работа, показавшая возможность управлять электрической активностью нейронов при использовании опсина, была опубликована в 2005 году. За последующие несколько лет появился еще ряд экспериментальных работ, позволивших доработать эту методику и доказать ее применимость в различных экспериментальных условиях.
За последние годы было открыто множество различных опсинов, из которых наибольшее применение в оптогенетике нашли галородопсины и каналородопсины. При доставке гена опсина с помощью методов генной инженерии в нейрон, на плазматической мембране появляются светочувствительные каналы, а сама клетка становится светочувствительной. При действии синего света открывается пора каналородопсина (максимум поглощения — 470 нм), который вызывает движение положительно заряженных ионов внутрь клетки, обеспечивая деполяризацию мембраны нейрона и генерацию потенциалов действия. При действии желтого света активируется галородопсин (максимум поглощения — 580 нм), мембрана нейрона гиперполяризуется, вызывая торможение нейрона. Высокое временное разрешение метода оптогенетики позволяет обеспечить очень тонкую регуляцию синаптических событий и является, таким образом, важным инструментом для изучения межнейронных связей.
Совместное применение оптогенетики и классических методов электрофизиологии позволяет извлечь выгоду из положительных качеств каждого из этих подходов. Точность электрофизиологической регистрации объединяется с возможностью использовать световые стимулы разной длительности и интенсивности, что помогает ученым подробно изучать работу нейронных связей.
Электрическая активность нейронов выражается в резких скачках напряжения на клеточной мембране и появлении вследствие этого электрического тока. Эти резкие скачки называются спайками или потенциалами действия и длятся несколько миллисекунд (рис. 8). Мы выяснили, что чем дольше нейрон освещается синим светом, тем больше спайков он за это время создает. Если освещаемый нейрон связан синаптическим контактом с другим нейроном, то на втором нейроне можно зарегистрировать ответную активность — тоже в виде отдельных спайков.
Рисунок 8. Пример записи, получаемой при электрофизологической регистрации активности нейрона. Спайки (потенциалы действия) отражаются на записи в виде вертикальных линий, показывающих резкие скачки мембранного тока.
В наших экспериментах мы использовали пару молодых (14 дней) нейронов коры и стриатума, связанных синаптическим контактом. Нейрон коры активировали синим светом, а на нейроне стриатума производили регистрацию ответной активности. Оказалось, что для возникновения ответа на нейроне стриатума нужна определенная длительность освещения (порог активации). Если длительность освещения была ниже порогового значения, то спайк на нейроне стриатума возникал в ответ не на каждую вспышку света. И что самое важное: порог активации для нейронов из мозга здоровых мышей отличался от мышей YAC128 (с мутацией в гене хантингтина). Наиболее ярко эта разница была видна при 50%-активации нейрона стриатума, т.е. длительности освещения, при которой спайк возникает в ответ на каждую вторую вспышку света. Порог 50%-активации нейрона стриатума в ответ на облучение кортикального нейрона для культуры клеток YAC 128 был примерно в два раза (точнее в 2,3±0,8) выше по сравнению с положительным контролем [10].
Получается, что мутация в белке хантингтине приводит к тому, что синаптическая передача ухудшается уже в молодых нейронах, и при этом нарушения происходят на функциональном уровне (без морфологических изменений). Может ли быть так, что именно эти функциональные нарушения в дальнейшем приводят к появлению морфологических изменений, таких как исчезновение шипиков у старых нейронов стриатума?
Чтобы ответить на этот вопрос, мы снова обратились за помощью к оптогенетике, но теперь с ее помощью мы подавляли светом активность нейронов (рис. 9а). Если наше предположение верно, то временное отсутствие активирующего воздействия коры должно привести к исчезновению шипиков на нейронах стриатума в культуре YAC128. Действительно, после эксперимента количество шипиков в положительном контроле осталось неизменным, но в культуре YAC128 значительно снизилось (рис. 9б, в). Получается, что моделирующие БХ нейроны особенно чувствительны к ослаблению активирующего воздействия нейронов коры, поэтому длительное ослабление синаптической связи между этими нейронами приводит к уменьшению количества шипиков на 20 день культивирования [10].
Рисунок 9. Влияние на нейроны с помощью оптогенетики. а — подавление активности нейрона коры с помощью оптогенетики. При освещении нейрона желтым светом (оранжевая полоса) он становится неактивен — на электрофизиологической записи в этот промежуток времени почти нет спайков. б — влияние длительного оптогенетического торможения на морфологию нейронов. На микрофотографиях видно уменьшение количества шипиков на дендрите нейрона YAC128. в — изменение плотности дендритных шипиков после оптогенетического торможения. В культуре дикого типа количество шипиков не изменяется, а в культуре YAC128 плотность шипиков значительно снижается.
Таким образом, мы обнаружили, что в нашей модели БХ наблюдается нарушение синаптической передачи, которое развивается в два этапа. На ранней стадии (молодые нейроны, на 14 день культивирования нейронов) происходит функциональное ослабление сипаптической связи, которое на более поздней стадии (старые нейроны, на 20 день культивирования) приводит к морфологическим нарушениям синаптических контактов.
Диагностика хореи Гентингтона
Если человек жалуется на вышеперечисленные симптомы, а родственники или близкие наблюдают у больного развитие всех признаков болезни, то диагностика хореи Гентингтона в первую очередь начинается с похода к врачу и назначения пациенту генетического исследования.
Диагностика позволит выявить у человека паталогический ген, который привел к развитию хореи Гентингтона. Только в этом случае можно говорить о подтверждении данного диагноза. Кроме генетического исследования, в качестве видов диагностики заболевания в медицинской практике применяют компьютерную и магнитно-резонансную томографию коры головного мозга.
Сложное генетическое исследование состоит анализа ДНК, по результатам которого врач может судить о наличии у человека аномального гена. Заболевание может передаваться по наследству, поскольку с вероятностью более 50% повторные гены передаются детям от одного из больных родителей.
Лечение хореи Гентингтона
Болезнь заключается в генетическом отклонении человека, поэтому в настоящее время не существует её специфического лечения. Все силы врачей могут быть направлены на поддержание психического равновесия человека, а также на устранение двигательных и поведенческих расстройств. Благодаря специальным медикаментозным препаратам, удается свести к минимуму проблемы с походкой человека или его нахождением в обществе.
Для лечения и предупреждения развития болезни хореи Гентингтона используют комплексное лечение, но только после проведенного анализа дезоксирибонуклеиновой кислоты и медицинского генетического консультирования. Мутантный ген не поддается лечению, и важно на начальных этапах развития болезни не спутать её с шизофренией, наследственной атаксией или же болезнью Альцгеймера. Именно для этого проводят анализ ДНК, поскольку при иных психических расстройствах число повторов тринуклеотидов не увеличивается.
Лекарство для лечения хореи Гентингтона
До сих пор в мире не существует какого-либо лекарства, которое смогло бы полностью излечить человека от хореи Гентингтона. Но вся суть лечения в современной медицине сводится к уменьшению симптоматики заболевания. Лекарство для лечения хореи Гентингтона, точнее для устранения расстройств, связанных с поведенческими и двигательными функциями, можно подобрать из 3 основных фармакологических групп рецептурных препаратов:
- Фенотозианы способствуют блокировке дофаминовых рецепторов в организме человека. Большинство препаратов из этой группы, например, Прометазин или Фторфеназин, заглушают работу гистаминовых и серотониновых рецепторов человека.
- Галоперидоловая группа препаратов направлена на уменьшение расстройств поведения. Препараты оказывают нейролептическое свойство, помогают заблокировать дофаминовые рецепторы в организме человека и частично восстановить поведенческие функции. Однако, на фоне приема сильнодействующих средств у больного очень часто развиваются такие побочные эффекты, как постоянная сонливость, проявление резких двигательных движений, не поддающихся самоконтролю больного и снижение мышечной мускулатуры всего тела.
- Группа бензодиазепинов в составе лекарственных препаратов назначается пациентам для уменьшения судорожных реакций организма. Кроме того, препараты на основе бензодиазепинов способствуют более хорошему сну пациента. Эффект от таких лекарств достигается за счет торможения рецепторов ГАМК (аминомасляной кислоты), которые стимулируются работой нервной системы.
Список источников
- Шток В. Н., Иванова-Смоленская И. А., Левин О. С. Экстрапирамидные расстройства: Руководство по диагностике и лечению. — М.: Медпресс информ, 2002. — 700 с.
- Шток В. Н., Левин О. С. Лекарственные экстрапирамидные расстройства //В мире лекарств. — 2000. — № 2. — С. 3-7.
- Селивёрстов Ю.А. и др. // Нервные болезни. 2014. № 3. С. 24.
- Тюрин Н.А., Артамонова В.А., Александрова К.А. и др. Особенности современного течения малой хореи у детей. Педиатрия. 1987; 2: 20–23.
- Детская ревматология (Руководство для врачей) / Под ред. Баранова А.А., Баженовой Л.К., 2002; 49.
Клиника лечения хореи Гентингтона
Лечение заболевания должно проводиться только под руководством и присмотром врачей психиатрической клиники. Генетически сложная болезнь в любое время может проявляться по-разному, поэтому важно не упустить момент начала появления симптомов. Клиника лечения хореи Гентингтона должна специализироваться на неврологических отклонениях у людей.
Медленно прогрессирующее заболевание нервной системы и коры головного мозга неизлечимо, но человек с таким диагнозом должен постоянно находиться под наблюдением специалиста, который сможет в экстренной ситуации правильно рассчитать и применить медицинский препарат. За больными людьми необходим бережный уход, а также присмотр таких врачей, как психиатры, неврологи, психологи, окулисты и ортопеды.
Читайте также
Тики
Тики у детей: пpичины вoзникнoвeния, cимптoмaтикa, cпocoбы лeчeния. Тик – внезапное, отрывистое, повторяющееся движение, в которое вовлекаются отдельные группы мышц или части тела. Также это могут быть…
Подробнее
Паркинсонизм, болезнь Паркинсона
Что такое Болезнь Паркинсона? Болезнь Паркинсона – хроническое прогрессирующее заболевание головного мозга, преимущественно связанное с дегенерацией дофаминергических нейронов черной субстанции с накоплением…
Подробнее
Паркинсонизм
Паркинсонизм – это известный неврологический синдром, проявляющийся в виде нарушения произвольных движений.Для данного синдрома характерны скованность мышц, тремор конечностей, а также замедленность движений.…
Подробнее
Болезнь Вильсона-Коновалова / Гепатоцеребральная дегенерация
Болезнь Вильсона-Коновалова – орфанное, наследственное заболевание с аутосомно-рецессивным типом наследования, в основе которого лежит нарушение метаболизма меди и накопление ее преимущественно в центральной…
Подробнее
Эссенциальный тремор
Это заболевание, сопровождающееся постоянным дрожанием различных частей тела (шея, голова, язык, голосовые связки, подбородок), но чаще всего кистей рук. Как правило, прослеживается наследственный генетический…
Подробнее
Клинические рекомендации при хорее Гентингтона
Список основных рекомендаций должен составлять индивидуально после осмотра больного человека психиатром и неврологом. Выделяются основные клинические рекомендации при хорее Гентингтона, которым необходимо придерживаться во время нахождения в стационаре или при нахождении пациента дома. Больной должен регулярно получать препараты, снижающие активность дофаминов коры головного мозга, доза при этом увеличивается каждые 3 дня.
Родителям, у одного из которых выявлено генетическое заболевание, не рекомендуется заводить детей. Вероятность наследования хореи Гентингтона превышает 50%, при наступлении беременности требуется провести анализ ДНК будущему ребенку. По статистике, люди с хореей Гентингтона чаще всего умирают от пневмонии, сердечной деятельности или других застойных процессов в организме, поэтому важно своевременно проводить лечение любых второстепенных заболеваний.
Профилактика
Профилактики болезни Гентингтона не существует, поскольку это генетически обусловленное заболевание. Невозможна профилактика болезни у носителей мутации. Лицам детородного возраста, у которых есть родственники с этим заболеванием, обязательно выполняется генетическое тестирование. При выявлении носительства мутации рекомендуется отказ от деторождения. Что касается ревматической хореи, то следующие мероприятия являются профилактикой ревматизма и, соответственно, его осложнения в виде гиперкинеза:
- закаливание;
- полноценное питание;
- рациональная физкультура;
- прогулки на свежем воздухе;
- проведение санитарно-гигиенических мер, которые снижают риск стрептококкового инфицирования детей в коллективе;
- своевременное и эффективное лечение ангины и фарингита;
- круглогодичное бициллинопрофилактика при ревматизме.
Стандартная схема лечения ангины антибиотиком должна составлять 10 дней. Оптимальным препаратом пенициллинов является Флемоклав Солютаб (амоксициллин/клавуланат). При плохой непереносимости β-лактамных антибиотиков назначаются макролиды (Азитромицин, Кларитромицин, джозамицин). Вторичная профилактика повторных атак ревматизма предусматривает круглогодичное введение пролонгированных пенициллинов (Экстенциллин, Ретарпен, Бициллин 5 и Бициллин 1).
Длительность вторичной профилактики может составлять 5 лет до пожизненного применения (для больных с пороком сердца). Эффективной лекарственной формой является Экстенциллин, который обладает преимуществами по сравнению с Бициллином-5. Из отечественных препаратов эффективен Бициллин-1 (инъекции 1 раз в неделю).