Наверняка многие, услышав слово «эпилепсия», скажут, что это психическое заболевание и лечить его нужно у психиатра. Это в корне неверно. Обращаться с подозрением на эпилепсию нужно к врачу-неврологу, поскольку эпилептология, наука, изучающая эпилепсию, – это раздел неврологии.
Ребенка с эпилепсией может наблюдать психиатр – если у него имеются нарушения в психической сфере, обусловленные самой эпилепсией или сопутствующими патологиями. Но саму эпилепсию лечит невролог.
Какое обследование помогает выявить эпилепсию?
Эпилепсия – хроническое заболевание, при котором в мозге появляются очаги избыточного возбуждения. Оно может возникнуть в любом возрасте. По данным Всемирной организации здравоохранения, в мире около 50 000 000 человек страдают эпилепсией. Доля населения с активной формой эпилепсии (и соответственно, нуждающихся в лечении) на 2021 год составляет от 4 до 10 на 1000 человек.
Единственной методикой достоверного выявления эпилепсии является ЭЭГ – запись электрической активности мозга, позволяющая обнаружить эти очаги.
Дополнительные методы – МРТ, компьютерная томография, генетические исследования помогают провести дифференциальную диагностику, например, выявить участок кровоизлияния или опухоль, наличие наследственной патологии.
Обычный сеанс ЭЭГ длится 20-30 минут и достаточно часто не выявляет у ребенка или взрослого никаких признаков заболевания, даже если имелись подозрительные симптомы.
Поэтому при наличии подозрения на эпилепсию проводится видео ЭЭГ мониторинг сна и длительного периода бодрствования с функциональными пробами (синонимами являются — видео ЭЭГ мониторинг ночного сна, видео ЭЭГ мониторинг дневного сна, видео ЭЭГ мониторирование ночного сна, видео мониторирование ЭЭГ суточное и так далее), которые позволяют спровоцировать приступ. Родители часто тревожатся, услышав о том, что врач постарается вызвать приступ, однако, иногда только так можно поставить стопроцентно достоверный диагноз.
Родителям стоит знать о том, что большинство детей, на ЭЭГ которых обнаруживается эпилептиформная активность, не являются больными эпилепсией. Они находятся в группе риска, но часто за всю жизнь не переносят ни единого приступа и не нуждаются ни в каком лечении. Более того, судорожный эпизод хоть раз в жизни испытывали 10% людей, однако диагноз «эпилепсии» им не ставится, так как один из главных критериев постановки такого диагноза – регулярность приступов.
Проявлениями эпилепсии не являются:
- Лунатизм (снохождение). Сам по себе лунатизм не является проявлением эпилепсии. Если присутствуют какие-то еще симптомы, необходимо рассматривать их в комплексе.
- Головные боли. Головная боль – синдром, который может указывать на наличие самых разных заболеваний и рассматривать ее необходимо также в комплексе с другими симптомами.
- Гиперкинезы, тики. Гиперкинезы – насильственные стереотивные движения, у детей могут быть проявлением целой группы заболеваний и далеко не всегда являются показанием к проведению ЭЭГ.
- Ночное недержание мочи (энурез). Возникает как у детей с эпилепсией, так и у тех, кто ей не страдает.
Специфические расстройства развития речи (СРРР) по классификации МКБ-10 [1] составляют рубрики F80.1 — расстройство экспрессивной речи и F80.2 — расстройство рецептивной речи. Они включают нарушения, при которых речь страдает уже на ранних этапах развития ребенка и предшествовавшего периода ее нормального развития не прослеживается. Распространенность СРРР в детской популяции — 5-10% [2, 3]. В современных международных классификациях терминами «дисфазия» или «дисфазия развития» обозначается алалия — системное недоразвитие речи в результате поражения корковых речевых зон в доречевом периоде [3, 4]. В литературе используются оба термина — СРРР и «дисфазия развития», но дисфазия развития является более точной формулировкой диагноза, поскольку данный термин отражает как неврологический, так и эволюционно-возрастной аспекты расстройства [4]. Недостаточный уровень развития речевых центров коры больших полушарий головного мозга, лежащий в основе дисфазии, может быть врожденным или приобретенным на ранних этапах онтогенеза, в доречевом периоде. В основе дисфазии лежат нейробиологические факторы: раннее повреждение ЦНС, обусловленное патологией течения беременности и родов, а также генетические механизмы [5].
В клинической практике наиболее часто встречаются экспрессивный и смешанный экспрессивно-рецептивный варианты патологии, проявляющиеся значительным запаздыванием развития экспрессивной речи по сравнению с развитием понимания, при этом экспрессивная речь характеризуется значительными отклонениями. У детей затруднены организация речевых движений и их координация, тогда как понимание речи страдает менее значительно или не нарушено. Самостоятельная речь долго не развивается либо остается на уровне отдельных звуков и слов. Речь замедлена, обеднена, словарный запас ограничен обиходно-бытовой тематикой. В ней много оговорок (парафазий), перестановок, персевераций. Взрослея, дети понимают эти ошибки, пытаются их исправлять.
Речь при дисфазии развития не служит полноценным средством коммуникации, организации поведения и индивидуального развития. Интеллектуальная недостаточность и ограниченный запас знаний, наблюдающиеся у пациентов в разные возрастные периоды, носят, таким образом, вторичный характер. Это отличает пациентов с дисфазией от детей с общей задержкой психического развития или умственной отсталостью, для которых характерно равномерное неполное формирование всех высших психических функций и интеллектуальных способностей. В то же время, необходимо проводить разграничение между дисфазией и темповой задержкой развития речи, в том числе обусловленной дефицитом стимуляции речевого развития (недостаточным общением и воспитанием).
Большое значение в комплексном обследовании детей с дисфазией развития имеет электроэнцефалографическое обследование (ЭЭГ), которое позволяет оценить уровень морфологической и функциональной зрелости различных отделов ЦНС (кора мозга и подкорковые регуляторные структуры), на которые могут воздействовать патологические факторы. В ходе нейрофизиологических исследований у ряда пациентов с дисфазией развития были обнаружены [3, 6] изменения на ЭЭГ, в частности дизритмический тип, низкий индекс и дезорганизация α-ритма и даже его отсутствие, гиперсинхронный тип ЭЭГ, снижение реактивности ЦНС, а также очаговые изменения в лобных, лобно-височных, лобно-теменных, височно-теменных и затылочно-теменных областях. Но нередко явные нарушения, в том числе фокальные, на ЭЭГ отсутствуют. На основании данных клинического обследования и ЭЭГ было высказано предположение [3, 6], что у части детей имеется недостаточное функционирование височно-теменно-затылочных отделов доминантного полушария. Кроме того, в ходе обследования детей с дисфазией с разными уровнями общего недоразвития речи (ОНР) было установлено, что выраженность изменений на ЭЭГ не соответствовала уровню ОНР [3, 6].
В зарубежных исследованиях много внимания уделялось [7-11] выявлению у пациентов с дисфазией развития эпилептиформных изменений на ЭЭГ, в том числе так называемых доброкачественных эпилептиформных разрядов детства (ДЭРД). На эти исследования повлияла концепция врожденного нарушения созревания головного мозга, разработанная H. Doose и соавт. [12]. Согласно этой концепции, у некоторых пациентов имеется генетически детерминированное нарушение созревания головного мозга во внутриутробном периоде, которое является причиной комплекса патологических состояний: эпилептических приступов, паттернов по типу ДЭРД на ЭЭГ и нарушений развития, в частности дисфазии и аутистических расстройств. Появление на ЭЭГ эпилептиформной активности по типу ДЭРД наблюдается, как правило, в возрасте от 3 до 6 лет, что позволяет уточнить ее возможную связь с нарушениями развития, в том числе речевого.
Цель настоящего исследования — оценка показателей нейрофизиологического обследования детей с дисфазией развития по данным ЭЭГ и ЭЭГ-мониторинга с выявлением эпилептиформной активности.
Материал и методы
Запись ЭЭГ была проведена у 65 детей, 48 мальчиков и 17 девочек, с дисфазией развития. Их возраст был от 3 до 4 лет 11 мес. У 31 ребенка было установлено ОНР 1-го уровня и у 34 — ОНР 2-го уровня.
Обследование детей осуществлялось в амбулаторных условиях, и на момент его проведения дети не получали какой-либо лекарственной терапии.
Диагноз дисфазии развития ставился на основании критериев МКБ-10 [1] как расстройство развития экспрессивной речи (рубрика F80.1), уровень ОНР определялся по отечественной психолого-педагогической классификации [13].
Из изучаемой группы исключались дети, у которых отставание в развитии речи обусловливалось снижением слуха, умственной отсталостью, аутизмом, тяжелой соматической патологией, неполноценным питанием, а также влиянием неблагоприятных социальных факторов (недостаточным общением и воспитанием).
После обнаружения на ЭЭГ изменений для уточнения их характера в 27 случаях из 65 было проведено видео-ЭЭГ-мониторирование в состояниях бодрствования и сна.
При анализе результатов ЭЭГ применялся метод визуальной оценки общего паттерна электрической активности мозга с расчетом индекса выраженности и амплитуды основного ритма (α-ритм), топографии, амплитуды и представленности других частотных составляющих, а также выявлением асимметрии и фокусов патологической активности. Это в совокупности позволяло отнести ЭЭГ к определенному типу по классификации Е.А. Жирмунской [14], адаптированной к детскому возрасту [15]. Кроме того, использовались Международная классификация нарушений ЭЭГ [16], систематизация нормальных и условно патологических паттернов ЭЭГ в зависимости от локализации [17].
Результаты
Многие родители обследованных детей указывали, что уже в раннем возрасте ребенка они обращали внимание на отсутствие или недостаточную выраженность у него лепета, молчаливость. При этом они часто подчеркивали, что ребенок как будто все понимает, но не желает говорить. Вместо речи развивались мимика и жестикуляция, но дети ими пользовались избирательно, в основном в эмоционально окрашенных ситуациях. Первые слова и фразы появлялись поздно. Родители при этом отмечали, что кроме отставания в речи, в целом дети развивались нормально. Имея скудный активный словарь, дети пользовались лепетными словами, звуками и звукоподражанием. Если появлялась элементарная речь, то отмечалось много оговорок, на которые дети обращали внимание и пытались исправлять ошибки.
На момент обследования объем активного словаря (запас произносимых слов) у детей с ОНР 1-го уровня не превышал 15-20 слов, а с ОНР 2-го уровня насчитывал от 20 до 50 слов.
При оценке ЭЭГ у большинства — 47 (72,3%) пациентов был отмечен I тип ЭЭГ — организованный, у 4 (6,2%) детей ЭЭГ приближалась к организованному типу по достаточно четко выраженному α-ритму с высоким значением его индекса, но ему не вполне соответствовала из-за повышенной представленности медленных нерегулярных колебаний, чаще в каудальных областях. Поэтому в этих случаях тип ЭЭГ был отнесен к I-b. У 13 (20%) детей выявлен тип ЭЭГ, соответствующий или приближающийся к IV (дезорганизованный, с преобладанием α-активности) по параметрам значительно представленных диффузных нерегулярных волн, но отличающийся высоким индексом (60-87%) α-ритма. У 1 (1,5%) ребенка ЭЭГ была отнесена к III типу (десинхронному) в связи с количественным преобладанием медленных диффузных волн низкой амплитуды и значительно сниженной амплитудой ритмизированной α-активности (менее 40 мкВ). II тип ЭЭГ в обследованной группе детей зарегистрирован не был.
Соответствующие возрасту частотные характеристики α-ритма имелись в 57 (87,7%) случаях, замедление фоновой активности — у 8 (12,3%) детей. В фоновой записи ЭЭГ у большинства — 57 (87,7%) детей было выявлено преобладание α-ритма в задних отделах коры больших полушарий головного мозга, с акцентом амплитуды в затылочной области. В меньшей части случаев, у 8 (12,3%) детей, наблюдалось смещение градиента α-ритма в теменно-височные отделы.
Одной из особенностей ЭЭГ, обнаруженной у 8 (12,3%) обследованных детей, были вспышки полиморфной медленной активности и острых α-волн в центрально-височных (у 4 детей) и лобно-центрально-передневисочных (у 4) областях полушарий головного мозга. По своей морфологии они были близки к центральному τ-ритму и могли быть связаны с незрелостью или резидуально-органическим повреждением ЦНС. При этом у 3 (4,6%) детей данные изменения локализовывались в доминантном, левом полушарии, у 5 (7,7%) — билатерально, без четкой локализации сторон. Таким образом, при дисфазии развития у детей могут иметь место изменения как со стороны левого, так и правого полушарий головного мозга.
При изучении реакции на ритмическую фотостимуляцию с частотой от 2,0 до 30,0 Гц были выявлены определенные особенности: у 56 (86,1%) детей не было установлено реакции усвоения ритма при частоте фотостимуляции от 2,0 до 30,0 Гц; у 4 (6,2%) зарегистрирована выраженная реакция усвоения ритма при низкочастотной фотостимуляции (6; 8 Гц), у 5 (7,7%) — при относительно высокочастотной фотостимуляции (10 Гц).
В табл. 1
обобщены выявленные на ЭЭГ изменения.
Необходимо отметить, что у 8 (12,3%) детей с дисфазией развития было зарегистрировано наличие специфических эпилептиформных паттернов, несмотря на отсутствие у них эпилептических приступов в анамнезе, на момент обследования и за весь период динамического наблюдения. Таким образом, эпилептиформная активность была субклинической.
Всем пациентам, у которых были обнаружены эпилептиформные разряды на рутинной ЭЭГ, было проведено видео-ЭЭГ-мониторирование в состояниях бодрствования и сна для исключения диагноза эпилепсии, в том числе скрытых приступов, а также феномена электрического эпилептического статуса в фазу медленного сна — ESES (electrical status epilepticus during slow sleep).
Прежде всего, обратим внимание на ДЭРД, которые представляют собой специфический эпилептиформный паттерн с характерной морфологией — высокоамплитудный пятиточечный электрический диполь, состоящий из острой и медленной волн; начальный компонент состоит из трехфазной острой волны, которая всегда превышает по амплитуде последующую негативную медленную волну. ДЭРД низкого индекса были обнаружены у 3 (4,6%) детей. Они локализовывались у 1 пациента в левой центрально-височной, у 1 — в правой височной и у 1 — в затылочной областях мозга. Еще у 5 (7,7%) детей были обнаружены эпилептиформные разряды низкого индекса, представленность которых не соответствовала картине эпилептической энцефалопатии и паттерну ESES. Выявленные эпилептиформные разряды у этих 5 пациентов регистрировались в состоянии бодрствования и имели следующий характер: 1) отдельных, коротких, диффузных вспышек высокоамплитудных медленных волн с включением пик-волновых и островолновых компонентов в лобно-центрально-передневисочных областях мозга, S>D
— у мальчика 3 лет 2 мес с моторной дисфазией; 2) повторных, коротких разрядов диффузных высокоамплитудных заостренных потенциалов и медленных волн с включением пик-волновых и островолновых компонентов в центральных и височных отделах,
S>D
— у мальчика 3 лет 6 мес с моторной дисфазией; 3) короткого разряда единичных, диффузных разрядов пиков, острых и медленных волн с преобладанием в лобно-передневисочных областях мозга, билатерально (
S=D
) — у девочки 3 лет с моторно-сенсорной дисфазией; 4) частых вспышек полиморфной медленной активности, иногда — с включением острых α-τ-потенциалов, редко — генерализованных вспышек полиморфной активности с акцентом изменений в переднецентрально-передневисочных отделах,
S=D
— у мальчика 4 лет 4 мес с моторной дисфазией; 5) острых волн, комплексов острая-медленная волна и разрядов острых волн в теменно-задневисочно-затылочной области мозга,
D>S
— у девочки 3 лет 7 мес с моторно-сенсорной дисфазией.
Особенности изменений на ЭЭГ также проанализированы в зависимости от степени выраженности ОНР (табл. 2)
.
Сразу заметим, что статистически достоверных различий между группами пациентов с ОНР 1-го и 2-го уровней не было установлено ни по одной из характеристик ЭЭГ. Тем не менее прослеживалась тенденция к повышению частоты изменений на ЭЭГ у детей с более выраженными речевыми нарушениями при ОНР 1-го уровня. Так, при определении частотных характеристик α-ритма замедление фоновой активности чаще обнаруживалось среди детей с ОНР 1-го уровня (16,1%), чем 2-го уровня (8,8%). Эпилептиформная активность также чаще выявлялась при ОНР 1-го уровня — у 5 (16,1%) пациентов, чем 2-го — у 3 (8,8%). В частности, ДЭРД отмечены у 2 (6,5%) детей с ОНР 1-го уровня и 1 (2,9%) с ОНР 2-го уровня. Комплексы острая-медленная волна низкого индекса определялись у 3 (9,7%) детей с ОНР 1-го уровня и 2 (5,9%) с ОНР 2-го уровня. Сравнение данных об изменениях на ЭЭГ в группах детей с ОНР 1-го и 2-го уровней могут быть свидетельством более выраженной функциональной незрелости структур головного мозга при ОНР 1-го уровня, что определяло более выраженное отставание в развитии речи.
Всем детям, у которых на ЭЭГ были выявлены замедление фоновой активности 1-2-й степени, а также эпилептиформная активность, при наблюдении в динамике проводился контроль ЭЭГ с интервалами 4-6 мес в течение 1,5-3 лет. При этом частотные характеристики фоновой активности приближались к возрастным нормам основного ритма, нарастала организация ритма. Это говорит о том, что описанные выше изменения носят преходящий характер, отражая проявления функциональной незрелости головного мозга. Изучение эпилептиформной активности в динамике показало, что она оставалась субклинической, и признаков ее прогредиентности не отмечалось.
Обсуждение
Как показывают полученные результаты, не у всех детей с дисфазией развития выявляются изменения биоэлектрической активности головного мозга, и характер этих изменений не всегда соответствует степени выраженности речевых расстройств. При определении характеристик α-ритма соответствующие возрасту параметры были обнаружены у 57 (87,7%) пациентов, замедление фоновой активности — у 8 (12,3%). При этом замедление фоновой активности чаще обнаруживалось у детей с ОНР 1-го уровня (16,1%), чем 2-го (8,8%).
Эпилептиформная активность на ЭЭГ была обнаружена у 8 (12,3%) пациентов с дисфазией развития, но во всех случаях она не проявлялась клинически. У 3 (4,6%) детей эпилептиформная активность определялась в виде ДЭРД, у 5 (7,7%) — эпилептиформных разрядов с низким индексом. Обращают на себя внимание случаи дисфазии развития с эпилептиформной активностью, имеющей лобную и височную локализацию в доминантном полушарии (у правшей — левом, у левшей — правом). Височная доля — зона Вернике — поле 22 коры левого полушария, отвечает за восприятие и дифференцировку слуховых сигналов, сложные процессы понимания речи, а нижняя лобная извилина (зона Брока — поля 44 и 45) обеспечивает программу речевого высказывания и моторную сторону речи.
Локальные изменения фоновой ЭЭГ, отмеченные у части детей с дисфазией развития, соответствуют предположению о том, что в основе наблюдаемых у них речевых нарушений лежит дисфункция лобной и височной долей больших полушарий головного мозга. Одновременно следует признать обоснованным мнение ряда исследователей о том, что у детей с дисфазией развития возможно вовлечение в патологический процесс как левого, так и правого полушарий головного мозга. По данным Ч. Ньокиктьена [4], при записи ЭЭГ в группе из 163 детей с дисфазией развития локальные (не только эпилептиформные) нарушения были выявлены в ¼ случаев, из них у 11 пациентов — в отведениях справа, у 25 — слева, у 6 — с обеих сторон. По-видимому, локализация и характер повреждений ЦНС, затрудняющих нормальное формирование латерализации речевых функций, препятствуют компенсаторным перестройкам и усугубляют трудности овладения речью у детей.
Следует отметить, что в наших наблюдениях эпилептиформная активность чаще выявлялась при ОНР 1-го уровня — у 5 (16,1%) пациентов, чем 2-го — у 3 (8,8%). В частности, ДЭРД отмечены у 2 (6,5%) детей с ОНР 1-го уровня и 1 (2,9%) с ОНР 2-го уровня, а комплексы острая-медленная волна — у 3 (9,7%) детей с ОНР 1-го уровня и 2 (5,9%) с ОНР 2-го уровня.
H. Doose и соавт. [12] рассматривают ДЭРД на ЭЭГ как генетически детерминированный эпилептиформный феномен с аутосомно-доминантным типом наследования, низкой пенетрантностью и вариабельной экспрессивностью гена. Данная эпилептиформная активность в большинстве случаев не связана со структурным органическим повреждением головного мозга, имеет возрастзависимый характер. По мере взросления ребенка и созревания ЦНС отмечается полный регресс ДЭРД к подростковому возрасту [17, 18]. Однако, несмотря на термин «доброкачественная», данная эпилептиформная активность способна оказывать негативное влияние на развитие высших психических функций [19, 20].
В популяции здоровых детей, по данным H. Doose [18], эпилептиформная активность на ЭЭГ встречается примерно в 2% случаев. В исследовании O. Eeg-Olofsson и соавт. [21] эпилептиформная активность была зарегистрирована у 1,9% здоровых детей в возрасте от 3 до 15 лет. По наблюдениям G. Cavazzuti и соавт. [22], частота эпилептиформной активности составляет 3,5%. При этом частота встречаемости ДЭРД имеет отчетливую возрастную зависимость [20]: среди обследованных без приступов в возрасте от 2 до 14 лет наибольшее число детей с ДЭРД были в возрасте 4-5 лет, второй пик встречаемости пришелся на возраст 8-9 лет. Поэтому частота встречаемости ДЭРД, составившая 4,6% среди обследованных нами пациентов с дисфазией развития в возрасте 4-5 лет, представляется незначительно превышающей средние популяционные значения для данного возраста.
Среди эпилептических синдромов, которые необходимо исключать при расстройствах речи у детей с применением ЭЭГ, в литературе рассматриваются эпилепсия с ESES или продолжительными комплексами пик-волна в фазе медленного сна (CSWS), а также синдром Ландау-Клеффнера [2, 4].
ESES является ЭЭГ-паттерном, который выявляется у детей 4-5 лет и более старшего возраста, в ряде случаев в анамнезе имеются указания на ранние поражения ЦНС и различные неврологические нарушения. Изменения на ЭЭГ примерно в 70% случаев сопровождаются эпилептическими приступами, чаще всего — парциальными приступами во время ночного сна. Эпилептиформная активность на ЭЭГ сохраняется на протяжении нескольких месяцев или лет. Данный синдром часто сопровождается когнитивными и поведенческими нарушениями и/или регрессом в развитии, затрагивающим функции речи. После исчезновения пароксизмальной активности на ЭЭГ отмечается некоторое улучшение когнитивных функций [2].
При синдроме Ландау-Клеффнера — «приобретенной эпилептической афазии» — происходит быстрый распад понимания речи (слуховая вербальная агнозия). Афазия обычно развивается в возрасте 3-7 лет. Ранее нормально развивавшийся ребенок теряет способность понимать обращенную к нему речь и говорить. В некоторых случаях потеря речи происходит постепенно и может растягиваться во времени до полугода, но чаще случается внезапно. Изменения на ЭЭГ выявляются в 100% случаев, характеризуются выраженной пароксизмальной активностью — часто в виде комплексов спайк-волна, множественных острых волн с преобладанием в височных отделах с одной или двух сторон, обычно асимметричных. Описана [19] длительная региональная и диффузная эпилептиформная активность в виде ДЭРД с нарастанием индекса в фазу медленного сна (до 85% и более) при пролонгированной записи. У многих детей с синдромом Ландау-Клеффнера во время медленного сна выявляется ESES. В большинстве случаев развиваются когнитивные и поведенческие нарушения, к которым примерно у 80% пациентов присоединяются эпилептические приступы (средний возраст — 5-7 лет, но их начало также описано в более старшем и младшем возрастах): генерализованные тонико-клонические, фокальные моторные, атипичные абсансы и атонические приступы, а также эпилептический статус. Приступы чаще отмечаются в ночное время. Синдром Ландау-Клеффнера характеризуется значительной гетерогенностью. В большинстве случаев эпилептические приступы и изменения на ЭЭГ исчезают до наступления 15-летнего возраста [2, 4, 19]. Как ESES, так и синдром Ландау-Клеффнера были исключены у пациентов рассматриваемой нами группы по данным клинического и нейрофизиологического обследования.
При выявлении эпилептиформных изменений на ЭЭГ пациентам с дисфазией развития показано проведение видео-ЭЭГ-мониторирования в состояниях бодрствования и сна с последующим периодическим контролем ЭЭГ в динамике. Но, по-видимому, риск формирования эпилепсии у пациентов с дисфазией развития невысок. Подтверждением этому служат результаты проведенного нами [23] ретроспективного обследования 110 детей в возрасте 7-9 лет, которые ранее, в возрасте 3-4 года, наблюдались по поводу дисфазии развития. Из всей группы лишь в 1 случае отмечено развитие эпилепсии, а именно — миоклонической эпилепсии в возрасте 9 лет у девочки с ОНР 2-го уровня в анамнезе.
Как отмечают L. Neuschlova и соавт. [9], частота обнаружения эпилептиформной активности среди пациентов с дисфазией развития варьирует в исследованиях разных авторов настолько широко (от 9 до 94%), что реальная оценка ее встречаемости затруднена. Это обусловлено методологическими различиями, в том числе критериями диагноза дисфазии, включением в изучаемые группы или исключением из них пациентов с аутистическими расстройствами, эпилептическими синдромами или эпилептическими приступами в анамнезе, а также в подходах к регистрации ЭЭГ и принципах оценки эпилептиформной активности.
При проведении ЭЭГ или ЭЭГ-мониторирования C. Duvelleroy-Hommet и соавт. [7] выявили ДЭРД у 38% из 24 детей с дисфазией развития, A. Picard и соавт. [10] — у 50% из 52, B. Echenne и соавт. [8] — у 93% из 32, L. Neuschlova и соавт. [9] — у 39% из 28 пациентов. При этом из обследованных групп не исключались значительное число детей, страдающих эпилепсией и аутизмом, но также имеющих выраженное отставание в речевом развитии, что, безусловно, приводило к увеличению частоты обнаружения ДЭРД. В то же время R.Tuchman и соавт. [11] отметили эпилептиформную активность у 58% детей с дисфазией и эпилепсией, но только у 9% — без эпилепсии.
Полученные нами данные позволяют уточнить частоту встречаемости эпилептиформной активности у пациентов с дисфазией развития в возрасте 3-4 лет без аутистических проявлений и эпилептических приступов в анамнезе; при этом показано, что эпилептиформная активность чаще обнаруживается при более выраженном отставании в речевом развитии, соответствующем ОНР 1-го уровня (16,1% случаев), чем при ОНР 2-го уровня (8,8%). Одновременно следует отметить, что результаты проведенных к настоящему времени исследований не позволяют обозначить какие-либо специфические паттерны ЭЭГ у пациентов с дисфазией развития. В том числе в качестве часто встречающихся при дисфазии развития изменений на ЭЭГ не могут рассматриваться ни ДЭРД, ни другие виды эпилептиформной активности.
Для преодоления речевых нарушений детям с дисфазией развития показана комплексная терапия; наряду с проведением логопедической и психолого-педагогической коррекции рекомендуется назначать повторные курсы препаратов ноотропного ряда. При выборе лекарственной терапии в случаях сочетания дисфазии развития с субклинической эпилептиформной активностью на ЭЭГ следует отдавать предпочтение ноотропным препаратам, которые не вызывают ее нарастания. Таким лекарственным средством является пантогам (гопантеновая кислота), положительное действие которого подтверждено не только при дисфазии развития у детей [24], но и в терапии речевых, когнитивных и поведенческих нарушений в группе пациентов с эпилепсией в возрасте 3-4 лет, среди которых ни в одном случае не было зафиксировано отрицательной динамики на ЭЭГ [25].
Обобщая приведенные в статье данные, можно отметить: 1) при проведении ЭЭГ-исследований у 12,3% детей с дисфазией развития зарегистрированы признаки эпилептиформной активности, не проявляющиеся клинически. Эпилептиформная активность чаще выявлялась при ОНР 1-го уровня (16,1% пациентов), чем при ОНР 2-го уровня (8,8%), т.е. ее частота зависела от степени отставания в речевом развитии; 2) при выявлении эпилептиформных изменений на ЭЭГ пациентам с дисфазией развития показано проведение видео-ЭЭГ-мониторирования в состояниях бодрствования и сна с последующим периодическим контролем ЭЭГ под наблюдением невролога в динамике. Необходимо проведение дифференциальной диагностики с целью исключения редких эпилептических энцефалопатий, в том числе ESES и синдрома Ландау-Клеффнера.
На что стоит обратить внимание родителям?
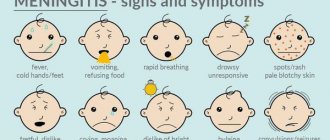
Первое и самое важное – нужно помнить, что эпилепсия – это не всегда приступы судорог с потерей сознания. При эпилепсии судороги могут быть локальными (местными): подергивания руки, ноги, угла рта, а могут вообще отсутствовать. Приступы могут проявляться морганием, слюнотечением, покраснением лица, эпизодами «отключения», которые ребенок не помнит, изменениями поведения (появлением агрессии, страха).
Часто в статусе у ребенка может быть только задержка развития.
Не каждые судороги могут быть проявлением эпилепсии, требующей серьезного лечения. Судорожный синдром – ответная реакция организма на интоксикацию, эндокринные заболевания, лихорадку, нарушения мозгового кровообращения, повышение внутричерепного давления и другие многочисленные патологии.
Насторожить родителя должны:
- Асимметрия. Подергиваются только одна рука или нога, одна половина лица, в процесс вовлекается одна половина туловища.
- Стереотипность приступов.
- Повторяемость.
- Распространение подергиваний, переход с одной части тела на другую.
При имеющемся подозрении необходимо попробовать «поймать» приступ на видео. Поставьте в комнату ребенка видеокамеру и фиксируйте периоды его бодрствования и сна. Если обнаружили что-то подозрительное – возьмите запись с собой на прием к врачу. Иногда запись приступа становится единственным и главным доказательством наличия проблемы, однако, доктор всегда будет рассматривать приступ в комплексе с другими симптомами: задержкой развития, двигательными и неврологическими нарушениями, данными других обследований.
Альфа-Ритм
О.Н. Кирилловских, В.С. Мякотных, Е.В. Сорокова, К.В. Мякотных, Т.А. Боровкова Уральская государственная медицинская академия, 620905 Екатеринбург, ул. Соболева, 25
Обследовано 89 пациентов пожилого и старческого возраста с различными формами эпилепсии. Определены общие характерные черты биоэлектрической активности головного мозга пожилых пациентов, страдающих эпилепсией, выявлены особенности электроэнцефалографической картины в зависимости от формы заболевания, возраста его дебюта, выраженности цереброваскулярной патологии. Показано, что контроль ЭЭГ в динамике помогает в подборе адекватной противоэпилептической терапии и позволяет избежать утяжеления когнитивного дефицита.
Ключевые слова: эпилепсия, пожилой и старческий возраст, ЭЭГ, цереброваскулярная патология, когнитивный дефицит.
Актуальность проблемы.
В последние годы все большее внимание приобретает проблема эпилепсии пожилого и старческого возраста, дифференциального диагноза эпилептических припадков и неэпилептических пароксизмальных состояний иного генеза, а также возможностей лечения эпилепсии у пожилых, страдающих множественной патологией [1,3,8]. Считается, что эпилепсия является заболеванием, развивающимся на основе генетически детерминированной предрасположенности головного мозга в сочетании с экзогенными факторами, определяющими ее актуализацию в клинической форме [4]. Доказано, что этой генетически детерминированной фенотипической предосновой развития эпилепсии у детей и подростков является высокоамплитудная синхронизация работы нейронов во всех частотных диапазонах. Но в процессе естественной возрастной трансформации биоэлектрической активности головного мозга происходит замедление основных корковых ритмов, прежде всего альфа-ритма, который выступает при старении в роли биологических часов. Кроме того, наблюдается снижение общего амплитудного уровня ЭЭГ и повышение доли бета-активности вследствие усиления неспецифических активирующих влияний срединно-стволовых структур [4,7]. Также с возрастом увеличивается количество медленных волн (МВ), преимущественно тета-диапазона, возникающих как регионально, преимущественно в лобно-височных областях, так и в виде генерализованного замедления основных корковых ритмов. Тем не менее, несмотря на происходящие возрастные изменения биоэлектрической активности головного мозга и укоренившееся мнение о том, что эпилепсия является заболеванием преимущественно представителей молодого возраста, заболеваемость эпилепсией в старших возрастных группах продолжает расти [7]. Поэтому нам показалось интересным определить особенности биоэлектрической активности как у пожилых пациентов с длительным анамнезом эпилепсии, так и у пациентов с дебютом эпилепсии в возрасте старше 60 лет.
Цель исследования
С помощью электроэнцефалографических (ЭЭГ) исследований определить особенности биоэлектрической активности головного мозга при эпилепсии у лиц пожилого и старческого возраста.
Материалы и методы.
В течение 5 лет, с 2006 по 2010 гг. проводилось проспективное исследование клинико-нейрофизиологических особенностей эпилепсии и возможностей ее лечения у 89 пациентов в возрасте 63-96 лет (m=75,5±6,87 лет). Диагноз эпилепсии во всех случаях был установлен на основании наблюдения не менее двух неспровоцированных эпилептических приступов. Критерием исключения являлся эпилептический синдром вследствие опухоли мозга, болезнь Альцгеймера. Группа контроля была представлена 30 пациентами в возрасте 65-85 лет (m=75±5,66 лет), не страдающих эпилепсией, но имеющих сходный спектр сопутствующей патологии, в основном сердечно-сосудистой. В зависимости от времени дебюта эпилепсии все больные основной группы наблюдений были подразделены на две сравниваемые группы: 1-я – пациенты с дебютом эпилепсии в пожилом и старческом возрасте, в основном постинсультного генеза (n=34); 2-я – пациенты с длительным анамнезом эпилепсии при ее дебюте до 60-летнего возраста (n=55). Отдельно из представителей 2-й группы была выделена подгруппа 2А – 18 пациентов старческого возраста, старше 80 лет, перенесших в годы Великой Отечественной войны тяжелую черепно-мозговую травму (ЧМТ) и страдающих посттравматической эпилепсией. Всем пациентам в исследуемых группах проводилось ЭЭГ исследование с периодичностью 4-6 за год. Применяли регистрацию ЭЭГ с визуальной оценкой и вычислением индексов для стандартных частотных диапазонов на компьютерном электроэнцефалографе «Энцефалан-131-01» (Россия, Таганрог). В процессе подбора оптимальной комбинации противоэпилептических препаратов записывали ЭЭГ в динамике через 5, 14 и 30 дней после смены схемы лечения. В случае отсутствия на рутинной ЭЭГ эпилептиформной активности или при сомнительных результатах больным проводили ЭЭГ с депривацией сна, дневной амбулаторный ЭЭГ – мониторинг, ЭЭГ- мониторинг сна на аппарате «Nicolet-one». При проведении ЭЭГ с частичной депривацией сна, лучше переносимой пожилыми, больного будили накануне в 4 часа утра и в 9 часов проводили запись ЭЭГ. Запись проводилась при биполярном и монополярном монтаже электродов с использованием 18-21 стандартного отведения по схеме 10-20, в качестве функциональных проб использовались: открывание и закрывание глаз, ритмичная фотостимуляция с частотой 3, 5, 10 и 15 Гц, блок с непрерывным возрастанием частоты фотостимуляции с 3 до 27 Гц и гипервентиляция в течение 3 минут. Оценка результатов ЭЭГ проводилась с использованием современных методов интерпретации – компьютерной обработки с вычислением индекса и амплитуды основных ритмов ЭЭГ, однако основным методов оценки ЭЭГ являлся визуальный. Первичная оценка варианта ЭЭГ проводилась с использованием классификации Е.А. Жирмунской [2], более детальное описание патологических изменений – с использованием Классификации Американской Ассоциации нейрофизиологов [6].
Результаты и их обсуждение.
При исследовании ЭЭГ пациентов обеих выделенных групп выявлены некоторые общие черты, которые отличают биоэлектрическую активность головного мозга пациентов больных эпилепсией пожилого и старческого возраста от таковой у лиц аналогичного возраста, но не страдающих эпилептическими припадками (табл. 1). Это, прежде всего, более высокий амплитудный уровень основных ритмов ЭЭГ: если в группе сравнения амплитуда ЭЭГ, как правило, не превышала 60 мкВ, то у больных эпилепсией средний амплитудный уровень оказался вдвое выше, составив 120-150 мкВ. Достоверных различий между представителями основной группы и группы контроля не выявлено только по частоте встречаемости межполушарной асимметрии, вспышек бета- активности и диффузной эпилептиформной активности. По остальным параметрам выявленные различия отчетливы и достоверны. Характерна также заметная тенденция к синхронизации основной биоэлектрической активности за счет дисфункции срединно-стволовых структур головного мозга. Tак, при исследовании рутинной ЭЭГ у 38 (42,7%) пациентов наблюдался высокоамплитудный для данного возраста вариант ЭЭГ с тенденцией к синхронизации основных корковых ритмов, в отличие от 2 (6,7%) пациентов контрольной группы (Р
Таблица 1. Сравнительная характеристика основных вариантов ЭЭГ и видов патологической активности.
| Основные характеристики ЭЭГ | Основная группа (n=89) | Группа сравнения (n=30) | |
| Гиперсинхронный высокоамплитудный вариант (sharp-looking) | 38 (42,7%) | 2 (6,7%) | |
| Десинхронный низкоамплитудный вариант | 0 | 14 (46,7%) | |
| Дезорганизованный гиперсинхронный вариант | 50 (56,2%) | 2 (6,7%) | |
| Дезорганизованный десинхронный вариант | 1 (1,1%) | 12 (40%) | |
| Межполушарная асимметрия | 28 (31,5%) | 4 (13,3%) | |
| Увеличение индекса бета-активности > 40% | 7 (7,9%) | 18 (60%) | |
| Вспышки бета-активности (excessivе fast) | 15 (16,9%) | 3 (10%) | |
| Замедление основной фоновой активности | I степени | 24 (27%) | 4 (13,3%) |
| II степени | 8 (9%) | 0 | |
| III степени | 3 (3,4%) | 0 | |
| Периодическое региональное замедление | в лобных отведениях | 23 (25,8%) | 5 (16,7%) |
| в височных отведениях | 41 (46,1%) | 0 | |
| Фокальная эпилептиформная активность | в состоянии бодрствования | 36 (40,4%) | 0 |
| в состоянии сна | 14 (15,7%) | 0 | |
| Диффузная эпилептиформная активность | 5 (5,6%) | 0 | |
| Индекс медленноволновой активности (%) | 39,5±6,5 | 29,9±3,1 | |
На фоне дезорганизации фоновой биоэлектрической активности у 50 (56,2%) пациентов основной группы также наблюдалась гиперсинхронизация основных корковых ритмов; в группе контроля подобного рода наблюдений оказалось всего 2 (6,7%); Р
Среди больных эпилепсией усредненные показатели индекса медленноволновой активности достигали 39,5±6,5%, в контрольной группе – 29,9±3,1% (Р
В группе больных эпилепсией в 24 (27%) наблюдениях отмечено замедление основной активности I степени (7 Гц и ниже), в контрольной группе – только в 4 (13,3%) случаях. Замедление основной активности II cтепени (6 Гц и ниже) также значительно чаще (Р=0,009) отмечено среди лиц, страдавших эпилепсией (табл. 1). Это согласуется с тем, что замедление основной активности по сравнению с возрастной нормой всегда является признаком серьезной патологии головного мозга [6]. Конечно, у пожилых больных замедление основной активности I степени может считаться условно-нормальным феноменом, так как после 60 лет происходит постепенное физиологическое уменьшение частоты альфа-ритма приблизительно на 1 Гц за каждые 10 лет [2,3,4,5]. Замедление же основной активности II-III cтепени у пожилых пациентов является маркером грубой корковой атрофии мозга [6].
В группе больных эпилепсией практически все виды пароксизмальной активности носили эпилептиформный характер; у 64 (71,9%) больных высокоамплитудные заостренные волны тета- и дельта-диапазона чаще локализовались в лобных и височных областях и являлись самым частым видом условно-эпилептиформной активности. Комплексы «острая-медленная волна», «спайк-медленная волна», классифицируемые как истинная эпилептиформная активность, встречались реже – у 36 (40,4%) больных и были обнаружены в состоянии бодрствования. У 14 (15,7%) пациентов эпилептиформная активность выявлена лишь во сне при проведении им ЭЭГ мониторинга.
Таким образом, на ЭЭГ пожилых больных эпилепсией помимо собственно эпилептиформной активности чаще встречаются следующие феномены: а) гиперсинхронная заостренная по форме альфа-активность амплитудой свыше 100 мкВ – «заостренные (sharp-looking) альфа-волны»; б) гиперсинхронная бета-активность (excessive fast) – бета-активность амплитудой свыше 30 мкВ, часто в форме веретен, распространяющихся за пределы нормальной лобно-центральной локализации; в) периодическое региональное замедление основной активности в виде вспышек билатерально-синхронных или локальных высокоамплитудных заостренных тета- и дельта-волн; г) повышение средней амплитуды ЭЭГ и увеличение мощности при компьютерном анализе во всех спектральных диапазонах; д) повышение индекса медленноволновой активности более 30%. Наличие перечисленных признаков позволяет даже при отсутствии истинной эпилептиформной активности сделать вывод об избыточной эпилептической синхронизации нейронов головного мозга, и, следовательно, подтвердить диагноз эпилепсии при соответствии анамнеза и клиники.
Сравнительный анализ характера изменений ЭЭГ в различных выделенных группах и подгруппах больных эпилепсией выявил следующие изменения (табл. 2).
Таблица 2. Сравнительная характеристика основных вариантов диффузных изменений на ЭЭГ и видов патологической активности у пациентов основных исследуемых группы и группы контроля.
| Основные характеристики ЭЭГ | Основная группа (n=89) | |||
| 1-я группа (n=34) | 2-я группа без 2A подгруппы (n=37) | 2А подгруппа (n=18) | ||
| Дезорганизованный гиперсинхронный вариант | 33 (97,1%) | 37 (100%) | 18 (100%) | |
| Десинхронный низкоамплитудный вариант | 1 (2,9%) | 0 | 0 | |
| Межполушарная асимметрия | 20 (58,8%) | 5 (13,5%)* | 3 (16,7%) | |
| Вспышки бета активности (excenssive fast) | 4 (11,8%) | 6 (16,2%) | 5 (27,8%) | |
| Замедление основной активности в фоновой записи | I степени | 11 (32,4%) | 7 (18,9%) | 6 (33,3%) |
| II степени | 2 (5,9%) | 0 | 6 (33,3%) | |
| III степени | 0 | 0 | 3 (16,7%) | |
| Периодическое региональное замедление | в лобных отведениях | 8 (23,5%) | 9 (24,3%) | 0 |
| в височных отведениях | 15 (44,1%) | 21 (56,8%) | 5 (27,8%) | |
| Фокальная эпилептиформная активность | бодрствование | 16 (47,1%) | 15 (40,5%) | 5 (27,8%) |
| сон | 6 (17,6%) | 8 (21,6%) | 0 | |
| Cредняя амплитуда (мкВ) | 98±6,7 | 116±4,8 | 93±4.9 | |
| Индекс медленноволновой активности (%) | 39,4±4,4* | 35,4±4,34* | 48,4±4,59 | |
Примечание: * – р
Все пациенты исследуемых групп с различными выделенными вариантами эпилепсии имели статистически значимые отличия (р
Амплитудная и частотная межполушарная асимметрия значительно преобладала в группе больных с поздним дебютом эпилепсии – у 20 (58,8%) пациентов (р
Рис. 1. Региональная эпилептиформная активность «острая-медленная волна» в правой височно-теменной области у пациентки В., 72 лет на фоне выраженной межполушарной асимметрии и относительной сохранности фоновой ЭЭГ в интактном левом полушарии головного мозга. Запись на фоне депривации сна.
На рутинной ЭЭГ у 16 (47,1%) больных с поздним дебютом эпилепсии выявлялся латерализованный очаг медленно-волновой активности в виде заостренных дельта- волн, частотой 1,5-3 Гц, комплексов «острая-медленная волна», реже «спайк-медленная волна», у 6 (17,6%) пациентов эпилептиформная активность выявлена на ЭЭГ мониторинге сна, у 2 (5,9%) выявлена диффузная (билатеральная) эпилептиформная активность. Сторонность выявления эпилептиформных изменений на ЭЭГ и локализации постинсультных рубцовых изменений совпадали в 70,6% (Р=0,016). У 10 (29,4%) пациентов не выявлялось очага эпилептиформной активности на рутинной ЭЭГ; это в основном были пациенты с небольшими, менее 15 мм, очагами размягчения, сформировавшимися в результате перенесенного инсульта.
Запись ЭЭГ во сне удалось провести только у 6 пациентов, так как инсомния является частым сопутствующим симптомом у данной категории больных. ЭЭГ картина медленноволнового сна у представителей 1-й группы характеризовалась дезорганизованностью с удлинением первой фазы медленноволнового сна. Сон при этом был поверхностным, с частыми пробуждениями на 8-12 секунд и артефактами движения; специфические паттерны сна – К-комплексы, вертекс-потенциалы и сонные веретена – были выражены недостаточно отчетливо, дельта- сон укорочен, амплитуда дельта- активности снижена. Стадия «быстрого сна» не была зарегистрирована ни у одного пациента 1-й группы, что в большей степени отражает дисфункцию центральных сомногенных механизмов у больных с церебральной сосудистой патологией. На дезорганизованном фоне у всех 6 пациентов, преимущественно во второй стадии медленноволнового сна, регистрировалась фокальная эпилептиформная активность типа «острая-медленная волна», локализованная в лобно-височных отведениях, на стороне постинсультного очага размягчения (рис. 2).
Рис 2. ЭЭГ больного М., 73 лет с диагнозом: Последствия ишемического инсульта в бассейне левой внутренней сонной артерии; симптоматическая эпилепсия, простые парциальные припадки с вторичной генерализацией. В I-II стадии медленноволнового сна – эпилептиформные комплексы «острая-медленная волна» в левой лобно-височной области.
Таким образом, анализирую структуру биоэлектрической активности у пациентов с поздним дебютом эпилепсии, можно предположить, что изначально, до перенесенного инсульта у больных имела место склонность нейронов коры к пароксизмальным формам реагирования в виде тенденции к высокоамплитудной синхронизации. Однако эти изменения оставались на протяжении жизни латентными и не приводили к клинической манифестации эпилепсии. Ишемический инсульт с локализацией мозгового инфаркта в корковых и корково-подкорковых областях явился тем пусковым моментом, который привел к формированию эпилептиформной активности и клиническому проявлению эпилепсии.
При изучении ЭЭГ у пациентов с длительным анамнезом эпилепсии (2-я группа наблюдений) наблюдался достоверно более высокий амплитудный уровень ЭЭГ (рЭЭГ-мониторинге сна (рис. 3). Индекс медленноволновой активности у пациентов 1-й группы, с ранним дебютом эпилепсии, достоверно выше, чем в группе контроля, но ниже чем у пациентов 1-й группы – с поздним дебютом эпилепсии (р
Рис. 3. ЭЭГ больного К., 77 лет с диагнозом: Симптоматическая эпилепсия, сложные парциальные припадки с вторичной генерализацией. Во второй фазе медленноволнового сна – короткий разряд диффузной эпилептиформной активности «спайк-медленная волна» с инициацией в левой лобно-височной области и феноменом вторичной билатеральной синхронизации.
Таким образом, биоэлектрическая активность в группе больных с ранним дебютом эпилепсии и длительным ее анамнезом отличалась признаками, характерными для биоэлектрической активности пациентов молодого возраста, страдающих эпилепсией, однако у пациентов пожилого возраста эти патологические признаки встречались реже. Процессы старения в биоэлектрической активности головного мозга больных эпилепсией проявляются, прежде всего, увеличением индекса медленноволновой активности, некоторым снижением общего амплитудного уровня ЭЭГ и снижением тенденции к генерализации эпилептиформных разрядов, что находит клиническое отражение в уменьшении доли вторично-генерализованных эпилептических припадков у пожилых пациентов. Можно предположить, что генетически детерминированные особенности биоэлектрической активности головного мозга, явившиеся причиной клинической манифестации эпилепсии, сохраняются на протяжении всей жизни.
Характерные особенности ЭЭГ в подгруппе пациентов старческого возраста (старше 80 лет) с боевой ЧМТ в анамнезе обусловлены возрастом больных и выраженными атрофическими изменениями в коре головного мозга. Основной отличительной чертой ЭЭГ представителей данной подгруппы 2А было увеличение индекса медленноволновой активности (48,4±4,59), что достоверно выше (P
Рис. 4. ЭЭГ больного Ч. 84 лет с диагнозом: Энцефалопатия сложного генеза (посттравматическая, цереброваскулярная), выраженные когнитивные и стато-координаторные нарушения. Симптоматическая эпилепсия, сложные парциальные припадки средней частоты. На ЭЭГ – диффузная медленноволновая активность в виде заостренных высокоамплитудных тета-дельта волн.
Региональная эпилептиформная активность у лиц старческого возраста выявлялась в небольшом проценте случаев – у 5 (27,8%) из 18, тем не менее, частота выявления региональной эпилептиформной активности больше чем в группе сравнения (P
Медленноволновая активность в ЭЭГ пациентов 2А группы более отражает не степень эпилептиформной активности, а уровень патологических морфологических и функциональных изменений нейронов вследствие травматических и сосудистых факторов. Индекс медленноволновой активности у этих пациентов оказался прямо пропорциональным степени атеросклеротического поражения церебральных сосудов и обратно пропорциональным количеству набранных баллов в процессе исследования когнитивных функций с помощью широко известной шкалы ММSE. Интересно, что индекс медленноволновой активности не является статической величиной, он может снижаться после курса сосудистой терапии и, наоборот повышаться при применении некоторых антиконвульсантов, в первую очередь барбитуратов. Это подтверждается анализом ЭЭГ у 3 (16,7%) представителей 2А подгруппы, принимающих барбитураты на протяжении более 60 лет; во всех случаях на ЭЭГ наблюдались грубые общемозговые изменения по органическому типу, продолженная медленноволновая активность различной амплитуды и степени синхронизации, но истинной эпилептиформной активности у данных больных не выявлено (рис. 5).
Рис. 5. ЭЭГ больного М., 85 лет с диагнозом: Сосудисто-атрофическое заболевание головного мозга, деменция, симптоматическая посттравматическая эпилепсия, редкие генерализованные судорожные припадки. Постоянный в течение 50 лет прием бензонала в дозе 100 мг 3 раза в день + фенобарбитала 100 мг на ночь. На ЭЭГ – диффузная медленно-волновая активность с синхронизацией в лобно-центральных отделах. Характерно полное отсутствие физиологических ритмов ЭЭГ. Истинной эпилептиформной активности не выявляется.
Таким образом, увеличение индекса медленноволновой активности на ЭЭГ в процессе лечения противоэпилептическими препаратами – это неблагоприятный прогностический признак углубления когнитивного дефицита который говорит о необходимости замены препарата на более современный или препарат другой группы.
Выводы.
- Частота выявления отчетливой эпилептиформной активности на ЭЭГ у пациентов пожилого и старческого возраста, страдающих эпилепсией, составляет 40,4%, условно-эпилептиформной активности – еще выше, до 72%. В ряде случаев эпилептиформную активность можно выявить при амбулаторном ЭЭГ мониторинге сна. Существуют индивидуальные различия характеристик ЭЭГ в зависимости от этиологии эпилепсии, длительности заболевания, возраста больных.
- Имеются следующие основные отличительные нейрофизиологические особенности ЭЭГ больных эпилепсией пожилого и старческого возраста:
- увеличение спектральной мощности ЭЭГ во всех частотных диапазонах – высокоамплитудный вариант ЭЭГ;
- усиление синхронизирующих влияний срединно-стволовых структур и, как следствие этого, сглаженность зональных различий;
- уменьшение доли бета-активности;
- увеличение индекса медленноволновой активности до 30% и выше, которое включает в себя как замедление основных корковых ритмов в фоновой записи, так и периодическое региональное замедление в виде билатерально-синхронных вспышек тета-дельта-волн;
- региональная эпилептиформная активность приблизительно в 40% выявляется в состоянии бодрствования, в 16% – при ЭЭГ мониторинге сна.
Литература.
- Гехт, А.Б., Бурд Г.С., Селихова М.В. Клинико-нейрофизиологические особенности двигательных нарушений у больных с постинсультной эпилепсией // Журнал неврологии и психиатрии.– 1998.– №7. – С. 4–8.
- Жирмунская, Е.А. В поисках объяснения феноменов ЭЭГ .- М.: НФП Биола, 1996. – 117 с.
- Зенков Л.Р., Елкин М.Н., Медведев Г.А. Клиническая нейрофизиология нейрогериатрических расстройств // Достижения в нейрогериатрии. – М., 1995. – С. 167-173.
- Зенков, Л.Р. Клиническая эпилептология : 2-е изд., испр. и доп. — М.: Медицинское информационное агентство, 2010.- С 123– 129.
- Зенков, Л.Р. Непароксизмальные эпилептические расстройства. – М.: Медпресс- информ, 2007. – 278 с.
- Мухин К.Ю., Петрухин А.С., Глухова Л.Ю. Эпилепсия: Атлас электроклинической диагностики.– М.: Альварес Публишинг, 2004. – 440 с.
- Мякотных В.С., Гальперина Е.Э. Электроэнцефалографические особенности у лиц пожилого и старческого возраста с различной церебральной патологией: Учебно-методические рекомендации. – Екатеринбург: Изд. УГМА. – 30 с.
- Blalock, E.M., Chen K.C., Sharrow K. Gene microarrays in hippocampal aging: statistical profiling identifies novel processes correlated with cognitive impairment // J. Neurosci. – 2003.- Vol. 23. – Р. 3807–3819.
- Carlson C. E., St Louis E.D., Granner M.A. Yield of video EEG monitoring in patients over the age of 50 // Program and abstract of the American Epilepsy Society 58th Annual Meeting. – 2004, 3 – 7 December. – Absract 2.- Р. 226.
- Van Cott, A. C. Epilepsy and EEG in the Elderly // Epilepsia. –2002. –Vol. 43, suppl. 3. – P. 94–102.
Виды приступов и аура при эпилепсии.
В международной классификации эпилептических приступов описано более 20 их разновидностей. В упрощенном виде классификация выглядит следующим образом:
- Парциальные (местные) приступы, протекающие без нарушений сознания.
При этих приступах судорожные подергивания захватывают какую-то часть тела, могут переходить с руки на ногу или на лицо и наоборот, но не распространяются на все тело. Иногда приступы протекают без судорог. Проявления таких фокальных приступов разнообразны: покраснение лица, слюнотечение, вспышки перед глазами, звон в ушах. Существует особый вид эпилепсии – джексоновский, при котором судороги захватывают сначала одну часть тела, потом перемещаются на другую в определенной последовательности.
- Парциальные приступы, протекающие с нарушениями сознания.
При этих приступах часты автоматизмы: человек расстегивает пуговицы, начинает что-то пережевывать, повторяет одну и ту же фразу «что такое», «плохо мне», смеется или гримасничает.
- Парциальные приступы с генерализацией.
Эти приступы начинаются, как описано выше, затем переходят в судорожный приступ, захватывающий все тело.
- Генерализованные приступы.
К ним относятся бессудорожные и судорожные приступы.
Абсансы – это вид бессудорожного приступа, при котором сознание человека отключается на короткий период времени. Они также могут сопровождаться автоматизмами, вегетативной симптоматикой (покраснение лица, слюнотечение).
Генерализованный тонико-клонический судорожный приступ выглядит как судороги всего тела с потерей сознания и амнезией (человек, придя в себя, не помнит сам приступ и события, непосредственно предшествующие приступу).
- Кроме того, существуют атипичные приступы, которые нельзя отнести ни к одной из групп.
Иногда приступу при эпилепсии предшествует аура – сенсорное ощущение в виде звука, цвета, запаха, неприятного привкуса, головокружения, изменения настроения, дискомфорта в животе.
Аура может проявляться самостоятельно, без приступа. Вид ауры определяется местонахождением эпилептического очага в коре головного мозга.
Эпилепсия без судорог у детей
Эпилепсия — это заболевание, связанное с нарушением работы определенных групп нервных клеток. Эпилепсия может быть врожденной и приобретенной. Иногда она начинается из-за повреждения головного мозга в результате травмы или опухоли. Также ее причиной может стать врожденная киста или другие особенности мозгового строения. Бывает, что эпилептические приступы начинают происходить без видимых причин на фоне наследственной предрасположенности.
Эпилепсия у детей может проявляться судорогами всего тела или одной конечности, а также эпизодами «выключения».
Бессудорожные приступы эпилепсии у детей
Эпилептические приступы с судорогами больше характерны для малышей с рождения до 2–3 лет. У детей старше 4–5 лет чаще бывают эпилептические приступы без судорог.
Наиболее частый бессудорожный приступ — это абсанс, кратковременное выключение сознания. Со стороны это выглядит как будто ребенок «завис», задумался. Взгляд не сосредоточен. Во время приступа малыш прекращает деятельность (например, игру, ходьбу, письмо) и замирает. При этом он может выполнять стереотипные движения (например, сгибание-разгибание пальцев).
Во время приступа ребенок ни на что не реагирует, его невозможно вывести из этого состояния. Спустя несколько секунд (обычно от 2 до 20) приступ завершается, ребенок снова «включается» и продолжает то, что он делал до приступа. Сам приступ не помнит.
Таких абсансов может быть несколько десятков в день. Обычно приступ провоцируется гипервентиляцией, вызванной частым вдохами. Абсансы долгое время могут оставаться незамеченными даже близкими родственниками ребенка.
Если вы замечаете, что ваш малыш часто замирает во время игры, понаблюдайте за ним повнимательнее. При любых сомнениях лучше ничего не дожидаться, а как можно быстрее посетить вместе с малышом детского невролога.
Чем опасна эпилепсия в детском возрасте
Эпилептические приступы (даже если они протекают без судорог), особенно частые (несколько раз в день), мешают нормальной работе головного мозга и в дальнейшем нарушают развитие нервной системы ребенка. Такие дети могут отставать от сверстников в развитии.
Для эпилепсии, особенно начавшейся в детском возрасте, характерны особые изменения личности. Эти изменения связаны не только с приступами, но и с принимаемыми лекарствами, отношением окружающих. С возрастом у людей, страдающих эпилепсией, появляется раздражительность, излишняя обстоятельность, замедленность мышления.
Прогноз при эпилепсии.
Эпилепсия всегда оценивается врачом как комплекс симптомов.
Доброкачественные формы эпилепсии часто требуют только наблюдения и могут проходить сами с возрастом.
В других случаях эпилепсия и сочетающиеся с ней патологии могут требовать серьезного лечения, и прогноз при этом будет зависеть от тяжести основного заболевания. Некоторые из этих патологий можно излечить совсем, например, удалить опухоль, устранить последствия травмы. Тогда исчезнут и приступы. В других случаях требуется пожизненный прием препаратов, работа с психологом.
Доброкачественная детская эпилепсия с пиками на ЭЭГ в центрально-височной области
Диагноз основывается на типичных проявлениях приступов и ЭЭГ данных. На нормальном или умеренно измененном общем фоне ЭЭГ имеются локальные пики или острые волны и/или комплексы пик-волн в одном полушарии или двух, но с односторонним преобладанием в центрально-средневисочных отведениях. Характерно извращение фазы над роландической или височной областью. Эпиактивность может иногда отсутствовать, их выявлению помогает подготовка с частичной депривацией сна.
Наряду с типичными центрально-височными пиками при РЭ обнаруживаются и другие эпилептиформные паттерны. Так, примерно в 10-30% случаев регистрируются пик-волновые комплексы, преимущественно в затылочных регионах. Морфология этих комплексов близка к роландическим и типична для другой формы эпилепсии — доброкачественной парциальной эпилепсии с затылочными пароксизмами. Частота представленности затылочных пароксизмов при РЭ обратно пропорциональна возрасту ребенка, чаще встречается до 3 лет. Примерно в 10-20% случаев может быть зарегистрирована типичная генерализованная пик-волновая активность с частотой 3 Гц (абсансная), чаще при гипервентиляции. Пик-волновые комплексы в лобных или затылочных регионах при РЭ отмечаются примерно в 20% случаев. Корреляции между локализацией эпилептиформной активности на ЭЭГ и особенностями течения заболевания нет.
Дифференциальная диагностика
Диффдиагностику следует проводить с оперкулярными приступами при височной эпилепсии, джексоновскими присупами. Моторными пароксизмами и центротемпоральными острыми волнами могут проявляться глиомы, каверномы, поэтому необходима нейрорадиологическая диагностика. При атипичности приступов более разнообразной пароксизмальной активности в ЭЭГ, большей выраженностью интеллектуально-мнестических и речевых нарушений дифференцировать с синдромом Леннокса — Гасто. Такой вариант РЭ получил название «атипичной РЭ», или синдрома псевдоЛеннокса.
Центрально-темпоральные спайки могут обнаруживаться у 5% людей общей популяции здорового населения, иногда при синдромах Ретта и фрагильной Х-хромосомы, перисильвиевом синдроме (кортикальная дисплазия), каверномах, глиомах.
Прогноз
Прогноз благоприятный, в пубертатный период наступает полное выздоровление. Случаи возобновления приступов после выздоровления крайне редки (1-2%). Факторы риска высокой частоты приступов — начало болезни с генерализованного судорожного приступа и большой временной интервал (1 год) между первым и вторым приступами. Чем раньше дебют, тем больше общая продолжительность заболевания.
Что делать и чего нельзя делать при приступе?
При приступе необходимо:
- если положение человека не угрожает его жизни (например, нет риска падения с высоты, в воду и т.п.), то лучше его не трогать, не пытаться удержать голову или тело на месте;
- убрать из зоны досягаемости острые, твердые предметы, чтобы исключить возможность травмы;
- по возможности – под голову подложить что-то мягкое;
- при необходимости расстегнуть воротник, развязать пояс, ослабить галстук;
- наблюдать.
Будьте готовы к остановке дыхания, пене с примесью крови изо рта, непроизвольному мочеиспусканию.
Важно! При судорогах нельзя удерживать человека на месте, пытаться сунуть ему в рот ложку, деревянную палку, пытаться разжать зубы усилием. Западение языка такая мера не предотвратит, а слишком агрессивное усилие может сломать человеку зубы, челюсть или предмет, который оказывающий помощь пытается сунуть ему в рот. Осколки в этом случае попадут в рот и могут оказаться в дыхательных путях.
Если вы застали начало приступа – засеките время. Если приступ длится более 5 минут – вызывайте скорую. Попросите кого-нибудь записать приступ на видео, чтобы потом показать врачу. Это может оказаться очень важным, особенно для человека, у которого приступ случился впервые, или для человека, не знающего о своей эпилепсии.
Как правило, после приступа человек приходит в себя не сразу, в течение 10–15 минут. Дыхание обычно восстанавливается самостоятельно, поэтому необходимости в проведении искусственного дыхания нет. В этот период также не нужно предлагать воду или пищу.