В мае 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило к применению «Аймовиг» (Aimovig, международное непатентованное наименование — эренумаб) — первое полностью человеческое антитело для лечения мигрени. Это лекарство, разработанное совместными усилиями фармацевтических компаний Novartis и Amgen, имеет принципиально иной механизм действия, чем традиционно используемые при лечении мигрени препараты. Сможет ли «Аймовиг» значительно снизить симптомы и улучшить качество жизни страдающих мигренью людей? Попробуем разобраться.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
Первые две статьи нашего спецпроекта «Современные лекарства» были посвящены общим вопросам того, как развивалась лекарственная индустрия [1], и тому, как ученые ищут новые мишени для лекарственных средств [2]. Эта статья открывает ряд новостных материалов об интересных современных лекарствах.
Как велика проблема?
Мигрень — неврологическое заболевание, характерное в первую очередь сильными приступами головной боли, — известно уже более 3000 лет [3]. Однако несмотря на хорошую изученность симптомов и проявлений, причины мигрени до конца не установлены до сих пор. Ранее считали, что мигрень вызывается изменениями мозгового кровообращения, но сейчас многие исследователи предполагают, что это не главная причина [4].
Современное понимание патогенеза мигрени связано с вовлечением определенных нервных путей и нейропептидов, в особенности тройничного нерва и CGRP — пептида, связанного с геном кальцитонина (calcitonin gene-related peptide). Исследования показали, что возбужденные нервные клетки могут активировать тройничный нерв, что приводит к выделению CGRP и других нейропептидов. CGRP сильно расширяет сосуды, вызывая локальный отек, а это привлекает клетки, участвующие в процессе воспаления. При воспалении сосудов черепа и твердой мозговой оболочки провоспалительные молекулы стимулируют болевые окончания мозговых оболочек, что и приводит к мигрени (рис. 1) [5–8].
Такое возбуждение нервных клеток, запускающее мигрень, связано с наследственностью и физиологией, однако сегодня его причины определены далеко не точно [3]. Известно только, что этот процесс может провоцироваться самыми разными факторами: от банальных стрессов, усталости и недостаточного сна до текущего гормонального фона, депрессивных состояний и приема медикаментов [9].
Рисунок 1. Патогенез мигрени
What happens during a migraine attack?
При этом мигрень проявляется не только головной болью: симптомы этой серьезной болезни гораздо разнообразнее, а зачастую и более болезненны. Изнурительные приступы мигрени могут быть мучительными и невыносимыми и подчас продолжаются от нескольких часов до нескольких дней, сопровождаясь тошнотой, рвотой и повышенной чувствительностью к свету, звукам и запахам [3], [10]. Такие приступы лишают возможности нормально мыслить, жить и работать миллионы людей во всем мире. Считается, что от мигрени сегодня страдает каждый седьмой житель планеты, а в рейтинге причин, ограничивающих трудоспособность, это заболевание заняло второе место в мире (по данным 2021 года) [11], [12].
Неудивительно, что мигрень была включена Всемирной организацией здравоохранения в список заболеваний, в наибольшей степени нарушающих социальную адаптацию пациентов [3].
Материал и методы
Проведено открытое, рандомизированное, проспективное, сравнительное исследование 60 пациентов с эпизодической мигренью с аурой и без ауры в возрасте от 18 до 65 лет. В исследование включали пациентов с мигренью, диагноз которой устанавливали в соответствии с диагностическими критериями МКГБ-3 бета (2013). Частота приступов головной боли составляла не менее 2 и не более 15 дней в 1 мес, что исключало участие пациентов с хронической мигренью. В исследование не включали пациентов в возрасте младше 18 лет и старше 65 лет, пациентов с лекарственно-индуцированной головной болью, принимающих средства профилактики мигрени или другие специфические антимигренозные препараты. Также не включали пациентов с другой неврологической или психиатрической патологией, а также с наличием, в том числе в анамнезе, ишемической болезни сердца или цереброваскулярного заболевания.
Методом простой рандомизации образованы две группы. В 1-ю группу вошли 30 пациентов, средний возраст которых составил 31,0±6,7 года (р
<0,01), преимущественно женщины — 90% (
n
=27). У 6 (20%) пациентов отмечена мигрень с аурой и у 24 (80%) — без ауры, с частотой 2,2±1,0 приступа в 1 мес (
p
<0,01). Пациенты 1-й группы принимали Л.П. Мигрепам в соответствии с инструкцией по медицинскому применению препарата в терапевтической дозе 2,5 мг.
Во 2-ю группу включили также 30 пациентов, из которых 24 (80%) преобладали женщины. Средний возраст в группе составил 31,5±7,4 года (p
<0,01). У 9 (30%) пациентов наблюдалась эпизодическая мигрень с аурой и у 21 (70%) — без ауры со средней частотой 2,2±1,3 приступа в 1 мес (
p
<0,01). Во 2-й группе пациентам в качестве препарата для купирования приступа головной боли назначали Л.П. Суматриптан в дозе 50 мг.
Сравнение исходных характеристик исследуемых групп представлено в табл. 2.
Таблица 2. Сравнительный анализ клинико-демографических показателей исследуемых групп Примечание. Данные представлены в формате «число (%)» или «среднее значение» (СО). ВАШ — визуально-аналоговая шкала. * — p-value — статистическая достоверность различий в сравнении со средним значением в исследуемых группах (р<0,05). Примечание. Данные представлены в формате «число (%)» или «среднее значение» (СО). ВАШ — визуально-аналоговая шкала. * — p-value — статистическая достоверность различий в сравнении со средним значением в исследуемых группах (р<0,05)
При рассмотрении в исследуемых группах средний возраст был сопоставим и приходился на третье десятилетие жизни, по гендерному распределению в обеих группах преобладали лица женского пола. Согласно диагностическим критериям, в обеих группах преобладала мигрень без ауры с сопоставимой частотой и интенсивностью головной боли.
Участие в исследовании предусматривало три последующих визита.
В ходе первого (исходного) визита определяли критерии включения, проводили клиническое неврологическое обследование, регистрировали показатели жизненно важных функций организма (артериальное давление, число сердечных сокращений), оценивали сопутствующую лекарственную или иную терапию. Интенсивность головной боли, фото- и фонофобии определяли с помощью 10-балльной шкалы ВАШ. В критерии оценки головной боли были включены следующие характеристики: частота, выраженность сопутствующих симптомов, количество приступов, купированных триптанами. Кроме того, изучали показатели степени влияния головной боли на общее состояние и качество жизни (индекс HIT-6 — Headache Impact Test), времени нетрудоспособности, связанной с головной болью (индекс HALT — The Headache-Attributed Lost Time), степени дезадаптации, обусловленные мигренью (MIDAS). Оценивали удовлетворенность пациентов используемой терапией приступов мигрени (MIGRAINE-ACT — The Migraine Assessment of Current Therapy). На 2-м визите через 30 дней, на фоне приема Л.П. Мигрепам и Л.П. Суматриптан проводили клинический неврологический осмотр, оценку характеристик головной боли (частота, выраженность приступа и сопутствующих симптомов при купировании соответствующим триптаном). В ходе визита заполняли опросники HIT-6, HALT, MIDAS, MIGRAINE-ACT. На 3-м визите, через 60 дней, заключительно обследовали пациентов и заполняли все упомянутые выше опросники. Эффективность терапии Л.П. Мигрепам и Л.П. Суматриптан оценивали по специально разработанным дневникам сопутствующих симптомов, заполняемым пациентами в течение трех последовательных приступов.
Клинические характеристики влияния головной боли на пациентов в исследуемых группах во время исходного визита представлены в табл. 2. Среднее значение показателя степени влияния головной боли на общее состояние и качество жизни (индекс HIT-6) составило в 1-й группе 59,9±5,9 балла, во 2-й группе 55,9±8,9 балла, (р
<0,05), что соответствует существенному влиянию мигрени на повседневную активность. Выраженность боли и степени дезадаптации по шкале MIDAS в 1-й группе превышало значение во 2-й группе (
р
<0,01), однако оба показателя указывали на наличие выраженного ограничения повседневной активности у пациентов обеих групп (≥21 баллу соответствует IV степени тяжести) [8]. Показатель индекса HALT на протяжении последних 3 мес до начала лечения в 1-й группе составил 27,5±4,7 дня, а во 2-й — 22,4±7,4 дня (
р
<0,01), что указывает на сильное влияние головной боли на функциональное состояние в исследуемых группах и необходимость медикаментозной коррекции головной боли. При обследовании удовлетворенность используемой ранее терапией приступов мигрени по данным анкеты MIGRAINE-ACT в 1-й группе отметили 9 (30%) пациентов, что было сопоставимо со значением во 2-й группе — 11 (38%).
Статистический анализ осуществлялся в зависимости от распределения выборочной совокупности при помощи параметрических критериев Стьюдента, Пирсона и точного критерия Фишера с помощью программы Excel 2021 и пакета статистических программ Statistica 12. Для предоставления полученных данных использовали методы описательной статистики (с вычислением средних величин, стандартного отклонения, стандартной ошибки среднего). Результаты расценивались как достоверные при р
-value <0,05.
Лечение мигрени сегодня
К сожалению, сегодня не существует лекарства , позволяющего раз и навсегда избавиться от мигрени. Применяющиеся препараты позволяют в основном снизить интенсивность и количество приступов или уменьшить симптомы и облегчить возникшую боль. В связи с этим терапию такими препаратами делят на две группы:
- Абортивная (острая) терапия — для снятия или уменьшения симптомов при уже появившейся мигрени.
- Профилактическое лечение — для снижения интенсивности, продолжительности или частоты возникновения приступов.
В этой статье мы рассказываем о медикаментозном лечении и профилактике, но оставляем «за кадром» разнообразное нефармакологическое лечение мигрени: от методик релаксации до когнитивно-поведенческой психотерапии и транскраниальной электростимуляции. Между тем, эти методы в ряде случаев могут быть эффективной альтернативой медикаментам при невосприимчивости или противопоказаниях к лекарственной терапии, а иногда и эффективно дополнять ее при комбинированном лечении мигреней [13].
Абортивная терапия
При лечении легкой и средней мигрени назначают различные анальгетики и НПВП (нестероидные противовоспалительные препараты), в том числе и широко известные парацетомол, ацетилсалициловая кислота и ибупрофен, иногда в сочетании с кофеином, кодеином или психотропными веществами в составе комбинированных лекарств [14], [15]. Существенный недостаток — возможный обратный эффект при неконтролируемом использовании анальгетиков: усугубление головной боли, которая в таких условиях может стать ежедневной [8], [15].
Когда же бороться приходится с более тяжелыми и продолжительными приступами мигренозной боли, в дело вступает «тяжелая артиллерия», а именно алкалоиды спорыньи и триптаны. Триптаны были первыми препаратами, созданными специально для лечения мигрени; их начали разрабатывать еще в далеком 1972 году. Уже тогда было известно, что алкалоид спорыньи эрготамин способен уменьшить приступы мигрени, что связывали с его сосудосуживающим действием [16]. Этот препарат оставался единственным специфичным средством лечения мигрени, пока в 1991 году рациональный поиск не привел, наконец, к появлению суматриптана — первого препарата нового класса, который действует схожим с эрготамином образом, однако более эффективен и безопасен (рис. 2) [16].
В отличие от своего знаменитого производного — ЛСД, — сам эрготамин не обладает галлюциногенными свойствами.
Рисунок 2. Триптаны — лекарства, применяемые для облегчения мигрени, — селективные агонисты серотониновых рецепторов. Они связываются с определенными подтипами таких рецепторов (5HT1B, 5HT1D и 5HT1F) и активируют их. Это приводит к ингибированию выделения нейромедиаторов из пресинаптической мембраны окончаний тройничного нерва (показан желтым цветом), располагающихся в сосудах головы. При этом ингибируется и выделение уже упомянутого CGRP — ключевого нейромедиатора, вызывающего мигрень. Этот «нейронный» механизм действия, как считается, блокирует основное патологическое звено в развитии мигрени. Известно также, что прием триптанов избирательно сужает сосуды твердой мозговой оболочки, снижает проницаемость сосудистой стенки и уменьшает отек. Так или иначе, эти лекарства эффективны — они уменьшают воспаление и боль, а также интенсивность сопутствующих симптомов мигрени [17]. Похожим образом действуют и алкалоиды спорыньи эрготамин и дигидроэрготамин, правда, они менее селективны — могут связываться с дофаминовыми и адренорецепторами, из-за чего их эффективность и безопасность ниже.
[18]
Однако несмотря на хороший профиль эффективности и безопасности, триптаны теоретически могут быть опасны для пациентов с ишемической болезнью сердца из-за своего сосудосуживающего действия, что сдерживает их широкое назначение в качестве терапии при мигрени [16].
Профилактическая терапия
Медикаментозная профилактика показана, когда мигрени регулярны (более 2–3 раз в месяц), и надо сказать, что сегодня такая терапия не совсем безопасна и эффективна: ее связывают со значительными побочными эффектами и развитием быстрой толерантности к лечению (тахифилаксией) [14]. При этом используют несколько классов лекарств, изначально разработанных для других показаний, и пока что во многом с неясным механизмом действия при мигрени. Из этих лекарств можно отметить: трициклические антидепрессанты, противоэпилептические препараты, бета-блокаторы, блокаторы кальциевых каналов, ингибиторы АПФ и некоторые другие [14], [19].
Кстати, о многих перечисленных лекарствах, их прямых показаниях, истории появления и механизме действия можно прочитать в первой статье нашего цикла «Три поколения лекарств» [1].
Клинический анализ триптанов для купирования приступов мигрени
Мигрень – частая форма первичной головной боли, которая значительно ухудшает качество жизни молодых трудоспособных пациентов. Распространенность мигрени в странах Европы и США в среднем составляет 14%, значительно чаще мигрень встречается у женщин [1]. Для мигрени характерна интенсивная, приступообразная, чаще односторонняя головная боль длительностью от 4 до 72 ч, усиливающаяся при физической активности и сопровождающаяся различными неврологическими, соматическими, эмоционально-аффективными и вегетативными проявлениями. Существуют 2 формы мигрени: мигрень без ауры и мигрень с аурой [2]. У большинства пациентов мигрень имеет наследственный характер, но среди основных механизмов также обсуждаются нейрохимические и нейрогенные факторы. Показано также, что для пациентов с мигренью характерна повышенная возбудимость нейронов коры головного мозга. Важным механизмом, запускающим приступ и обусловливающим развитие и сохранение боли, является активация тригемино-васкулярной системы (ТВС). Механизм мигренозной ауры связывают с распространением волны возбуждения корковых нейронов (распространяющаяся корковая депрессия) от зрительной коры к соматосенсорной и лобно-височной области. Распространяющаяся корковая депрессия определяет характер и последовательность симптомов ауры: зрительных, чувствительных, речевых [3]. Большинство приступов мигрени возникают внезапно. Но часто приступ может провоцироваться рядом эндогенных и экзогенных факторов (триггеров мигрени). Многие авторы полагают, что для запуска приступа мигрени необходимо сочетание нескольких триггеров. В настоящее время описано около 60 различных факторов, провоцирующих приступы мигрени [4]. Основные факторы, провоцирующие приступ мигрени: – психофизиологические: чрезмерная нагрузка, усталость, плохой или избыточный сон; – гормональные и соматические: менструация, применение оральных контрацептивов, высокое кровяное давление; – эмоциональные: тревога, депрессия, выраженный стресс; – диетические: нерегулярное питание, алкоголь, шоколад, сыр, цитрусовые и др.; – экзогенные: изменение погоды и климата, яркий свет, шум, сильные запахи, курение, горячая ванна. Диагностика мигрени – клиническая, т. е. она основывается на детальном клиническом опросе и осмотре пациента. Крайне важны информация о возрасте начала головной боли, семейный анамнез, характеристики приступа, провоцирующие и облегчающие факторы, отсутствие признаков вторичного характера головной боли. При установлении диагноза следует опираться на диагностические критерии Международной классификации головных болей МКГБ-3 бета [2]. При типичной клинической картине мигрени дополнительные исследования не показаны, поскольку они неинформативны. Параклинические исследования должны проводиться только при подозрении относительно симптоматического характера цефалгии.
Основные стратегии купирования приступа мигрени
Главные цели лечения мигрени – облегчение течения мигрени, предотвращение хронизации и улучшение качества жизни пациента. Для достижения вышеперечисленных целей необходимо соблюдение нескольких подходов [5]: 1) купирование приступов мигрени; 2) профилактическое лечение; 3) рекомендации по соблюдению стиля жизни и поведенческая терапия. Профилактическая терапия мигрени проводится пациентам в случае наличия соответствующих показаний (частые приступы головной боли, высокая степень дезадаптации пациента, полная неэффективность симптоматических средств и др.). В целом от 10 до 30% пациентов нуждаются в назначении превентивных средств для снижения частоты приступов. Между тем стратегия купирования приступов должна быть применима у каждого пациента, обратившегося за консультацией, поскольку тяжесть мигренозной цефалгии, как правило, требует лекарственного купирования, причем подавляющее большинство пациентов лекарственные средства используют при каждом приступе мигрени. Цели купирования приступа мигрени – уменьшение интенсивности, длительности боли и сопровождающих симптомов (тошнота, рвота, фоно- и фотофобии и т. д.) и нормализация общего состояния пациента. Выбор оптимального средства для купирования приступа мигрени среди существующего множества фармакологических средств является непростым для каждого пациента.
Фармакологические средства, применяемые для купирования приступа мигрени:
• Препараты с неспецифическим механизмом действия: – анальгетики (парацетамол, кодеин); – нестероидные противовоспалительные средства; – комбинированные препараты. • Специфические антимигренозные средства: – селективные агонисты 5-HT1В/1D-рецепторов (триптаны); – неселективные агонисты 5-HT1-рецепторов (эрготамин, дигидроэрготамин). При выборе конкретного препарата для купирования приступа следует учитывать индивидуальные характеристики пациента, такие как интенсивность головной боли, скорость ее нарастания, наличие ассоциированных симптомов, степень дезадаптации, предшествующий опыт и предпочтения пациента. С этой точки зрения используется стратифицированный подход, который предполагает учет наиболее важной характеристики приступа мигрени – уровня дезадаптации пациента. Этот подход основывается на ранжировании мигренозных приступов по тяжести и степени нарушения адаптации пациентов [6]. Пациентам с легкими приступами и хорошим уровнем адаптации назначаются простые анальгетики и НПВС, возможно, в комбинации с лекарствами, которые улучшают их абсорбцию. Пациентам с тяжелыми и умеренными приступами необходимо назначение триптанов. Также важным принципом купирования приступа мигрени является раннее назначение антимигренозного препарата, обеспечивающее более полный обезболивающий эффект и меньшую вероятность рецидива. Кроме того, по мере прогрессирования приступа у большинства пациентов развивается гастропарез с нарушением пассажа пер-оральных медикаментозных препаратов в кишечник и их плохой абсорбцией. Раннее применение антимигренозных средств важно и с этой точки зрения [7]. Триптаны создавались специально для лечения приступа мигрени. Они обладают высоким аффинитетом к 5-HT1D и 5-HT1В-рецепторам, и у них отсутствует активность по отношению к адренергическим, дофаминергическим, мускариновым, гистаминовым и серотониновым рецепторам других подтипов. В настоящее время известны 7 представителей класса триптанов, в России зарегистрированы 5 из них (табл. 1) [8].
Патофизиологические механизмы действия триптанов при мигрени: – сужение избыточно расширенных краниальных сосудов; – ингибирование выделения противовоспалительных и вазоактивных пептидов; – ингибирование трансмиссии боли на уровне ствола мозга. Несмотря на то, что все препараты относятся к одному классу, они имеют различные фармакокинетические параметры. Эти различия имеют большое клиническое значение как факторы, определяющие эффективность триптана. В 1990 г. в клиническую практику был внедрен суматриптан. Он был первым представителем класса триптанов. В клинических исследованиях и до настоящего времени суматриптан рассматривается как «золотой стандарт» специфического лечения приступов мигрени. В последующем в практику вошли препараты с более высокой биодоступностью, достаточно длинным периодом полувыведения, что позволяет избегать частого приема препарата и рецидива головной боли.
Сравнительный анализ триптанов для купирования приступа мигрени
В исследовании J. Pascual et al. был проведен анализ использования золмитриптана в дозировке 5 мг для купирования приступа мигрени. Были исследованы 82 пациента, которые купировали в среднем 7 приступов мигрени. Пациенты принимали золмитриптан орально и интраназально, и также суматриптан подкожно. Авторами был сделан вывод о том, что около 62,5% пациентов отдавали свое предпочтение золмитриптану в связи с его хорошей эффективностью [9]. В 2015 г. было проведено подобное исследование, авторы которого пришли к выводу о том, что стандартная доза триптанов уменьшала интенсивность головной боли в течение 2 ч у 42–76% пациентов. Среди триптанов лучшую эффективность показали подкожная форма суматриптана и таблетированные формы золмитриптана и элетриптана [10]. Эффективность золмитриптана для купирования острого приступа мигрени была показана в исследовании L.C. Chen et al. Авторы продемонстрировали, что золмитриптан в дозировке 2,5 мг имел такую же эффективность при острых приступах мигрени, как элетриптан 2,5 мг и суматриптан 50 мг. Также золмитриптан был более эффективен, чем наратриптан 2,5 мг [11]. Золмитриптан является селективным агонистом 5НТ1-рецепторов. Обладает высоким сродством по отношению к 5НТ1B/1D-рецепторам и умеренным аффинитетом к 5HT1A-рецепторам. Взаимодействуя с 5НТ-рецепторами интракраниальных сосудов (включая артериовенозные анастомозы) и чувствительных нервов ТВС, иннервирующих чувствительные к боли интракраниальные структуры, золмитриптан вызывает вазоконстрикцию, ассоциированную с подавлением высвобождения CGRP, VIP и субстанции Р, и облегчает течение приступа мигрени, снижая интенсивность боли не позднее чем через 1 ч после приема, уменьшая выраженность тошноты, рвоты, фото- и фонофобии. Взаимодействие золмитриптана с рецепторами по механизму отрицательной обратной связи способствует уменьшению высвобождения серотонина и снижению его содержания в синаптической щели. Кроме этого, золми-триптан оказывает действие на центры ствола головного мозга, ответственные за развитие мигрени, что объясняет устойчивый повторный эффект при лечении серии приступов мигрени у одного пациента. После приема внутрь золмитриптан быстро и хорошо всасывается в пищеварительном тракте; прием пищи не влияет на абсорбцию препарата. Абсолютная биодоступность — около 40%. Максимальная концентрация в плазме крови достигается через 2 ч после приема. Средний период полувыведения золмитриптана и его активного метаболита — около 3 ч. Связывание с белками плазмы крови низкое (приблизительно 25%). Метаболизируется препарат в печени с образованием активного N-десметил-метаболита и двух неактивных — индолуксусной кислоты и N-оксид-метаболита. Агонистическое влияние активного метаболита в отношении 5НТ1-рецепторов в 2–6 раз превосходит исходное соединение. При повторном приеме аккумуляция не наблюдается. Более 60% введенной дозы выводится с мочой преимущественно в виде индолуксусного метаболита и около 30% — с калом в неизмененном виде. Почечный клиренс золмитриптана и его метаболитов у пациентов с умеренной и выраженной почечной недостаточностью уменьшен в 7–8 раз. Известно, что фармакокинетика золмитриптана не изменяется у лиц пожилого возраста [12]. В исследовании С.М. Spencer et al. была показана эффективность золмитриптана при лечении мигрени, связанной с менструацией, и мигрени с аурой, персистирующей и/или повторяющейся мигрени. Также золмитриптан был эффективен при облегчении таких симптомов мигрени, как тошнота, фото- и фонофобия. Для облегчения головной боли при мигрени золмитриптан в дозировке 5 мг имел сходную эффективность с суматриптаном в дозе 100 мг при однократном приступе, но, как правило, был более эффективен, чем суматриптан в дозах 25 и 50 мг для многократных приступов. Золмитриптан, как правило, хорошо переносится пациентами, вызывает меньшее количество нежелательных побочных эффектов. Наиболее частыми нежелательными явлениями при терапии золмитриптаном являются астения, сухость во рту, тошнота, головокружение, сонливость, парестезия, боль в груди [13]. В крупном двойном рандомизированном исследовании сравнивали эффективность и переносимость золмитриптана (2,5 или 5 мг) и суматриптана (50 мг) для купирования до 6 умеренных и тяжелых приступов мигрени. В исследовании приняли участие 1522 пациента, из них 500 пациентов принимали золмитриптан 2,5 мг, 514 пациентов – золмитриптан в дозировке 5 мг, 508 пациентов – 50 мг суматриптана. В целом уменьшение интенсивности головной боли в течение 2 ч в этих группах составило 62,9%, 65,7% и 66,6% соответственно. Не было статистически значимых различий между 50 мг суматриптана и 2,5 мг золмитриптана (р = 0,12) или 5 мг (р = 0,80). Авторы пришли к выводу, что золмитриптан (2,5 или 5 мг) оказался столь же эффективным, как и суматриптан в дозировке 50 мг [14]. Однако в сравнительном исследовании была показана более высокая эффективность купирования приступа мигрени в течение 2 ч золмитриптаном в дозировке 2,5 мг, чем суматриптаном в дозировке 25 и 50 мг, хотя у 3,3% пациентов не было клинически значимых показателей. В данном исследовании авторами не было обнаружено различий в частоте побочных эффектов между золмитриптаном и суматриптаном [15]. В большом сравнительном исследовании 1445 пациентов с мигренью оценивалась эффективность золмитриптана (в дозе 2,5 мг и 5 мг) и суматриптана (в дозе 25 мг и 50 мг) [16]. Поскольку для большинства современных триптанов характерно купирование 2-х атак из 3-х, в данном исследовании анализировалось количество пациентов с постоянным эффектом (в 3-х последовательных приступах). Этот показатель был достоверно выше в группе золмитриптана (рис. 1).
Триптаны противопоказаны при ишемической болезни сердца (ИБС), инсульте в анамнезе, неконтролируемой артериальной гипертензии (АГ), приеме некоторых лекарственных средств [17]. Вопрос о кардиобезопасности применения триптанов изучался специально в масштабных клинических исследованиях. В период с 1995 по 1999 г. в 20 штатах США с целью выявления серьезных кардиоваскулярных последствий мигрени и установления их возможной связи с применением современных антимигренозных средств проведено одно из самых больших проспективных популяционных исследований. В нем приняли участие 130 тыс. больных мигренью и примерно такое же количество больных, не страдающих мигренозными головными болями. В этих группах в течение всего периода наблюдения изучалась частота значимых кардиоваскулярных событий: инфаркта миокарда, инсульта, сердечных аритмий, нестабильной стенокардии, транзиторных ишемических атак (ТИА). Также анализировалась частота указанных событий у принимавших (50 383 пациента) и не принимавших (80 028 пациентов) селективные агонисты 5-НТ рецепторов. В целом у больных мигренью была выявлена более высокая частота ИБС, цереброваскулярных заболеваний, АГ и гиперлипидемии, а также нестабильной стенокардии и ТИА по сравнению с лицами, не страдающими мигренозными цефалгиями. Было показано, что в группе больных мигренью среди использовавших и не использовавших триптаны не было достоверных различий по частоте инфарктов миокарда, инсультов, сердечных аритмий, нестабильной стенокардии и ТИА, а частота смертельных случаев у пациентов, использующих триптаны, была даже ниже. Эти результаты позволили авторам прийти к заключению, что использование триптанов у больных мигренью не сопровождается увеличением риска значимых сердечно-сосудистых событий [18]. Таким образом, изучение этих селективных свойств триптанов имеет большое практическое значение для обоснования кардиобезопасности современных представителей данной группы препаратов. Сопоставление результатов клинических и экспериментальных исследований не позволяет связывать появление так называемых триптан-ассоциированных кардиальных жалоб с объективными кардиоваскулярными нарушениями у пациентов с мигренью. Для их объяснения следует изучить другие возможные неишемические причины этих расстройств. Их наличие может быть обусловлено генерализованными вазоспастическими реакциями, нарушением моторики пищевода, легочного кровообращения либо энергетического метаболизма скелетных мышц грудной стенки, а также развитием процессов центральной сенситизации [2]. Случаи серьезных кардиоваскулярных событий как в клинических испытаниях, так и в клинической практике наблюдаются крайне редко, и их появление не связано с фактом применения пациентами триптанов для купирования приступов головной боли. Профиль безопасности триптанов хорошо изучен. В соответствии с данными клинических исследований для пациентов без признаков коронарного заболевания триптаны характеризуются низким риском серьезных кардиоваскулярных побочных эффектов. Это позволяет рекомендовать пациентам с низким риском коронарного заболевания триптаны без предварительной оценки кардиального статуса. Таким образом, для купирования приступа мигрени могут использоваться различные препараты. Выбор оптимального средства для купирования приступа мигрени среди существующего множества фармакологических средств является непростым для каждого пациента. С этой точки зрения оптимален стратифицированный подход, основанный на ранжировании мигренозных приступов по тяжести и степени нарушения адаптации пациентов. Пациентам с тяжелыми и умеренными приступами необходимо назначение специфических препаратов (триптанов) с учетом их высокой эффективности в клинических исследованиях. Так, основываясь на данных эффективности золми-триптана в сравнительных исследованиях, можно рекомендовать данный препарат в качестве приоритетного для симптоматической терапии мигрени. Также для успешного лечения необходимо динамическое наблюдение за пациентами. Крайне важно помнить, что допустимо для купирования приступов использовать не более 10 доз в месяц, чтобы избежать злоупотребления лекарствами и развития медикаментозно-индуцированной головной боли.
Таргетная терапия мигрени: решение проблемы?
Поскольку мигрень — хроническое заболевание, а эффективность и безопасность используемых для профилактики препаратов оставляет желать лучшего, очевидно, что в этой области есть неудовлетворенная потребность; при этом специально разработанных для этого показания новых лекарств существует немного [14].
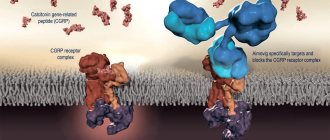
Прорывом сегодня могут похвастаться Amgen и Novartis, получившие в мае 2021 года одобрение на применение таргетного препарата «Аймовиг» (антитела erenumab) для профилактики мигрени у взрослых пациентов [20]. Это первое появившееся на рынке полностью человеческое антитело, профилактическое действие которого обусловлено связыванием и блокированием рецептора CGRP, роль которого в развитии мигрени считается критически важной (рис. 3).
Рисунок 3. «Аймовиг» специфически связывается с CGRP-рецептором, предотвращая связывание с ним CGRP. Связывание CGRP со своим рецептором в молекулярный комплекс (на рисунке слева) приводит к передаче ассоциированных с мигренью болевых сигналов. У людей с мигренью уровни CGRP повышены при болевом приступе и возвращаются к нормальному уровню, когда мигренозная боль отступает.
About Aimovig® (erenumab) in migraine prevention
«Аймовиг» был одобрен после трех серий клинических испытаний, результаты которых хоть и несколько разнились, но были сходны в одном: препарат показывал достоверное снижение числа дней с приступами и общей длительности мигренозной боли. При этом в испытаниях фазы III у 50% пациентов, принимавших по 140 мг «Аймовига», число болезненных дней снизилось в сравнении с плацебо аж вдвое, а безопасность и переносимость препарата оказалась как раз-таки вполне подобной плацебо [21], [22]. Такие результаты весьма обнадеживают, и очевидно, что хоть «Аймовиг» и не является панацеей, его применение определенно изменит к лучшему жизнь пациентов, страдающих частыми и тяжелыми формами мигрени.
Очистка антител с помощью непрерывной противоточной хроматографии
Очищать биотехнологически полученные антитела можно с помощью хроматографического оборудования партнера этого материала — компании Cytiva. Это делается в режиме непрерывной противоточной хроматографии (periodic counter-current chromatography, PCC) на установке ÄKTA pcc. В сочетании с минимальными габаритами системы технология непрерывной хроматографии обеспечивает максимально эффективное использование хроматографического сорбента (смолы). Этот метод особенно удобен для очистки нестабильных молекул, так как быстрый процесс обеспечивает стабильность целевого продукта. Система ÄKTA pcc разработана на основе хорошо зарекомендовавшей себя и широко используемой учеными во всем мире платформы для хроматографических систем ÄKTA. Ключевые характеристики системы ÄKTA pcc:
- Скорость потока: 0,5–75 мл/мин.
- Максимальное рабочее давление: 20 бар.
- Поддержка трех- и четырехколоночной конфигурации PCC (3C и 4C PCC).
- Интегрированные УФ-детекторы: один с перестраиваемой длиной волны (три значения) и три с фиксированной длиной волны (280 нм).
- Мониторы для отслеживания показателей pH и проводимости.
- Интерактивная визуализация, непрерывно отображающая состояние колонок и ход выполнения процесса.
- Линии трендов, позволяющие моментально приступить к анализу получаемой информации о процессе.
Хроматографические системы ÄKTA можно использовать вместе с колонками AxiChrom, хотя они подходят и для более крупных масштабов очистки белка. Широкий спектр размеров колонок одного типа (рис. 4) позволяет масштабировать очистку белков с минимальными изменениями параметров.
Рисунок 4. AxiChrom — семейство колонок для очистки белка от пилотных до промышленных масштабов с внутренним диаметров 50–1600 мм. Колонки AxiChrom удачно сочетают стандартизацию и возможности индивидуальной настройки и совместимы со множеством современных носителей, например, со смолой для очистки антител MabSelect SuRe™.
Проведенные компанией Cytiva исследования подтвердили сходство характеристик белка, очищенного в лаборатории и на производстве. При этом объем препарата был масштабирован в 294 раза (рис. 5).
Рисунок 5. Сравнение хроматограмм, полученных с помощью ÄKTA pcc на колонках HiTrap (а) и на колонках AxiChrom 50 (б)
Материал предоставлен партнёром — компанией Cytiva
Результаты
Динамика интенсивности головной боли и сопутствующих симптомов в исследуемых группах
Анализ основных объективных и субъективных показателей, характеризующих интенсивность боли, сопровождающих симптомов и параметров повседневного функционирования, показал, что оба триптана столь же эффективны в качестве симптоматического средства купирования как боли, так и сопутствующих симптомов мигрени.
Так, применение Л.П. Мигрепам в дозе 2,5 мг сопровождалось не только снижением интенсивности и продолжительности головной боли в первые 2 ч, но и редукцией выраженности сопутствующих симптомов (фото- и фонофобия, тошнота, рвота) уже в первый час от начала купирования приступа, что приводило к уменьшению степени дезадаптации пациентов, повышению качества жизни и быстрому возвращению к социальной активности. Следует отметить, что выявляемые положительные изменения регистрировали в виде снижения интенсивности головной боли после приема Л.П. Мигрепам в течение первых 30 мин с 8,9 до 6,5 балла по ВАШ (р
<0,001), а через 2 ч до 1,9 балла по ВАШ (
р
<0,001), что соответствовало легкопереносимой боли или боли, которая не требует приема анальгетиков. За период наблюдения за пациентами в течение 24 ч возникновения повторного мигренозного приступа отмечено не было (рис. 1).
Рис. 1. Динамика интенсивности головной боли, фото- и фонофобии в приступе мигрени (по шкале ВАШ). На момент развернутого приступа 85% респондентов указывали на тошноту, 40% — на одно- или двукратную рвоту, в 70% случаев приступы сопровождались фото- и фонофобией. В первые 30 мин после приема Л.П. Мигрепам отмечали значительное снижение выраженности рвоты (только 10% пациентов указывали на ее наличие) и наблюдали полное ее прекращение в течение 60 мин после приема препарата. Отмечено 3-кратное снижение представленности тошноты в первые 60 мин после приема препарата — только 29% пациентов отмечали у себя сохраняющееся легкое субъективное ощущение тошноты, а через 2 ч приема Л.П. Мигрепам ощущение тошноты сохранялось у 10% пациентов (р
<0,001), с последующим полным купированием в пределах 2 ч (рис. 2).
Рис. 2. Динамика интенсивности тошноты и рвоты в приступе мигрени (по шкале ВАШ). Жалобы на фото- и фонофобию у пациентов уменьшились в течение 60 мин более чем на 50%, на сохраняющиеся сопутствующие симптомы указывали 21% респондентов, с полным регрессом жалоб в течение второго часа (
p
<0,001) (см. рис. 1).
Во 2-й группе, в которой применяли Л.П. Суматриптан в дозе 50 мг, интенсивность головной боли снижалась в течение первых 30 мин с 8,5 до 4,7 балла по ВАШ (p
<0,001). К концу первого часа интенсивность головной боли составляла в среднем 2,4 балла, что соответствовало легкой головной боли, через 2 ч пациенты указывали на полное купирование приступа (
р
<0,001) (см. рис. 1). Наиболее распространенными сопутствующими мигренозной боли симптомами у пациентов 2-й группы, сопоставимо с 1-й группой, были тошнота (92%), фотофобия (85%), фонофобия (77%), рвота (46%). После приема Л.П. Суматриптан в первые 60 мин также получены достоверные результаты: снижение выраженности рвоты (полное купирование симптома в течение часа). На сохраняющиеся легкие позывы на тошноту указывали 33% респондента. Через 2 ч после приема Л.П. Суматриптан ощущение тошноты сохранялось у 8% пациентов (
p
<0,001), с последующим полным купированием сопутствующего симптома в течение 2 ч (см. рис. 2). Достоверные показатели получены в отношении таких частых симптомов, как фото- и фонофобия. Снижение фото- и фонобии возникало у пациентов в течение первых 60 мин (
p
<0,001). За период наблюдения в течение 24 ч за пациентами 2-й группы возобновление повторного мигренозного приступа отмечено не было (см. рис. 1). На основании полученных данных можно сделать предварительный вывод: 2,5 мг Л.П. Мигрепам облегчают течение приступа мигрени, снижая интенсивность боли и сопутствующие симптомы не позднее 2 ч после приема препарата, не уступая по эффективности Л.П. Суматриптан.
Динамика параметров индекса HIT-6 в исследуемых группах
Во время 1-го (исходного) визита среднее значение показателя степени влияния головной боли на общее состояние и качество жизни (индекс HIT-6) в обеих группах был сопоставим и соответствовал существенному влиянию мигрени на повседневную активность (см. табл. 2). Через 30 дней лечения (2-й визит) в 1-й группе отмечено снижение среднего значения по индексу HIT-6 до 51,7±5,0 балла (р
<0,001) и c дальнейшим уменьшением показателя к 60-му дню до 47,7±3,6 балла (
р
<0,001), что соответствовало низкому уровню влияния головной боли на повседневную жизнь. Во 2-й группе на 2-м визите индекс HIT-6 снизился с 55,9±8,9 до 52,2±7,8 балла (
р
<0,001), и к 3-му визиту данный показатель составил 45,6±5,6 балла (
р
<0,001). Различия в исследуемых группах к 3-му визиту достоверно не отличались (
р
<0,05) (см. рис. 3).
Рис. 3. Динамика параметров индекса HIT-6 в исследуемых группах.
Динамика шкалы MIDAS в исследуемых группах
В обеих исследованных группах к 3-му визиту на фоне лечения наблюдали достоверное умеренное снижение степени влияния повторяющихся приступов мигрени на повседневную жизнедеятельность. Ко 2-му визиту в 1-й группе значение по шкале MIDAS составило 26,8±8,2 балла (р
<0,005), и на 3-м визите — 22,6±9,1 балла (
р
<0,001). Не столь значительная, как ожидалось, продемонстрирована динамика по шкале MIDAS в 1-й группе в отличие от 2-й группы, где отмечено статистически значимое снижение показателя до 16,9±11,7 балла (
р
<0,001) (рис. 4).
Рис. 4. Динамика параметров шкалы MIDAS в исследуемых группах.
Динамика показателей индекса HALT в исследуемых группах
Кроме улучшения показателей, непосредственно характеризующих степень влияния головной боли на общее состояние и качество жизни пациентов, на фоне применения Л.П. Мигрепам наблюдали положительные изменения и других показателей, в том числе индекса HALT, отражающего время, потерянное из-за головной боли, и необходимость переоценки используемого медикаментозного лечения. На фоне лечения в 1-й группе отмечали сокращение среднего значения по шкале HALT ко 2-му визиту до 25,4±8,2 дня (р
<0,05) и к 3-му визиту до 20,2±6,6 дня (
р
<0,01). Во 2-й группе на 2-м и 3-м визитах также отмечено снижение индекса HALT с 22,4±7,4 до 14,3 ±4,9 дня в сравнении с исходным показателем (
р
<0,01). Различия в исследуемых группах к 3-му визиту достоверно несколько отличались во 2-й группе (
p
<0,01), однако оба показателя соответствовали значению среднего или умеренного ограничения повседневной активности из-за головной боли (рис. 5).
Рис. 5. Динамика параметров индекса HALT в исследуемых группах.
Динамика по данным анкеты MIGRAINE-ACT в исследуемых группах
В настоящем исследовании применение Л.П. Мигрепам вызвало у пациентов наибольшую приверженность и удовлетворенность качеством лечения. При обследовании больных удовлетворенность используемой ранее терапией приступов мигрени по данным анкеты MIGRAINE-ACT в обеих исследуемых группах на момент исходного (1-го) приема достоверных отличий не было выявлено. Однако через 30 дней на фоне приема Л.П. Мигрепам число пациентов, удовлетворенных лечением, составило 50% (р
<0,001). К 3-му визиту отмечено достоверное увеличение относительного числа пациентов, оценивающих качество своего лечения как «удовлетворительное», до 70% респондентов (
n
=21), что превышало значение при сравнительном анализе во 2-й группе, в которой купирование приступов осуществляли приемом Л.П. Суматриптан, относительное число пациентов, оценивающих свое лечение как «удовлетворительное», на 2-м визите составило 46% (
n
=14), а на 3-м — 62% (
p
<0,001) (рис. 6).
Рис. 6. Динамика субъективной оценки купирования приступов мигрени по данным анкеты MIGRAINE-ACT в исследуемых группах.
Динамика купирования 3 последующих приступов в исследуемых группах
В процессе терапии оценивали число пациентов с полным купированием трех последовательных приступов мигрени. В 1-й группе среди пациентов, которые использовали Л.П. Мигрепам, купирование 2 приступов из 3 отметили 31%. При этом 53% пациента указали на купирование всех 3 приступов. Во 2-й группе на фоне применения Л.П. Суматриптан число пациентов, отметивших купирование 2 атак из 3, составило 33%, что достоверно не отличалось от этого показателя в 1-й группе. На купирование 3 последовательных атак на фоне приема Л.П. Суматриптан указали 47% пациентов, что было достоверно ниже этого показателя в 1-й группе (p
<0,05). Процент пациентов, резистентных к обоим триптанам, было сопоставимым в обеих группах и составил 8 и 7, соответственно (табл. 3).
Таблица 3. Анализ купирования 3 последовательных приступов мигрени в исследуемых группах
Субъективно отмечена хорошая переносимость медикаментозной терапии обоими триптанами. Частота побочных реакций (тошнота, сухость во рту и парестезии в конечностях, ощущение тепла и жара) в группах достоверно не различалась и составила в 1-й группе 11,9%, во 2-й — 12,1%. Все побочные эффекты носили слабовыраженный характер, проходили самостоятельно и не требовали дополнительной терапии.
«Аймовиг» и конкуренты
Надо сказать, что в поле таргетной противомигренозной терапии у Novartis и Amgen уже появились серьезные конкуренты: Eli Lilly выпустила Emgality, а Teva Pharmaceutical — Ajovy. Эти препараты — гуманизированные моноклональные антитела, нацеленные на лиганд, а не на рецептор CGRP, и этим отличаются от «Аймовига», уступая последнему также как минимум в переносимости. При применении Ajovy 43–45% пациентов столкнулись с болью, покраснениями и зудом в месте инъекции, при использовании Emgality — 18% больных испытали подобные симптомы, а «Аймовиг» вызвал такие реакции только в 5–6% случаев. При этом «Аймовиг» еще и удобнее для использования, поскольку из трех перечисленных препаратов только он поставляется в виде автоинъектора — устройства, напоминающего инсулиновую шприц-ручку, — пользоваться которым надо лишь раз в месяц. Перечисленные преимущества, вкупе с тем, что «Аймовиг» стал первым таргетным препаратом для лечения мигрени и сразу же занял на рынке пустующую нишу, скорее всего обеспечат ему светлое финансовое будущее: по прогнозам экспертов, его доля на рынке в 2024 году составит $2 млрд, в то время как прогнозируемые доли конкурентов приблизительно вдвое меньше [20].
Успеху «Аймовига», по всей видимости, не сможет помешать даже крайне высокая цена ($575 в месяц по прайс-листу Amgen — правда, в США у многих пациентов препарат покрывается страховкой), которую, кстати, некоторые эксперты считают неразумной [11]. Компания проводит исследование «Аймовига» и в России, но когда препарат появится на рынке, сколько будет стоить и кем оплачиваться — пока неизвестно.
Литература
- Три поколения лекарств;
- Поиск лекарственных мишеней;
- Саноева М.Ж. и Саидвалиев Ф.С. (2016). Мигрень — вчера, сегодня, завтра. Современный взгляд на проблему. «Международный неврологический журнал». 8, 72–78;
- How a migraine happens. Johns Hopkins Medicine;
- Migraine headaches. (2018). WebMD;
- Paul L. Durham. (2006). Calcitonin Gene-Related Peptide (CGRP) and Migraine. Headache
.
46, S3-S8; - What to know about the new anti CGRP migraine treatment options. (2018). American Migraine Foundation;
- Silberstein S.D. (2016). Мигрень. Справочник MSD;
- Migraine triggers: your personal checklist. (2019). WebMD;
- Русакова Е. (2018). FDA одобрило препарат для предотвращения мигрени. N+1;
- Kolata G. (2018). F.D.A. approves first drug designed to prevent migraines. The New York Times;
- Theo Vos, Amanuel Alemu Abajobir, Kalkidan Hassen Abate, Cristiana Abbafati, Kaja M Abbas, et. al.. (2017). Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2021. The Lancet
.
390, 1211-1259; - Francesca Puledda, Kevin Shields. (2018). Non-Pharmacological Approaches for Migraine. Neurotherapeutics
.
15, 336-345; - Doodipala Samba Reddy. (2013). The pathophysiological and pharmacological basis of current drug treatment of migraine headache. Expert Review of Clinical Pharmacology
.
6, 271-288; - Ogbru A. and Ogbru O. Prescription migraine medications. RxList;
- Boyce S., Ali Z., Hill R.G. (2001). New developments in analgesia. Drug Discovery World;
- Азимова Ю.Э. (2017). Триптаны: эра специфического лечения мигрени. «Нервные болезни». 1, 10–14;
- Ameri M. and Lewis H. (2018). The evolution of transdermal drug delivery and treating migraine. Drug Discovery World;
- Migraine medications. (2013). TMedWeb;
- Дмитриев Р. (2019). «Аймовиг» превратит хроническую мигрень в эпизодическую. «Мосмедпрепараты»;
- Aimovig (erenumab) for the treatment of episodic migraine. Clinical Trials Arena;
- Хоружая А. (2018). Новый препарат против мигрени выходит в продажу. «Нейроновости»;
- Таргетная терапия — прицельный удар по болезни.